Біофізика і біомеханіка - В. С. Антонюк - 2012
Розділ 1.ОСНОВИ БІОМЕХАНІКИ
1.4.Будова та властивості біологічних рідин. Поняття біореології
Зі зниженням температури та зменшенням об’єму газ переходить у рідкий стан, який є проміжним між газоподібним і твердим. Стан речовини змінюється залежно від температури: за низьких температур відбувається фазовий перехід у твердий стан (кристалізація), а за високих - у газоподібний (випаровування).
Відстань між молекулами речовини, що перебуває в рідкому стані, суттєво менша, ніж між молекулами газу, тому для рідин значущими є сили міжмолекулярної взаємодії, які утримують молекули рідини одна
біля одної тривалий час. У рідині існують скупчення (кластери) атомів і молекул, які мають певну впорядкованість. Рентгенівські дослідження показали [6], що мікроструктура рідини більше наближена до твердих тіл, ніж до газів. У рідинах не тільки утворюються і руйнуються кластери, але й відбуваються флуктуації руху маси в мікрооб’ємах рідини.
Для рідин характерний близький порядок розміщення частинок, зокрема частинок, що перебувають на невеликій, порівняно з міжмолекулярною, відстані від заданої частинки. Зі збільшенням відстані цей порядок зникає, тоді як для кристалічних тіл упорядкованість зберігається в значних об’ємах (далекий порядок).Усе це в цілому зумовлює фізико- механічні властивості рідини, такі, як плинність, мала стисливість, велика самодифузія тощо.
Числове значення коефіцієнта стисливості К для більшості рідин становить 0,2... 1,5 ГПа-1. Тому в більшості випадків рідину можна вважати нестисливою.
Як і гази, рідини набувають форми судини, в якій вони містяться, не мають далекого порядку розміщення частинок; подібно до твердих тіл займають певний об’єм, мають велику густину і малу стисливість.
У цілому будову рідин вивчено ще недостатньо. Згідно з найпоширенішою теорією Я. І. Френкеля [100] віддалені від критичної точки молекули рідини здійснюють нерегулярні коливання із середньою частотою 1/v0 біля положення рівноваги, час від часу перескакуючи в нове положення на відстань між сусідніми частинками.
Джерелом енергії активації є тепловий рух сусідніх молекул, тому частота перескоків різко зростає із підвищенням температури, що спричиняє значне зменшення в’язкості рідини. Так, для води підвищення температури від 0 до 70 °С зумовлює пониження в’язкості в 4,5 разу.
Теплоємність рідини мало відрізняється від теплоємності твердої фази поблизу точки плавлення і залежить від молекулярної структури. Рідини з великою молекулярною масою мають звичайні значення теплоємності.
Аморфні тверді тіла (наприклад, скло, смоли) за своїми властивостями ближчі до рідин, ніж до твердих тіл. По суті аморфні тіла є переохолодженими рідинами з дуже низькими значеннями коефіцієнта в’язкості і тривалим часом релаксації [36].
Рідини зазвичай ізотропні, тобто мають однакові властивості в усіх напрямках. Виняток становлять рідкі кристали - рідини, що складаються з подовжених, упорядкованих орієнтованих молекул, взаємне розміщення яких, так само, як і молекул звичайних рідин, не мають далекого порядку.
Однією з основних біологічних рідин є кров, яка складається з двох основних компонентів - плазми і завислих у ній формених елементів. Формені елементи крові дорослої людини становлять близько 40.. .48 %, а плазма - 52.60 % [103]. Це співвідношення називають гематокрит- ним числом (від грец. haima - кров, kritos - показник).
Плазма крові містить воду і розчинені в ній речовини - білки та інші органічні й мінеральні сполуки. Понад 90 % плазми - вода. Плазма містить і гази, зокрема кисень і вуглекислий газ. У плазмі крові розчинені також живильні речовини (зокрема, глюкоза і ліпіди), гормони, вітаміни, ферменти і проміжні та кінцеві продукти обміну речовин, а також неорганічні йони.
Аналіз експериментальних та літературних даних [42-45] розкриває механізм виникнення особливих властивостей води. Уже сам склад хімічної формули води є незвичайним - два газоутворені елементи, об’єднавшись у відповідних співвідношеннях, та ще з вибухом, утворюють рідку речовину без кольору, запаху, яка весь час скорочується та розширюється за рахунок коливальних рухів атомів, що перебувають на визначеній відстані один від одного, постійно змінюючи на дуже малу величину не тільки цю відстань, але й кут між атомами водню та атомами кисню. Молекула води має вісім валентних електронів: два від кожного атома водню та шість електронів, що містяться на валентних орбіталях атома кисню. Кожен атом водню віддає свій єдиний електрон на
утворення валентного зв’язку, зв’язуючи по одному валентному електрону атома кисню. Як результат утворення валентного зв’язку з атомом кисню з’являються вільні протони, що осцилюють на рівноважній відстані від атомів кисню. У свою чергу, атом кисню, який віддав два із шести валентних електрони на утворення валентного зв’язку з двома атомами водню, утворює з тих електронів, що залишилися, дві зв’язані пари електронів, які отримали назву неподілених пар електронів. До цих не- поділених пар електронів прямують протони молекули води, розгортаючи кожну молекулу води так, щоб протони однієї молекули води немовби притягували неподілені пари електронів атомів кисню іншої молекули води, утворюючи майже фіксовану просторову конфігурацію, для якої характерний кооперативний характер взаємодії, і так же миттєво руйнується, як і утворилась (рис. 1.11). Зниження температури та утворення льоду дозволяє зафіксувати такі просторові утворення, які отримали назву «лід І», «лід II». Досі вважають, що відстань між атомами однієї молекули води та атомами кисню іншої молекули води впливає на спектральні параметри води і змінює розміщення ліній в оптичній ділянці спектра. Така гіпотеза зумовила виникнення донорно-акцепторної теорії водневого зв’язку, що на деякий час загальмувала розвиток інших моделей структурної будови води, аби пояснити наявність стрибкових змін фізичних та зв’язаних з ними спектральних параметрів води. Чому, наприклад, лід має меншу густину, ніж вода, і розширюючись, руйнує посудину, в якій містилася вода.
Рис. 1.11. Кластерна модель структурованої води
Використовуючи значення ентальпії, можна отримати такі значення теплоти реакцій у процесі утворення води (кДж/моль):
![]()
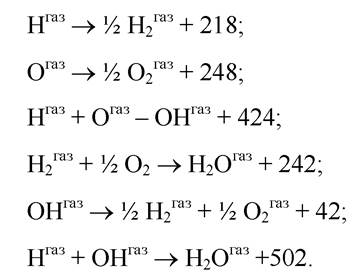
Отже, якщо послідовно розриваються два ОН зв’язки в молекулі води, енергія дисоціації першого з них дорівнює 502 кДж/моль, тоді як другого - лише 424 кДж/моль. Середнє з цих двох значень 463 кДж/моль і є тим значенням енергії зв’язку ОН, що наведено вище. Щоб з’ясувати, які структурні особливості зумовлюють таку відмінність, треба дослідити електронну структуру Н2О, ОН та О (електронна структура атома водню 1S— 2S не залежить від того, першим чи другим вилучається він з молекули, через що його структура не може визначати різницю енергії дисоціації двох зв’язків —О—Н—). Молекула води містить дві неподілені пари електронів на атомах кисню, причому одній відповідає 2^-орбіталь, а другій — 2р-орбіталь. Дві інші 2р-орбіталі атома кисню утворюють два ОН-зв’язки:
![]()
Кожен зв’язок здійснюється парою електронів з протилежними спінами. Їх можна уявити електронами, що міняються місцями у просторі між двома атомами. Радикал ОН, що утворюється внаслідок усунення одного з атомів водню з молекули води, має електронну структуру, яка містить знову дві неподілені пари електронів на 2s- і 2р-орбіталях атома кисню. Одна з 2р-орбіталей, що залишилася, як і раніше, бере участь в утворенні О—Н- зв’язку, а друга зайнята неспареним електроном. Орієнтація спіну неспареного електрона може бути як в додатному, так і від’ємному напрямку, при цьому енергія в обох напрямках буде однаковою, оскільки всі інші електрони в молекулі спарені.
Якщо вилучається другий атом водню, лишається атом кисню О-, що має неподілені пари електронів на 2s- і 2р-орбіталях та два неспарені електрони на двох інших 2р-орбіталях. Якби ці два неспарені електрони були зв’язаними електронами, то їх спіни з однаковою імовірністю були б паралельними або антипаралельними. Проте в атомі кисню паралельна орієнтація спінів приводить до триплетного стану 3р, а антипаралельна - до двох синглетних станів d та s. Тут треба враховувати наявність взаємодії електронів, що отримала назву зв’язку Рассела- Саундерса, ls-зв’язку, коли спіни електронів в атомі можуть утворювати результативний спін і визначатися як електронно-спінове квантове число s. Аналогічним чином орбітальні моменти кількості руху декількох електронів можуть утворювати результативну величину, що характеризується як орбітальне квантове число /, і нарешті утворювати вектори повного спінового моменту та повного орбітального моменту - всіма можливими способами, що становить повний момент імпульсу системи, якому відповідає квантове число j. Принцип Паулі накладає обмеження у тому випадку, коли два електрони мають однакові значення головного й азимутального квантових чисел. Взаємодія електронів в атомі кисню така, що стан з паралельними спінами (тобто стан максимальної мультиплетності, правило Хунда) стає більш стабільним, ніж стан з антипаралельними спінами. Як наслідок, основним станом атома кисню є триплетний стан 3d. Стабілізувальна взаємодія двох електронів з паралельними спінами в атомі кисню зменшує енергію дисоціації першого зв’язку порівняно з енергією дисоціації другого зв’язку молекули води.
Аналіз спектральних досліджень води та розчинів неорганічних солей [45] дозволяє переглянути погляди на фізичні процеси, які відбуваються у воді, їх пояснення та використання, запропонувати моделі побудови води та їх здатність утворювати, нагромаджувати, запам’ятовувати та передавати інформацію. Вода має велике значення дипольного моменту - 1,8546 Дебая, що визначається не тільки моментами валентних зв’язків, але й наявністю двох неподілених пар електронів у атомі кисню. Спектральні вимірювання дозволяють дійти висновку, що під час електронно-молекулярного переходу складова дипольного моменту змінюється мало на відміну від валентних зв’язків і дещо більше змінюється складова дипольного моменту відносно неподілених пар електронів. Протони містять позитивний електростатичний заряд, весь час змінюють своє положення унаслідок коливань - то наближаючись, то віддаляючись від атомів кисню молекул води, кожна з неподілених пар яких розгорнена назустріч протонам інших молекул води. Створюється не тільки електростатична, але й механічна взаємодія набагато більшого за розмірами та масою протона з неподіленими парами електронів атомів кисню молекул води (рис. 1.12).
Рис. 1.12. Схема механічної взаємодії протона з неподіленими парами електронів атомів кисню молекул води
На цей процес впливають також електромагнітні поля сусідніх молекул води. В результаті такої складної взаємодії змінюється стан самих неподілених пар електронів (може змінюватися мультиплетність). Відомо, що мультиплетність змінюється внаслідок дії магнітного (ефект Зеємана), електричного (ефект Штерка), та механічного (ефект П’єра Кюрі) полів. Кожен з таких станів електронів відрізняється один від одного ще й об’ємом, тобто переходи з одного стану до іншого супроводжуються зміною об’єму. Відомо також, що для однієї молекули води зміна мультиплетності неподілених пар потребує великої за величиною енергії (близько 3 еВ), що досягає межі руйнування валентних зв’язків, але якщо врахувати полімерний характер структур, поляризацію молекул води, кооперативний характер міжмолекулярної взаємодії у рідкій воді, а також складні електростатичні, електромагнітні та механічні взаємодії, слід очікувати зниження енергії розщеплення електронних рівнів, на яких перебувають неподілені електронні пари атомів кисню молекули води до 0,5...1,5 еВ. Наслідком електронно-коливальних переходів у молекулах води в рідкому стані, взаємодії енергетичних рівнів, розщеплення енергетичних рівнів, що зайняті неподіленими парами електронів атомів кисню в молекулах води, на декілька електронних рівнів, електрони неподіленої пари можуть переходити з одного енергетичного рівня на інший, як ноти по нотних лініях (рис. 1.13). Умовно це можна зобразити так:![]() Такі переходи супроводжуються змінами всіх фізичних параметрів води (густини, об’єму, електропровідності, поляризації, стискання, розширення) та діелектричної сталої, яка і є тією енергією, що витрачається на розщеплення енергетичних рівнів, зайнятих неподіленими парами електронів не тільки у воді, а взагалі в усіх діелектриках. Для рідкої чистої води такі зміни не є великими, проте їх можна виміряти цілком доступними спектральними методами. Дія на воду зовнішніх (температури, механічних, магнітних, електричних, електромагнітних полів) та внутрішніх (розчину у воді солей, газів) чинників може стабілізувати ту або іншу структуру води, зробивши її більш доступною для дослідження (наприклад, різке зниження температури викликає різку зміну об’єму води). Утворення солі- тонів також зумовлює зміну стану неподілених пар електронів атомів кисню в молекулах води.
Такі переходи супроводжуються змінами всіх фізичних параметрів води (густини, об’єму, електропровідності, поляризації, стискання, розширення) та діелектричної сталої, яка і є тією енергією, що витрачається на розщеплення енергетичних рівнів, зайнятих неподіленими парами електронів не тільки у воді, а взагалі в усіх діелектриках. Для рідкої чистої води такі зміни не є великими, проте їх можна виміряти цілком доступними спектральними методами. Дія на воду зовнішніх (температури, механічних, магнітних, електричних, електромагнітних полів) та внутрішніх (розчину у воді солей, газів) чинників може стабілізувати ту або іншу структуру води, зробивши її більш доступною для дослідження (наприклад, різке зниження температури викликає різку зміну об’єму води). Утворення солі- тонів також зумовлює зміну стану неподілених пар електронів атомів кисню в молекулах води.
Рис. 1.13. Схема переходу електронів неподіленої пари на енергетичні рівні
Про аномалії води є багато відомостей, як і взагалі про воду [64]. Не тільки геологи, але й біологи вважають рідку воду різновидом рідкого мінералу, а просторова кристалографічна ґратка льоду подібна за структурою до кварцу.
Основою спектрального аналізу в оптичному діапазоні є залежність одного зі спектральних параметрів - оптичної густини - від кількості речовини - чим більша кількість речовини, тим більша оптична густина. Під час аналізу водних розчинів неорганічних солей (хлориду натрію, калію, кальцію, магнію, нітратів та інших), що розчинюються у воді, ця закономірність порушується. Якщо поступово розводити насичений розчин солі за стандартних умов водою, тобто збільшувати кількість води у розчині, оптична густина води - поглинання електромагнітного випромінювання, не тільки не збільшується, як цього слід очікувати, але й зменшується, потім знову збільшується, тобто спостерігається відхилення від установлених закономірностей, на яких і ґрунтуються спектральний аналіз, нелінійна залежність зміни оптичної густини від концентрації (вмісту води у розчині солі).
Білки зазвичай не розчиняються у чистій воді, але розчиняються у розчинах неорганічних солей. Проте максимум на кривій залежності величини оптичної густини води від зміни концентрації солі, розчиненої у воді, потрапляє в діапазон тих концентрацій, за яких білки розчиняються у розчині солі, причому концентрація усіх солей, що досліджувалися, однакова. Якщо крива такої залежності має мінімум, то в розчині такої солі білки не розчиняються (наприклад, хлорид алюмінію).
Структура води, на перший погляд, досить проста. Кожен з двох атомів водню перебуває на певній відстані від атома кисню і всі атоми здійснюють коливальні рухи відносно стану рівноваги у площині молекули води та кута, або виходять з цієї площини. Такі коливання називають валентними та деформаційними (кутовими). Їх енергія пропорційна частоті або довжині хвиль електромагнітного поля, потрапляє і може бути виміряна в інфрачервоній (оптичній) ділянці спектра у вигляді смуг поглинання електромагнітного випромінювання, положення яких відповідає енергії цього молекулярного коливання, тобто в цьому випадку - групи О-Н у молекулах води. Форма таких смуг, їх висота та ширина залежать від фізичних параметрів молекул досліджуваної речовини.
Відмінність між формами смуг поглинання, що зумовлюється зміною концентрації, температури та іншими факторами, дозволяє визначати фізичні параметри молекул та речовини в цілому. Якщо змінювати вид солей, що вимірювалися у водному розчині, та їх концентрацію у воді, то зміниться форма смуг поглинання інфрачервоного випромінювання, що спричиняє першу спектральну аномалію, але такі самі зміни спостерігаються як для смуг поглинання, зумовлених лінійними валентними коливаннями у площині, так і для смуг поглинання, викликаних деформаційними коливаннями, що виходять з площини молекули води. Природа цих коливань різна, проте ті зміни, що спостерігаються у спектрах води в розчинах солей, однакові для досить великої кількості досліджених солей, що й дозволяє константувати спектральну аномалію в молекулах води.
Характер змін дає змогу встановити таке: якщо неорганічні солі розчиняються у воді і лінійно змінюється їх концентрація, відбувається нелінійна зміна всіх фізичних параметрів молекул води - густини, об’єму, діелектричної проникності. Цікавим є те, що відчутної зміни розміщення смуг поглинання на шкалі частот не спостерігається, тоді як форма смуг поглинання значно змінюється, що свідчить про значну зміну електронного стану в молекулах води, але не тих, що беруть участь в утворенні смуг поглинання молекул води, хоча й перебувають на валентній орбіті атомів кисню.
Таким чином, детальне вивчення спектральних даних дозволяє наблизитися до розуміння складних процесів, що відбуваються у самих молекулах води під час їх взаємодії, та зміни, які відбуваються під час взаємодії електромагнітних полів молекул води з електричними, магнітними, електростатичними та механічними полями, які створюють катіони та аніони солі під час розчинення у воді та в разі зміни їх концентрацій.
Ці властивості води використовує все живе у природі: живі організми - для транспортування іонів через мембрани, рослини - зі зниженими густиною та в’язкістю для руху по стеблах. Якщо змінюється поляризація води, то відбувається обмін речовин та ріст тканин. Тобто вода під дією електромагнітних та механічних полів, а також розчинених у ній солей стає своєрідним підсилювачем, резонатором. Це підсилює розщеплення енергетичних рівнів та впорядковує їх взаємодію, що змінює фізичні параметри води та сприяє функціонуванню живих організмів та рослин.
Відомі дотепер органічні рідини і рідкі кристали містять атоми з неподіленими парами (наприклад, кисень, азот, хлор, фтор тощо), які в рідкому стані є середовищами, що легко деформуються, а також дуже чутливі до зовнішньої дії полів - температурних, механічних, магнітних, електричних, електромагнітних, що й зумовлює їх широке використання в радіоелектроніці та інших галузях науки і техніки.
Реологія - наука про рух та деформацію різних реальних матеріалів. Одним з основних її завдань є розроблення математичних моделей для опису процесів руху та деформації середовищ з різними фізико- механічними властивостями. Такі моделі мають вигляд реологічних рівнянь, які пов’язують внутрішнє напруження в суцільному середовищі з кінематичними характеристиками. У СРСР реологічними моделями займалися провідні вчені-механіки, такі, як академік А. Ю. Ішлінський, професор Д. Д. Івльов й ін. [31; 54; 54].
Для опису реологічних моделей [57] використовують реологічні діаграми, в основу яких покладено ідею про те, що реологічні властивості різних матеріалів можна подати як об’єднання декількох елементарних властивостей, а просту модель такого складного матеріалу - у вигляді схеми з’єднаних елементарних моделей. Схеми деяких елементарних і складних реологічних моделей показано на рис. 1.14.
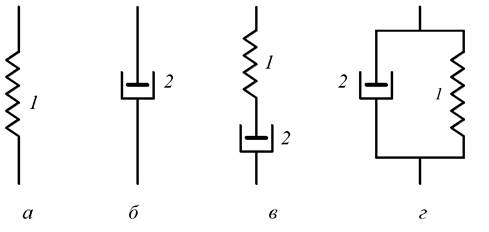
Рис. 1.14. Основні реологічні моделі біоматеріалів: а - пружне тіло; б - в’язке середовище; в - послідовне з’єднання в'язкопружного тіла (еластинове волокно); г - паралельне з’єднання в’язкопружного тіла (колагенове волокно);
1 - пружний елемент; 2 - поршень
Крім моделі пружного тіла, імітованої пружинкою (рис. 1.14, а), моделі в’язкого середовища, імітованої поршнем (рис. 1.14, б), складної моделі в’язкопружного тіла з різними проявами впливу пружності і в’язкості речовини (рис. 1.14, в і г), можуть бути і набагато складніші моделі. За допомогою набору елементарних моделей можна отримати моделі певних матеріалів. Наприклад, для в’язкопружної рідини трьохелементна діаграма відрізняється від складеної з тих самих елементів трьохелементної діаграми в’язкопружного твердого тіла (рис. 1.15).
Як можна бачити з рис. 1.15, елемент в’язкості в діаграмі рідини такий, немовби він є основною характеристикою матеріалу (він наявний в кожному відгалуженні), при цьому прикладене навантаження змушує матеріал текти. На діаграмі твердого тіла елемент в’язкості та елемент пружності розміщені так, що в разі навантаження матеріал проявить основну властивість твердого тіла: за певного навантаження воно отримає відповідну деформацію, але не потече, як рідина.
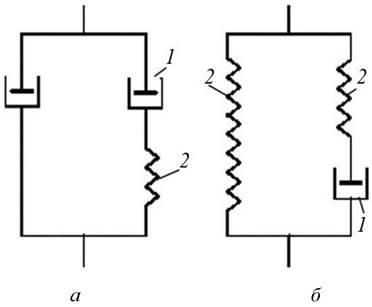
Рис. 1.15. Трьохелементна діаграма в'язкопружного середовища: а - рідина; б - тверде тіло; 1 - поршень; 2 - пружний елемент