СОВРЕМЕННАЯ БОТАНИКА - П. РЕЙВН - 1990
РАЗДЕЛ VII. ПОГЛОЩЕНИЕ И ТРАНСПОРТ ВЕЩЕСТВ У РАСТЕНИЙ
ГЛАВА 27. ДВИЖЕНИЕ ВОДЫ И РАСТВОРЕННЫХ ВЕЩЕСТВ В РАСТЕНИЯХ
Способность растения транспортировать органические и неорганические вещества, в том числе воду, необходима как для его нормального функционирования, так и для поддержания формы и структуры. В первой части этой главы мы рассмотрим поступление воды и растворенных веществ из почвы к надземным частям растения. Затем, в конце главы, мы обсудим, каким образом растворимые вещества и вода перемещаются из мест, где происходит фотосинтез, в остальные части растения. Вначале мы остановимся на процессе транспирации, поскольку именно он обеспечивает перемещение воды в растении.
Движение воды в растениях
Транспирация
В начале XVIII в. английский врач С. Хейлс заметил, что растения поглощают значительно больше воды, чем животные. Он установил, что при пересчете на единицу массы одно растение подсолнечника «всасывает» и «выпотевает» каждые 24 ч в 17 раз больше воды, чем человек (рис. 27-1). В самом деле, общее количество воды, поглощаемой растением, огромно — много больше того, которое используется животным, сравнимым по весу. Животному требуется меньше воды потому, что она рециркулирует в его организме в составе плазмы крови и других жидкостей. У растений более 90% воды, поглощенной корнями, поступает в атмосферу в виде водяного пара (табл. 27-1). По определению этот процесс, называемый транспирацией, представляет собой потерю водяного пара любой частью растения, хотя самые главные органы транспирации — листья.
Рис. 27-1. Схематическое изображение растения подсолнечника, которое использовал Хейлс в своих работах по изучению движения воды в растениях. Хейлс обнаружил, что большую часть воды, которую растение «всасывает», оно затем теряет в результате «потения»

Таблица 27-1. Потеря воды в результате транспирации одним растением за вегетационный период

Почему же растения теряют так много воды в процессе транспирации? На этот вопрос можно ответить, рассмотрев фотосинтез — основной процесс, происходящий в листьях, который обеспечивает питательными веществами все растение. Энергия, необходимая для фотосинтеза, поступает от Солнца. Поэтому для максимального фотосинтеза растение должно развернуть и подставить солнечному свету максимальную поверхность. Но для фотосинтеза необходим не только свет — хлоропластам нужна и двуокись углерода. В большинстве случаев двуокись углерода легкодоступна растению из окружающего воздуха, но попасть в клетку (посредством диффузии) она может только в растворенном состоянии, поскольку плазматическая мембрана почти непроницаема для газообразной формы двуокиси углерода. Поэтому углекислый газ должен войти в контакт с влажной поверхностью клетки. Но как только вода поступает на поверхность листа, начинается испарение. Растения выработали целый ряд специальных приспособлений для ограничения испарения, но все они уменьшают приток двуокиси углерода. Другими словами, поглощение углекислоты для фотосинтеза и потеря воды в процессе транспирации представляют собой неразрешимое противоречие в жизни зеленого растения.
Поглощение воды корнями
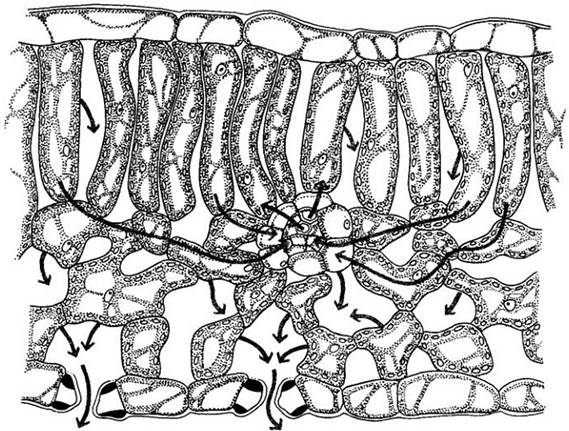
Корневая система служит для закрепления растения в почве и, самое главное, для удовлетворения огромных потребностей листьев в воде. Почти вся вода, которую растение забирает из почвы, проходит через самые молодые части корня. Поглощение воды происходит прямо через эпидерму корня. Корневые волоски, расположенные на несколько миллиметров выше кончика корня, создают гигантскую поглощающую поверхность (рис. 27-2; табл. 27-2). Из корневых волосков вода поступает через кору, эндодерму (самый внутренний слой коровых клеток) и перицикл к первичной ксилеме. Попав в проводящие элементы ксилемы, вода поднимается по корню и стеблю в листья.
Рис. 27-2. А. Первичный корень проростка редьки (Raphanus sativus), на котором видны корневые волоски. Б. Корневые волоски, окруженные почвенными частицами, удерживающими воду
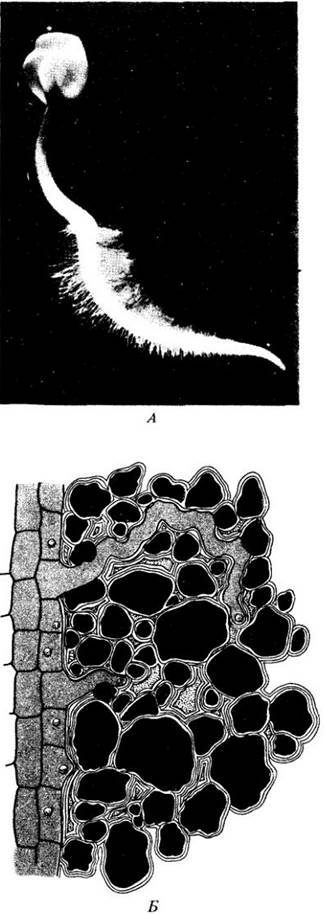
Таблица 27-2. Число корневых волосков на квадратный сантиметр поверхности корня у растений трех видов

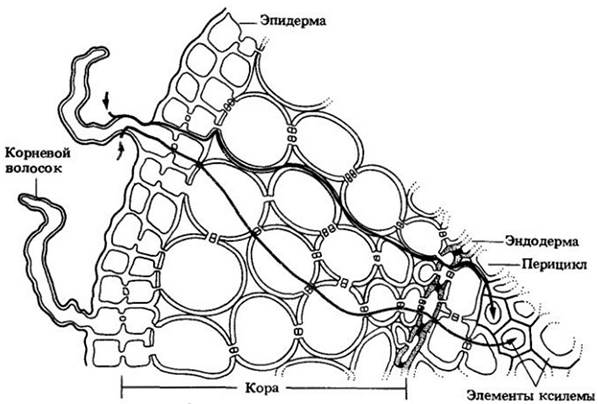
Вода и растворенные вещества перемещаются в растениях по апопластному (через клеточные оболочки), симпластному (от протопласта к протопласту через плазмодесмы) или смешанному путям. Основной путь воды через эпидерму и кору корня — апопластный (рис. 27-3). Однако в эндодерме вода должна пройти через плазматические мембраны и протопласты плотно упакованных эндодермальных клеток, потому что на их радиальных и поперечных стенках расположены водонепроницаемые пояски Каспари (см. гл. 21). Эндодерма, таким образом, создает осмотический барьер между корой корня и его центральным цилиндром.
Рис. 27-3. Основные пути перемещения воды (черная линия) и неорганических ионов (цветная линия) из почвы через эпидерму и кору в ксилемные, или проводящие воду, элементы корня. Вода движется в основном по апопласту, пока не достигнет эндодермы, где апопластное движение перекрывается поясками Каспари. Пояски Каспари заставляют воду на пути к ксилеме пересечь плазматические мембраны и протопласты эндодермальных клеток. Пройдя сквозь плазматическую мембрану на внутренней поверхности эндодермы, вода может снова пойти по апопластному пути до полостей элементов ксилемы. Неорганические ионы активно поглощаются эпидермальными клетками и затем перемещаются по симпласту через кору в паренхимные клетки, из которых они перекачиваются в элементы ксилемы
В периоды сильной транспирации вода, окружающая корневые волоски, может расходоваться так быстро, что почва иссушается и вода начинает поступать к корневым волоскам через мелкие почвенные поры с некоторого расстояния. В целом корни «находят» воду по мере роста, хотя в сухой почве они расти нс будут. В нормальных условиях корни яблони, например, вырастают в среднем на 3 — 9 мм в день, корни степных трав могут вырасти более чем на 13 мм в день, а корни кукурузы — в среднем на 52 — 63 мм в день. Такой быстрый рост может иметь впечатляющий результат: четырехмесячное растение ржи (Secale cereale) имеет около 10 000 км корней и много миллиардов корневых волосков.
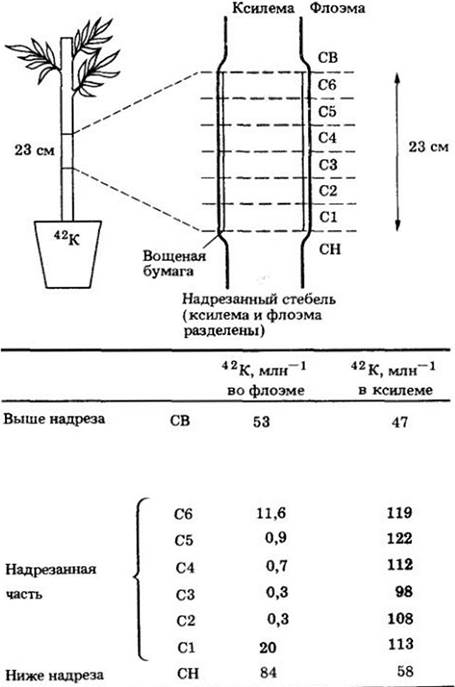
Транспирационный ток помимо обеспечения побега водой снабжает его еще и неорганическими ионами (рис. 27-4). После того как ионы поглощаются наружными клетками корня, они переносятся через кору и секретируются в ксилему. В процессе транспирации ионы быстро разносятся по растению.
Рис. 27-4. Радиоактивный калий (42К), добавленный к почвенной воде, показывает, что восходящий ток воды и неорганических ионов идет по ксилеме. Между ксилемой и флоэмой была вставлена вощеная бумага для предотвращения латерального перемещения изотопа. Относительные количества радиоактивного калия, обнаруженные в каждом сегменте стебля, приведены в таблице
Корневое давление и гуттация
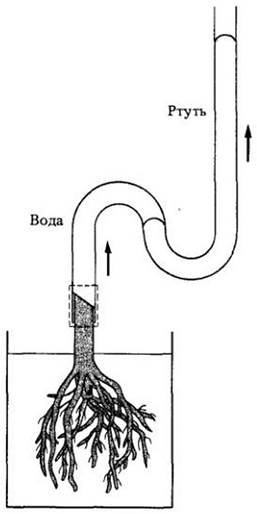
Когда транспирация очень слаба или отсутствует вообще, например, ночью, корневые клетки еще могут перекачивать ионы в ксилему. Поскольку проводящая ткань корня окружена эндодермой, ионы не могут выйти из ксилемы. В результате водный потенциал (см. гл. 4) ксилемы становится более отрицательным и по закону осмоса вода устремляется в ксилему через окружающие клетки. Таким образом создается положительное давление, называемое корневым давлением, которое заставляет воду и растворенные ионы подниматься вверх по ксилеме (рис. 27-5).
Рис. 27-5. Демонстрация корневого давления в срезанном основании растения. Поглощение воды корнями вызывает подъем ртути в трубке. Данный метод демонстрирует давление в 3 — 5 бар
Похожие на росу капельки воды на концах травинок демонстрируют ранним утром работу корневого давления (рис. 27-6). Эти капельки — не роса, которая конденсируется из водяного пара, находящегося в воздухе; они появляются на листьях в процессе гуттации (от лат. gutta — капля). Капли выделяются нс через устьица, а через гидатоды —специальные отверстия на концах и краях листьев (рис. 27-7). При гуттации вода буквально выжимается из листьев корневым давлением.
Рис. 27-6. Гуттация. Капельки воды на концах листьев ячменя (Hordeum vulgare) тоже свидетельствуют о наличии корневого давления. Эти капельки не конденсируются из водяного пара окружающего воздуха. Они выжимаются из листа через специальные отверстия — гидатоды, находящиеся на концах листьев

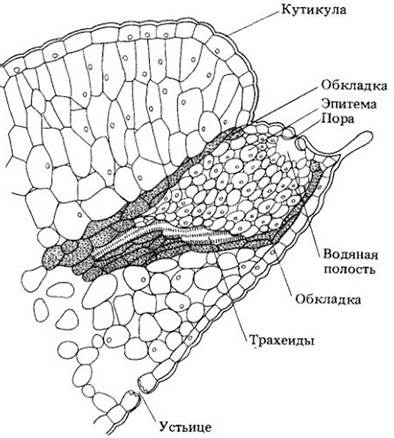
Рис. 27-7. Продольный срез через гидатоду листа Saxifraga lingulata. Гидатода состоит из терминальных трахеид окончания проводящего пучка, тонкостенной парасхимы (эпитемы) с многочисленными межклетниками и эпидермальных пор. Трахеиды прямо контактируют с эпитемой. Эпидермальные поры обычно представляют собой устьица, лишенные способности открываться и закрываться
Корневое давление наименее эффективно днем (когда передвижение воды, но растению наиболее интенсивно) и никогда нс бывает достаточным для подъема воды к вершине высокого дерева. Более того, у многих растений, к которым относятся хвойные, например, у сосны, корневое давление вообще не развивается. Таким образом, его, по- видимому, можно рассматривать как побочный эффект механизма закачивания ионов в ксилему и как дополнительный способ передвижения воды в побеге при особых условиях.
Пассивное поглощение воды
В периоды интенсивной транспирации ионы, аккумулированные в ксилеме корня, выносятся в транспирационном токе и осмотическое движение через эндодерму уменьшается. Корни при этом превращаются в пассивную поглощающую поверхность, через которую вода увлекается объемным потоком, образующимся в транспирирующих побегах. Некоторые исследователи считают, что практически все поглощение воды корнями транспирирующего растения происходит таким пассивным способом.
Передвижение воды
Вода поступает в растение через корни и выделяется в больших количествах через листья. Каким образом вода перемещается по растению, часто преодолевая большие расстояния по вертикали? Этот вопрос занимал многие поколения ботаников.
Основной путь, по которому поднимается вода, точно установлен. Вы можете проследить этот путь с помощью простого эксперимента. Поместите срезанный стебель в воду, подкрашенную безвредной краской (стебель лучше срезать под водой, чтобы воздух не попал в проводящие элементы ксилемы), и затем следите за перемещением жидкости в листья. Краска отчетливо выявит проводящие элементы ксилемы. Опыты с радиоактивными изотопами подтверждают, что изотоп и, по-видимому, вода действительно поднимаются по сосудам (или трахеидам) ксилемы. В опыте, показанном на рис. 27-4, ксилему осторожно отделили от флоэмы. Более ранние эксперименты, в которых подобного разделения не проводилось, давали неопределенные результаты из-за латерального движения из ксилемы во флоэму. Однако это латеральное движение, как показывают эксперименты, не является необходимым для общего передвижения воды и минеральных веществ из почвы в лист.
Таков путь, по которому движется вода, но каким образом осуществляется это движение? Логика подсказывает две возможности: вода выталкивается снизу или ее тянут сверху. (Третий вариант — наличие активных насосов, или «сердец», по ходу движения — предлагался время от времени, но больше всерьез ботаниками нс рассматривается.) Первая из указанных возможностей уже была исключена. Корневое давление, как указывалось выше, существует не у всех растений, а если оно и есть, то нс способно поднять воду к вершине высокого дерева. Поэтому мы останавливаемся на гипотезе, предполагающей, что вода «протягивается» через все растение (эту гипотезу подтверждают имеющиеся данные).
Механизм когезии-адгезии-натяжения
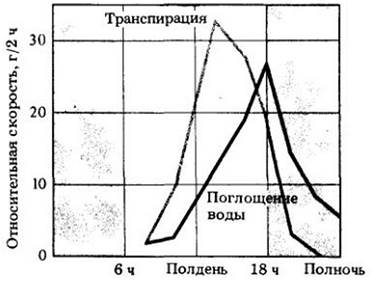
Когда во время транспирации вода испаряется с поверхности клеточных оболочек, ограничивающих межклеточные пространства внутри листа, она замещается водой из клеток, диффундирующей через плазматическую мембрану. Мембрана свободно пропускает воду, но непроницаема для растворенных веществ, находящихся в клетке. В результате концентрация веществ в клетке повышается, а водный потенциал снижается. Возникает градиент водного потенциала между этой клеткой и соседними, более насыщенными водой. Эти клетки в свою очередь отбирают воду у других, пока в конце концов «цепочка» не достигнет жилки и не установится натяжение воды в ксилеме. Из-за чрезвычайной силы сцепления молекул воды это натяжение существует на всем протяжении стебля до самых корней, так что вода вытягивается из них, продвигается по ксилеме и распределяется среди клеток, которые испаряют ее в атмосферу (рис. 27-8). В результате потери воды водный потенциал корней становится более отрицательным, что увеличивает их способность извлекать воду из почвы.
Рис. 27-8. Исследования перемещения воды в ясене (Fraxinus) показывают, что увеличение поглощения воды следует за увеличением транспирации. Эти данные подтверждают, что потеря воды создает силу, необходимую для ее поглощения
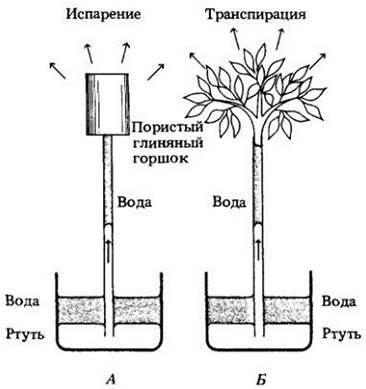
Теория передвижения воды известна как теория когезии (сцепления)-натяжения, поскольку перемещение воды зависит от силы сцепления молекул воды, которая позволяет ей выдержать натяжение (рис. 27-9). Однако эту теорию лучше было бы назвать теорией когезии-адгезии-натяжения, поскольку адгезия (прилипание) молекул воды к оболочкам трахеид и сосудов ксилемы и к оболочкам клеток листьев и корней так же важна для подъема воды, как когезия и натяжение. Клеточные оболочки, вдоль которых движется вода, в процессе эволюции превратились в поверхность, очень эффективно притягивающую воду, что дает максимальные преимущества для адгезии воды и создает условия, благоприятные для проявления се когезивности. Надежности системы способствует и малый диаметр проводящих элементов ксилемы — сосудов и трахеид, по которым передвигается вода.
Рис. 27-9. A. Простая физическая система, иллюстрирующая теорию когезии- адгезии-натяжения. Пористый глиняный горшок наполняется водой и прикрепляется к концу длинной тонкой стеклянной трубки, также заполненной водой. Заполненная водой трубка опускается нижним концом в ртуть, налитую в стакан. Вода испаряется через поры горшка и замещается водой, которая втягивается из трубки и поднимается по ней как непрерывный столб. По мере подъема воды в трубку втягивается ртуть и замещает воду. Б. Транспирация листьев приводит к потере воды, достаточной для создания подобного отрицательного давления. Поэтому теорию когезии-адгезии-натяжения часто называют «теорией транспирационной тяги»
Нет сомнения, что прочность на разрыв у воды достаточно высока и способна предотвратить разделение ее молекул под действием натяжения, необходимого для подъема воды по ксилеме высокого дерева. Например, было показано, что столб воды в тонкой капиллярной трубке выдерживает натяжение в -264 бар, а для подъема воды к вершине секвойи (Sequoia sempervirens) по расчетам требуется натяжение всего лишь около — 20 бар. Подсчитано, что прочность на разрыв у воды очень высока: между 1300 и 1500 бар, а возможно, даже 15 000 бар!
Как можно проверить теорию когезии-адгезии-натяжения? Способ ее прямой проверки заключается в измерении натяжения воды в ксилеме. Когда срезают ветвь странспирирующего дерева, то вода в сосудах резко отступает от края среза. Поместив ветвь в толстостенную камеру, можно приложить к ней такое давление, чтобы увидеть (при соответствующем увеличении), как мениски водяных столбов в сосудах поднимаются к поверхности среза (рис. 27-10). Давление, требующееся для возвращения воды к срезу, равно по величине натяжению воды, существовавшему в ветви до срезания. Результаты, полученные данным методом, полностью совпадают с предсказаниями теории когезии-адгезии-натяжения.
Рис. 27-10. Измерение натяжения воды в ксилеме. Ветвь, у которой хотят измерить натяжение в ксилеме, срезают и помещают в камеру для измерения давления. Когда ветвь срезают, ксилемный сок, который испытывал до этого натяжение, отступает в ксилему от поверхности среза. В камере повышают давление до тех пор, пока сок не появится на поверхности среза стебля. Предполагая, что равное дарение требуется для перемещения сока в обоих направлениях, считают, что положительное давление, необходимое для подъема сока к срезу, равно натяжению, существовавшему в ксилеме до того, как была перерезана ветвь
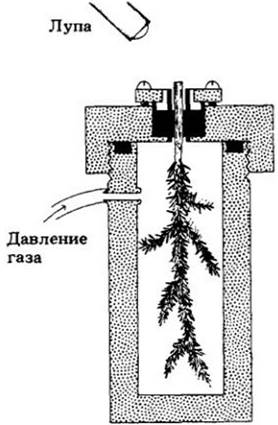
Вторая группа данных, находящихся в соответствии с этой теорией, показывает, что движение воды начинается с вершины дерева. Скорость ксилемного тока в разных частях дерева была измерена простым методом с использованием маленького элемента для нагревания в течение нескольких секунд содержимого ксилемы и чувствительной термопары для определения момента, когда нагретый ксилемный сок пройдет мимо фиксированной точки (рис. 27-11). Как показывает график, утром движение сока начинается сперва в ветвях, поскольку натяжение появляется ближе к листьям, а затем в стволе. Вечером скорость тока уменьшается сначала в ветвях, поскольку уменьшается потеря воды листьями, а затем в стволе. У деревьев с широкими сосудами (200 — 400 мкм в диаметре) наблюдается полуденный пик скорости от 16 до 45 м/ч (измерения на уровне груди человека), а у деревьев с узкими сосудами (50 — 150 мкм в диаметре) полуденный пик скорости ниже — от 1 до 6 м/ч.
Рис. 27-11. Способ измерения скорости движения сока. Маленький нагревательный элемент, введенный в ксилему, в течение нескольких секунд нагревает восходящий сок. Термопара, помещенная выше нагревательного элемента, регистрирует проходящую волну тема. Экспериментатор отмечает интервал между этими двумя событиями. Как видно на графике, утром увеличение скорости движения сока начинается сначала в ветвях (верхняя кривая), затем в стволе (нижняя кривая). Вечером скорость уменьшается сначала в ветвях, затем в стволе
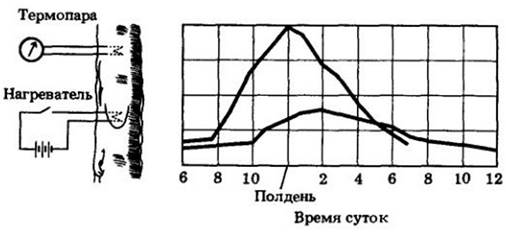
Третья группа данных получена в результате измерения суточных колебаний диаметра древесного ствола (рис. 27- 12). Сжатие ствола происходит из-за отрицательного давления в водных путях ксилемы. Молекулы воды, прилипая к стенкам сосудов, втягивают их внутрь. Когда утром начинается транспирация, сначала сжимается верхняя часть ствола, поскольку вода вытягивается из ее ксилемы прежде, чем может быть замещена водой из корней. Затем уменьшается в диаметре нижняя часть ствола. Позже в течение дня, когда снижается интенсивность транспирации, верхняя часть ствола расширяется раньше, чем нижняя.
Рис. 27-12. Дендрометр (слева) регистрирует небольшие суточные изменения диаметра древесного ствола. Одновременные измерения на двух разных высотах показывают, как видно на графике. что утром сжатие ствола происходит в его верхней части немного раньше, чем в нижней. Эти данные означают, что транспирация листьев «вытягивает» воду из ствола прежде, чем она может быть замещена водой из корней. Затемненные полосы обозначают ночное время
Подчеркнем, что энергию для испарения молекул воды — и тем самым для движения воды и минеральных веществ по растению — поставляет не растение, а непосредственно Солнце. Отметим также, что это движение возможно благодаря исключительной способности молекул воды к когезии и адгезии, которую растения так умело используют.
Регуляция транспирации
Когда двуокись углерода, необходимая для фотосинтеза, поглощается листьями, водяной пар поступает в атмосферу в результате транспирации, что может быть крайне опасно для растения. Эти два процесса неотделимы друг от друга, однако существует ряд специальных приспособлений, которые сводят к минимуму потери воды и в то же время благоприятствуют поглощению углекислоты.
Кутикула и устьица
Листья покрыты кутикулой, которая делает их поверхность в значительной степени непроницаемой как для воды, так и для двуокиси углерода. Лишь малая доля транспирируемой растением воды уходит через этот защитный наружный слой, а другая небольшая часть выходит через чечевички коры. Наибольшее количество воды при транспирации растение теряет через устьица (рис. 27-13). Устьичная транспирация включает два этапа: (1) испарение воды с поверхности клеточных стенок, ограничивающих межклеточные, или воздушные, пространства листа; (2) диффузию образовавшегося водяного пара из межклеточных пространств в атмосферу через устьица (см. рис. 27-18).
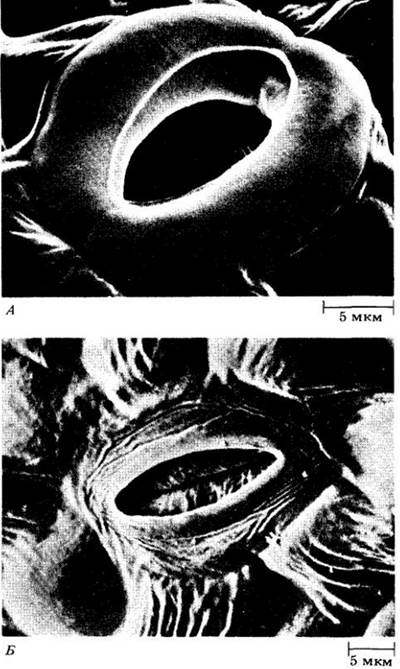
Рис. 27-13. На микрофотографиях. полученных с помощью сканирующего электронного микроскопа, видны открытое устьице в эпидерме листа огурца (Cucumis sativus) (А) и закрытое устьице в эпидерме листа петрушки (Apium petroselinum) (Б). Устьица ведут в воздушные полости листа, окруженные тонкостенными фотосинтезирующими клетками мезофилла. Воздушные полости насыщены водяным паром, который испаряется с поверхностей клеток мезофилла
Устьица — это мелкие отверстия в эпидерме. Каждое устьице окружено двумя замыкающими клетками, которые могут изменять свою форму и таким образом открывать и закрывать устьичную щель. Устьица имеются и в молодых стеблях, но их значительно больше в листьях. Число устьиц может быть довольно велико. Например, на один квадратный сантиметр поверхности листа табака приходится около 12 000 устьиц. Устьица ведут в воздушные полости листа, окруженные тонкостенными клетками мезофилла. Воздух этих полостей, составляющих от 15 до 40% общего объема листа, насыщен водяным паром, который удаляется с влажных поверхностей клеток мезофилла. Хотя устьица занимают около 1% всей площади листа, более 90% воды, транспирируемой растением, испаряется через них. Остальное теряется через кутикулу.
Закрывание устьиц нс только предотвращает потерю водяного пара листом, но, как указывалось выше, и прекращает доступ углекислоты в лист. Некоторое количество углекислоты, однако, образуется в растении в процессе дыхания, и пока имеется свет, эта углекислота может быть использована для поддержания фотосинтеза на очень низком уровне даже при закрытых устьицах.
Механизм устьичных движений
Устьичные движения обусловлены изменениями тургорного давления в замыкающих клетках. Открывание происходит, когда в замыкающих клетках активно накапливаются растворенные вещества. Накопление растворенных веществ приводит к поступлению воды в замыкающие клетки и созданию тургорного давления, превышающего таковое в побочных клетках. Закрывание устьиц обеспечивается обратным процессом: с уменьшением количества растворенных веществ в замыкающих клетках вода выходит из них и тур- горное давление падает. Таким образом, тургор поддерживается или исчезает в результате пассивного осмотического движения воды в клетки или из клеток по градиенту водного потенциала.
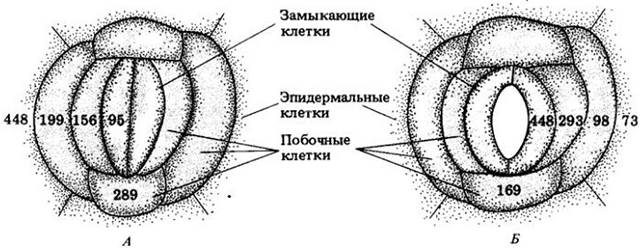
Градиент водного потенциала создается преимущественно ионами калия (К+). Ионы калия обнаружены в замыкающих клетках открытых устьиц более чем у 50 видов растений, включая САМ-растения, чьи устьица открыты ночью. Определение содержания калия в одной замыкающей клетке, проведенное специальным методом, показывает, что концентрация калия возрастает, когда устьица открыты, и падает, когда они закрыты. Побочные клетки служат резервуаром ионов калия. Градиент калия между замыкающими и побочными клетками существенно изменяется, что сопровождается осмотическим движением воды и вследствие этого изменением тургора (рис. 27-14).
Рис. 27-14. Изменение концентрации калия в устъичном комплексе (замыкающие и побочные клетки) и соседних обычных эпидермальных клетках листа коммелины (Commelinacommunis). Замыкающие клетки устьиц листа коммелины связаны с шестью побочными клетками — четырьмя латеральными и двумя терминальными. А. Концентрация калия в вакуолях разных клеток при закрытых устьицах. Б. Концентрация калия в разных метках при открытых устьицах. Для определения содержания калия в индивидуальных клетках использовались чувствительные к калию микроэлектроды
Вместе с положительно заряженными ионами К+, которые переносятся в таких больших количествах, для сохранения электрической нейтральности клетки должны перемещаться и отрицательно заряженные ионы (анионы). В этом отношении особенно велика роль двух анионов — хлорида и малата.
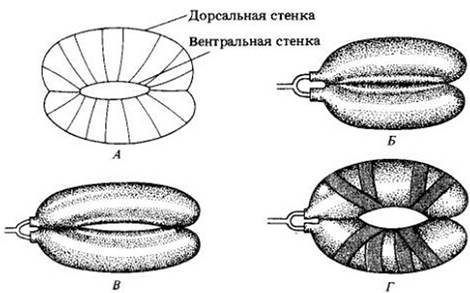
Структура оболочек замыкающих клеток играет решающую роль в движении устьиц. В процессе растяжения спаренных замыкающих клеток два фактора способствуют их изгибанию и таким образом открыванию устьичной щели. Один из них — радиальная ориентация целлюлозных микрофибрилл в оболочках замыкающих клеток (рис. 27-15, А). Эти радиальные мицеллы позволяют замыкающим клеткам удлиняться и одновременно не дают им расширяться. Второй ограничитель находится на концах замыкающих клеток, где они соединяются друг с другом. Их общая стенка почти не меняет свою длину во время открывания и закрывания устьиц. Поэтому увеличение тургорного давления заставляет внешние (дорсальные) стенки замыкающих клеток отодвигаться наружу по отношению к их общим стенкам. Когда это происходит, радиальные мицеллы вовлекают в это движение стенки, окаймляющие устьичную щель (вентральные стенки), и щель открывается. Рис. 27-15, Б — Г иллюстрирует результаты опытов с баллонами, которые проводились для подтверждения роли радиальных мицелл в движении устьиц.
Рис. 27-15. А. Схема пары замыкающих меток. Радиальные линии показывают расположение целлюлозных микрофибрилл в оболочках замыкающих клеток. Б — Г. Схема модели, используемой для изучения роли радиальных мицелл в открывании устьиц. Б. Два не до отказа наполненные газом баллона, склеенные вместе у концов. В. Те же баллоны под большим давлением. Видна узкая щель между ними. Г. Пара наполненных газом баллонов, перетянутых лентой, имитирующей радиальные мицеллы. Щель значительно шире, чем в предыдущем случае (см. В)
Факторы, влияющие на движение устьиц
Среди внешних факторов, влияющих на открывание и закрывание устьиц, потеря воды имеет наибольшее значение. Когда тургор листа падает ниже определенного критического уровня, неодинакового у различных видов растений, ширина устьичной щели становится меньше. Потеря воды перекрывает действие других факторов на устьица, но устьичные движения могут происходить и независимо от увеличения или уменьшения количества воды в растении. Наиболее замечательным примером этого служат наблюдающиеся у многих видов регулярные открывания устьиц утром и закрывания их вечером, которые происходят и при отсутствии изменений в снабжении растения водой.
В периоды водного дефицита у многих растений резко повышается содержание абсцизовой кислоты (АБК). «Подкормка» или обработка листьев АБК приводит к закрыванию устьиц в течение нескольких минут. Более того, влияние АБК на движение устьиц легко обратимо. Экспериментальные данные говорят о том, что выход растворенного вещества (К+) из замыкающих клеток начинается, когда в устьица попадает АБК, образовавшаяся в мезофилле и сигнализирующая устьицам о том, что клетки мезофилла испытывают недостаток воды. Механизм действия АБК на замыкающие клетки еще остается нераскрытым.
К другим факторам внешней среды, влияющим на движение устьиц, относятся концентрация двуокиси углерода, свет и температура. У большинства видов увеличение концентрации СO2 вызывает закрывание устьиц. Сила реакции на СO2 зависит от вида растения и степени водного стресса, от которого данное растение пострадало или страдает. У кукурузы (Zea mays) устьица могут отреагировать на изменение концентрации СО2 в течение секунд. Показано, что восприятие уровня СО2 происходит в замыкающих клетках.
У большинства видов устьица открываются на свету и закрываются в темноте. Частично это можно объяснить использованием СO2 в процессе фотосинтеза, что приводит к снижению содержания ее в листе. Однако свет оказывает и более прямое действие на устьица. Давно известно, что синий свет стимулирует открывание устьиц независимо от концентрации СO2. Например, протопласты замыкающих клеток лука (Allium сера) набухают в присутствии К+ при освещении синим светом. Пигмент, поглощающий синий свет (флавин или флавопротеин, локализованный в тонопласте и, возможно, в плазматической мембране), стимулирует поглощение ионов К+ замыкающими клетками.
Изменения в нормальном диапазоне температур (от 10°С до 25°С) оказывают небольшое влияние на движение устьиц, но подъем температуры выше 30 — 35°С может привести к их закрыванию. Закрывание устьиц, однако, можно предотвратить, поместив растение в воздух без углекислоты. Это свидетельствует о том, что эффект повышения температуры первоначально определяется изменением концентрации СO2 в листе. Повышение температуры приводит к усилению дыхания и соответственно к увеличению концентрации двуокиси углерода в клетках, что может быть действительной причиной закрывания устьиц в ответ на нагревание. Многие растения жаркого климата регулярно закрывают устьица в полдень, что можно объяснить, как влиянием температуры на концентрацию СO2, так и обезвоживанием листьев в результате того, что транспирационные потери воды превышают ее поглощение.
Устьица нс только реагируют на факторы внешней среды, но и демонстрируют суточные ритмы открывания и закрывания, которые контролируются, по-видимому, внутренними механизмами, т. е. устьица обнаруживают циркадианные ритмы (см. гл. 25).
Хотя устьица большинства растений открыты днем и закрыты ночью, это справедливо не для всех растений. Разнообразные суккуленты, в том числе кактусы, ананас (Ananascomosus) и представители семейства толстянковых (Crassulaceae), открывают устьица ночью, когда условия наименее благоприятны для транспирации. Путь фиксации СО2 у растений семейства Сrassulасеае принципиально не отличается от С4-пути фотосинтеза, как обсуждалось в гл. 7. Ночью, когда их устьица открыты, САМ-растения поглощают углекислоту и превращают ее в органические кислоты. Днем, когда устьица закрыты, углекислота отщепляется от органических кислот и используется в фотосинтезе.
Факторы, влияющие на интенсивность транспирации
Хотя открывание и закрывание устьиц — это основной фактор, определяющий скорость транспирации, на нее влияет и ряд других факторов как внешних, так и внутренних. Одним из самых важных можно считать температуру. Скорость испарения воды примерно удваивается при подъеме температуры на каждые 10°С. Однако испарение воды охлаждает листовую поверхность, поэтому ее температура не поднимается так быстро, как температура окружающего воздуха. Как указывалось, выше, устьица закрываются, когда температура превышает 30 — 35°С.
Влажность также имеет большое значение. Вода испаряется намного медленнее, если воздух уже насыщен водяным паром. Растения, произрастающие в тенистом лесу, где влажность обычно высока, щедро подставляют солнцу обширную листовую поверхность, поскольку их основная проблема — получение достаточного количества света, а нс недостаток воды. Напротив, растения степей или других открытых мест часто имеют узкие листья с относительно малой листовой поверхностью. Они получают столько света, сколько могут использовать, но постоянно находятся под угрозой чрезмерной потери воды.
Токи воздуха существенно влияют на скорость транспирации. В жаркий день ветерок охлаждает нашу кожу, унося водяной пар, который накапливается вблизи ее поверхности, и тем самым ускоряя испарение воды из тела. Точно так же ветер относит пары воды от поверхности листьев. Иногда, если воздух очень влажен, ветер может уменьшить интенсивность транспирации из-за охлаждения листа, однако сухой ветер резко усилит испарение. Листья растений открытых продуваемых пространств часто опушены. Считается, что волоски защищают листовую поверхность от действия ветра и уменьшают скорость транспирации, стабилизируя примыкающий к листу слой воздуха.
Недавно было высказано предположение, что основная роль чувствительности устьиц к СO2 заключается в том, чтобы вызывать их частичное закрывание при усилении скорости ветра. Ветер уносит водяной пар от листовой поверхности и одновременно доставляет к ней СO2. Таким образом, если устьица закрываются в ответ на увеличение концентрации СO2, они уменьшают интенсивность транспирации.
Передвижение неорганических питательных веществ в растениях
Поглощение неорганических питательных веществ
Поглощение, или абсорбция, неорганических ионов происходит через эпидерму корня. Современные данные показывают, что от эпидермы до эндодермы ионы проходят в основном симпластически. Передвижение ионов по симпластному пути начинается с их прохождения через плазматическую мембрану эпидермальных клеток. Затем ионы перемещаются из протопластов эпидермальных клеток в клетки первого корового слоя через плазмодесмы в эпидермальнокоровых клеточных оболочках (см. рис. 27-3). Радиальное перемещениие ионов продолжается по коровому симпласту — из протопласта в протопласт через плазмодесмы, через эндодерму в паренхимные клетки проводящего цилиндра путем диффузии. Этому передвижению, вероятно, способствуют клеточные токи цитоплазмы.
Вопрос о том, как ионы поступают в сосуды (или трахеиды) ксилемы из паренхимных клеток проводящего цилиндра, активно обсуждается. Высказано предположение, что ионы пассивно «вытекают» из паренхимных клеток в сосуды. Однако сейчас имеются серьезные доказательства того, что ионы секретируются в сосуды из паренхимных клеток путем активного мембранного транспорта с участием переносчиков (см. гл. 4).
Активное поглощение растворенных веществ
Минеральный состав клеток корня резко отличается от такового окружающей среды. Например, в одной работе было показано, что концентрация ионов калия в клетках корней гороха (Pisum sativum) в 75 раз выше, чем в питательном растворе. Подобным же образом результаты другого эксперимента свидетельствуют о том, что вакуоли клеток брюквы (Brassica napus var. napobrassica) содержат в 10 000 раз больше калия, чем наружный раствор.
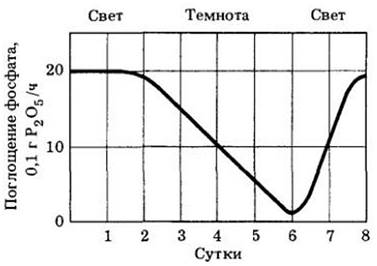
Поскольку вещества не могут диффундировать против градиента концентрации, становится ясно, что минеральные вещества поглощаются с помощью активного транспорта. В пользу этой гипотезы говорят факты, подтверждающие, что поглощение минеральных веществ — процесс, требующий энергии. Если, например, корни лишены кислорода или отравлены, в результате чего подавлено дыхание, то поступление минеральных веществ резко уменьшается. Точно так же, если растение затенить, то после истощения запасов углеводов оно перестанет поглощать соли и в конце концов будет даже выделять их в почвенный раствор (рис. 27-16). Следовательно, для транспорта ионов из почвы в сосуды ксилемы необходимо осуществление двух этапов активного мембранного транспорта с участием переносчиков: (1) поглощение ионов плазматической мембраной эпидермальных клеток; (2) секреция их в сосуды плазматической мембраной паренхимных клеток проводящего цилиндра.
Рис. 27-16. Скорость поглощения фосфата растениями кукурузы (Zea mays) падает почти до нуля после четырех суток непрерывной темноты. Она вновь начинает увеличиваться, когда растения выставляют на свет. Эти и другие данные показывают, что поглощение солей растениями — это процесс, требующий энергии
Трансмембранный потенциал
Активный транспорт ионов через плазматическую мембрану может привести к различию в электрическом заряде по обе стороны мембраны. Когда это происходит, между сторонами возникает напряжение, называемое трансмембранным потенциалом. Ион водорода Н+ является одним из главных катионов, участвующих в создании трансмембранного потенциала. При откачивании Н+ из клетки внутри нее возникает отрицательный потенциал. Образовавшись, трансмембранный потенциал может оказывать значительное влияние на последующее движение ионов. Например, внутриклеточный отрицательный потенциал будет привлекать положительно заряженные ионы, такие, как К+, и одновременно отталкивать отрицательно заряженные ионы, такие, как СI-.
Транспорт неорганических питательных веществ
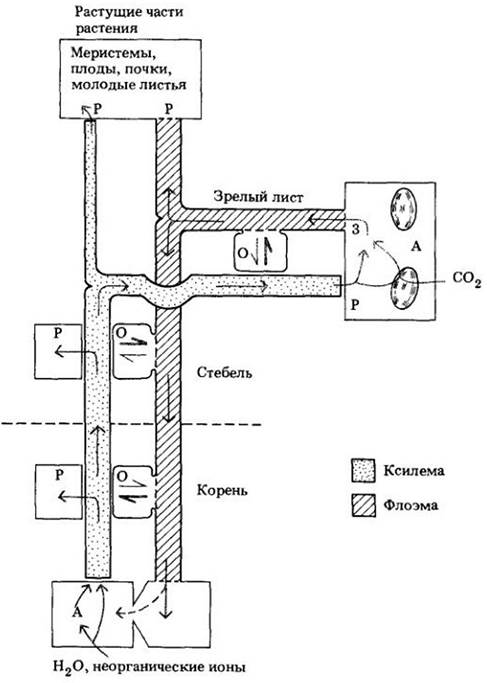
Неорганические ионы, попав путем секреции в сосуды ксилемы, быстро поднимаются вверх и разносятся по растению транспирационным током. Некоторые ионы перемещаются латерально из ксилемы в соседние ткани корня и стебля, другие — транспортируются в листья (рис. 27-17).
Рис. 27-17. Схема циркуляции воды, неорганических ионов и ассимилятов в растении. Вода и неорганические ионы, поглощенные корнем, передвигаются по ксилеме вверх с транспирационным током. Некоторая их часть перемещается латерально в ткани корня и стебля, остальная транспортируется к растущими частям и зрелым листья. В листьях значительное количество воды и неорганических ионов перемещается во флоэму и выносится из них вместе с сахарозой в токе ассимилятов. Растущие части, имеющие относительно малую возможность поглощения воды с помощью транспирации, получают основную часть питательных элементов и воды через флоэму. И вода, и растворенные вещества, попадающие в корни по флоэме, могут переноситься в ксилему и рециркулировать в транспирационном токе. Буквой А обозначены места, специализированные на поглощении (абсорбции) и ассимиляции исходных материалов из внешней среды. Буквы 3 и Р указывают соответственно места загрузки и разгрузки, О — основные точки, в которых происходит обмен между ксилемой и флоэмой
О путях перемещения ионов в листьях известно много меньше, чем об их движении в корнях. В листе ионы переносятся с водой в апопласт, т. е. в клеточные оболочки. Некоторые ионы могут оставаться в транспирируемой воде и достигают основных мест испарения воды — устьиц и других эпидермальных клеток. Большинство ионов в конце концов поступает в протопласты клеток листа, вероятно, с помощью переносчиков, как это происходит в корнях. По симпласту ионы могут передвигаться в другие ткани листа, в том числе во флоэму. Неорганические ионы в небольших количествах могут поглощаться и через листья, поэтому подкормка некоторых культурных растений путем нанесения микроэлементов прямо на листья стала обычным сельскохозяйственным приемом.
Значительные количества неорганических ионов, поступающих в листья по ксилеме, обмениваются с флоэмой листовых жилок и выносятся из листа вместе с сахарозой в токе ассимилятов (рис. 27-17, см. также обсуждение передвижения веществ в следующем разделе). Например, у однолетнего люпина белого (Lupinus albus) транспорт по флоэме обеспечивает более чем на 80% снабжение плодов азотом и серой и на 70 — 80% фосфором, калием, магнием и цинком. Поглощение этих неорганических ионов развивающимися плодами, несомненно, сопряжено с потоком сахарозы по флоэме.
В растении может происходить рециркуляция питательных элементов, когда они, достигнув корней в нисходящем токе ассимилятов, попадают в восходящий транспирационный ток в ксилеме (рис. 27-17). Только те ионы, которые могут передвигаться по флоэме и которые считаются флоэмно-подвижными, могут выноситься из листьев в заметных количествах. Например, К+, СI- и H2PO4-2 легко экспортируются из листьев, а Са2+ нет. Вещества, подобные кальцию, считаются флоэмно-неподвижными.
Транслокация: движение веществ по флоэме
Как описывалось в гл. 20 — 22, ксилема и флоэма вместе образуют непрерывную проводящую систему, которая пронизывает практически все части растения. В то время как вода и неорганические растворенные вещества поднимаются по ксилеме в транспирационном токе, сахара, образовавшиеся в процессе фотосинтеза, перемещаются из листьев по флоэме в токе ассимилятов (рис. 27-18) к местам, где они используются, например, растущим верхушкам побегов и корней, и к местам запасания, например, плодам, семенам, запасающей паренхиме стеблей и корней (см. рис. 27-17).
Рис. 27-18. Схема листа, на которой показаны пути следования молекул воды с транспирационным током. Вода поступает из ксилемы мелкой жилки в клетки мезофилла, испаряется с поверхности оболочек этих клеток и затем диффундирует из листа через открытые устьица (цветные линии). Показаны также пути, по которым движутся молекулы сахаров, образованные в процессе фотосинтеза. Они выходят из клеток мезофилла во флоэму той же жилки и попадают в поток ассимилятов. Считается, что молекулы сахаров, образовавшиеся в палисадных клетках, перемещаются в клетки губчатой паренхимы и двигаются по ним латерально к флоэме (серые линии)
Считается, что передвижение ассимилятов подчиняется схеме донор — акцептор. Основные доноры (источники) ассимилятов — фотосинтезирующие листья, но и запасающие ткани тоже могут считаться немаловажными донорами. Все части растения, не способные самостоятельно удовлетворить свои потребности в питании, могут быть акцепторами, т. е. потребителями, или импортерами, ассимилятов. Таким образом, запасающие ткани выступают в качестве акцепторов, когда они импортируют ассимиляты, и в качестве доноров, когда они их экспортируют.
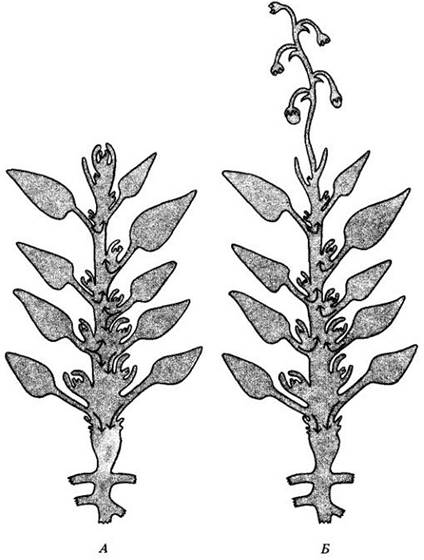
Донорно-акцепторные отношения могут быть относительно простыми и прямыми, как, например, в молодых проростках, у которых семядоли, содержащие запасные питательные вещества, служат их основным источником, а растущие корни — основным потребителем. У более старых растений верхние, в последнюю очередь сформировавшиеся листья обычно посылают ассимиляты главным образом к верхушке побега, нижние листья — в обоих направлениях (рис. 27-19, А). При переходе от вегетативного к генеративному росту данная схема распределения ассимилятов заметно меняется.
Развивающиеся плоды являются сильными конкурентами в потреблении и монополизируют ассимиляты из ближайших, а часто и из более удаленных листьев, что может привести к уменьшению или прекращению вегетативного роста (рис. 27-19, Б).
Рис. 27-19. Схемы растения в вегетативной стадии (А) и стадии плодоношения (Б). Стрелки показывают направление транспорта ассимилятов
Доказательство транспорта сахаров по флоэме
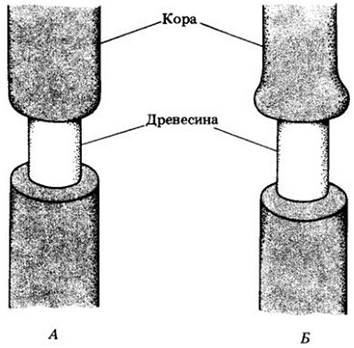
Первые доказательства роли флоэмы в транспорте ассимилятов были получены при наблюдении над деревьями, с которых снималось кольцо коры. Как отмечалось в гл. 23, кора более старых стеблей состоит в основном из флоэмы и не содержит ксилемы. Когда с фотосинтезирующего дерева срезают кольцо коры («кольцуют» его), то кора над кольцом набухает, что свидетельствует о накоплении ассимилятов, передвигающихся вниз по флоэме из фотосинтезирующих листьев (рис. 27-20).
Рис. 21-20. Еще в XVII в. итальянец Марчелло Мальпиги заметил, что если снять со стебля кольцеобразный кусок коры (А), то ткани над кольцом набухнут (Б). Он правильно объяснил это явление усиленными ростом тканей коры и древесины, который стимулируется накоплением питательных веществ, спускающихся из листьев и задержанных над кольцом. Мальпиги изучил влияние кольцевания в разное время года и нашел, что в зимние месяцы набухания не происходит
Более убедительные доказательства роли флоэмы в транспорте ассимилятов были получены с помощью радиоактивных меток. Ранее, когда меченые атомы не были доступны, приходилось делать надрезы на растении, чтобы ввести красители или другие вещества для исследования особенностей транспорта. Однако в момент перерезания ситовидных трубок в них исчезало высокое тургорное (гидростатическое) давление, а их содержимое устремлялось к поверхности срезов, нарушая всю систему. Как обсуждалось в гл. 20, это явление ответственно за образование пробок из слизи (Ф-белка) в поврежденных ситовидных элементах. Применение радиоактивных меток в настоящее время позволяет экспериментировать с целым растением и таким образом получать совершенно ясное представление о нормальном транспорте. Результаты экспериментов с радиоактивными ассимилятами (такими, как сахароза, меченная 14С) подтвердили, что эти вещества передвигаются по флоэме. Позднее в подобных исследованиях было убедительно показано, что сахара транспортируются по ситовидным трубкам флоэмы (см. приложение).
Использование тлей в исследовании флоэмы
Много ценной информации о передвижении веществ по флоэме было получено в исследованиях, где использовались тли — мелкие насекомые, сосущие сок растений. Большинство видов тлей питаются флоэмным соком. Они погружают свои модифицированные ротовые части, или стилеты, в стебель или лист до тех пор, пока концы стилетов не проколют ситовидные трубки (рис. 27-21). Тургорное давление в ситовидной трубке выталкивает ее сок в пищеварительный тракт тли и затем через его задний конец в виде капельки так называемой медвяной росы. Если питающихся тлей анестезировать и отделить от стилетов, то экссудат выделяется из перерезанных стилетов в течение многих часов; его можно собрать с помощью микропипетки. Анализы экссудата, полученного таким образом, показали, что сок ситовидных трубок содержит от 10 до 25% сухого вещества, 90% которого у большинства растений состоит из сахара (в основном сахарозы). Присутствуют в малых концентрациях (менее 1%) и аминокислоты, а также другие азотсодержащие вещества.
Рис. 27-21. А. Тля (Longistigma сагуае), питающаяся на стебле липы (Tilia americana). Видна капля медвяной росы, выделяющаяся из тли. Б. Микрофотография, на которой виден фрагмент модифицированной ротовой части (стилета) тли, погруженной в ситовидную трубку вторичной флоэмы стебля липы
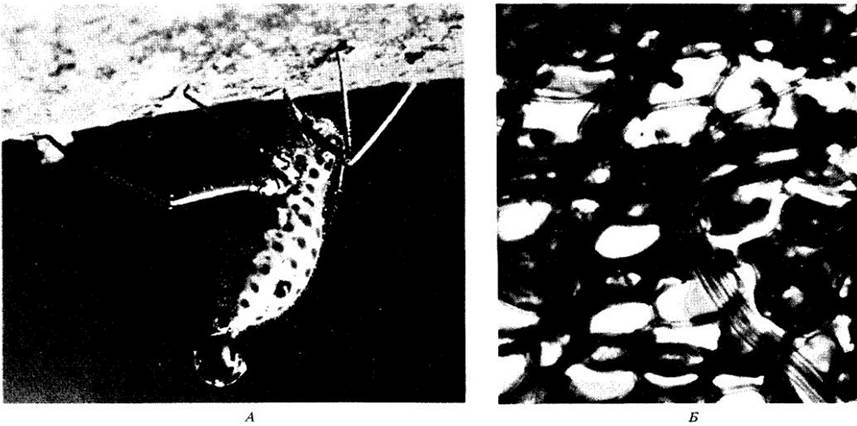
Результаты исследований, в которых используются тли и радиоактивные метки, показывают, что скорость продольного движения ассимилятов по флоэме удивительно высока. Например, в одной серии экспериментов с использованием отделенных стилетов тлей было установлено, что в местах прокола сок ситовидных трубок движется со скоростью около 100 см/ч.
Механизм флоэмного транспорта: ток под давлением
За годы исследований было выдвинуто несколько гипотез о механизме транспорта ассимилятов в ситовидных трубках флоэмы. Согласно самой ранней из них, основу транспортного механизма составляет диффузия, ускоряемая током цитоплазмы. Свободная диффузия и токи цитоплазмы, наблюдаемые обычно в клетках высших растений, рассматривались как возможные механизмы движения ассимилятов до тех пор, пока не выяснилось, что скорость транспорта ассимилятов (обычно от 50 до 100 м/ч) значительно превышает скорости этих двух процессов, которые поэтому не могут обеспечивать дальний транспорт через ситовидные трубки.
Для объяснения механизма флоэмного транспорта выдвигались и другие гипотезы, но только одна из них — гипотеза тока под давлением — удовлетворительно объясняет практически вес экспериментальные данные и учитывает структурные особенности флоэмы.
Первоначально предложенная в 1927 г. немецким физиологом растений Эрнстом Мюнхом, а затем модифицированная гипотеза тока под давлением дает, несомненно, самое простое и в настоящее время наиболее широко признанное объяснение дальнего транспорта ассимилятов по ситовидным трубкам. Это объяснение является самым простым, поскольку оно основывается исключительно на осмосе как движущей силе транспорта ассимилятов.
В кратком изложении гипотеза тока под давлением утверждает, что ассимиляты транспортируются от источника к месту потребления по градиенту тургорного давления, возникающего в результате осмоса. Основное положение этой гипотезы можно иллюстрировать с помощью простой физической модели, состоящей из баллонов, или осмотических ячеек, проницаемых только для воды и соединенных стеклянными трубочками (рис. 27-22). Первоначально первый баллон (А) содержит более концентрированный раствор сахара, чем второй баллон (Б). Соединенные друг с другом баллоны помещают в воду, вода начинает поступать в первый баллон путем осмоса, увеличивая в нем тургорное давление. Это давление передается по трубке во второй баллон, вызывая перетекание в него раствора сахара и вытесняя воду. Если второй баллон соединен с третьим, в котором концентрация сахарозы ниже, чем во втором, то раствор будет перетекать из второго баллона в третий (в результате того же процесса) и так далее неопределенно долго — по градиенту тургорного давления.
Рис. 27-22. Модель Мюнха, демонстрирующая основной механизм тока под давлением. А и Б — осмотические ячейки. А содержит более концентрированный раствор сахарозы, чем Б. В — стеклянная трубка, соединяющая две ячейки, Г — сосуд с водой. Вода поступает в А путем осмоса, увеличивая тургорное давление и выталкивая сахарный раствор в Б
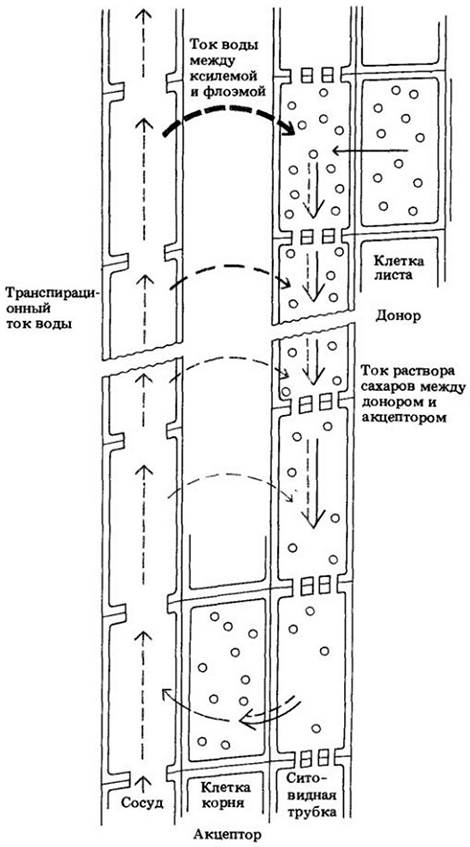
В растении сахароза, образовавшаяся в листе в результате фотосинтеза, активно секретируется в ситовидные трубки мелких жилок (рис. 27-23). Этот активный процесс, называемый загрузкой флоэмы, уменьшает водный потенциал в ситовидных трубках и приводит к тому, что в них путем осмоса поступает вода, попадающая в лист с транспирационным током. В результате поступления воды в ситовидные трубки донора сахароза пассивно переносится водой к акцептору, например, в запасающий корень, где сахароза удаляется (разгружается) из ситовидных трубок. Удаление сахарозы приводит к увеличению водного потенциала ситовидных трубок акцептора и последующему выходу из них воды. Сахароза может здесь либо использоваться, либо откладываться, но основная часть воды возвращается в ксилему и рециркулирует в транспирационном токе.
Рис. 27-23. Схема, иллюстрирующая механизм осмотически генерируемого тока под давлением. Кружки изображают молекулы сахара. Сахар активно загружается в ситовидные трубки донора (в месте производства). С повышением концентрации сахара уменьшается водный потенциал, и вода из ксилемы осмотически поступает в ситовидные трубки. В месте потребления или запасания (акцепторе) сахар высвобождается (разгружается), его концентрация в ситовидных трубках падает, в результате этого возрастает водный потенциал, и вода выходит из ситовидных трубок. При движении воды в ситовидные трубки донора и ее выходе из ситовидных трубок акцептора молекулы сахара пассивно переносятся водой по градиентам концентрации и гидростатического давления между донором и акцептором. Отметим, что в отличие от модели Мюнха, изображенной на рис. 27-22, ситовидные трубки, расположенные между донором и акцептором, окружены избирательно проницаемыми мембранами — плазматическими мембранами. Следовательно, вода поступает в ситовидные трубки и выходит из них не только у донора и акцептора, но и вдоль всего пути. Существуют данные о том, что лишь малое (если вообще какое-то) число молекул воды, поступивших первоначально в ситовидные трубки донора, достигает акцептора, поскольку они обмениваются на другие молекулы воды, которые попадают в ситовидные трубки по флоэмному апопласту вдоль транспортного пути
Отметим, что гипотеза тока под давлением отводит ситовидным трубкам пассивную роль в прохождении через них раствора сахара. Активный транспорт тоже участвует в перемещении раствора, однако не непосредственно в дальнем транспорте через ситовидные трубки, а скорее в загрузке и, возможно, разгрузке сахаров и других веществ из ситовидных трубок в зонах производства и потребления. Существуют серьезные доказательства того, что движущая сила для накопления сахарозы (загрузки флоэмы) в местах ее производства создается протонным насосом, использующим энергию АТР через АТРазу, присутствующую в плазматической мембране. При этом работает система сахарозно-протонного котранспорта (симпорта) (см. гл. 4). Метаболическая энергия, необходимая для загрузки и разгрузки, расходуется в большей степени клетками-спутниками и паренхимными клетками, окружающими ситовидные трубки, чем самими ситовидными трубками. До недавнего времени предполагалось, что загрузка осуществляется через плазматическую мембрану клетки-спутника, из которой сахар затем переносится в ситовидную трубку через многочисленные плазмодесмы в их общей стенке. Однако теперь стало ясно, что некоторые ситовидные трубки способны загружаться самостоятельно и что активный транспорт сосредоточен в их собственных плазматических мембранах. Но во всяком случае зрелая ситовидная трубка зависит в основных или во всех своих энергетических потребностях от клеток-спутников или от соседних паренхимных клеток.
Загрузка флоэмы — избирательный процесс. Как указывалось, ранее, основным транспортируемым сахаром является сахароза; кроме того, все сахара, содержащиеся в соке ситовидных трубок, относятся к нередуцирующим. Во флоэму также избирательно загружаются некоторые аминокислоты и ионы.
Заключение
В растениях более 90% воды, поглощенной корнями, выделяется в воздух в виде водяного пара. Этот процесс называют транспирацией, и основная часть воды, транспирируемой сосудистыми растениями, испаряется через устьица листьев.
Поглощение воды происходит преимущественно через корневые волоски, которые образуют огромную всасывающую поверхность. У некоторых растений, когда корни поглощают воду из почвы и транспортируют ее в ксилему, вода в ксилеме создает положительное давление, называемое корневым. Это осмотическое поглощение зависит от переноса неорганических ионов из почвы в ксилему, осуществляемого живыми клетками корня, и может привести к явлению, называемому гуттацией. Оно заключается в том, что вода выжимается через специальные отверстия на концах или краях листьев. В основном вода перемещается по апопластному пути через эпидерму и кору, пока не достигнет эндодермы, где дальнейшее ее движение по апопласту перекрывается поясками Каспари. На пути к ксилеме вода должна пройти через плазматические мембраны и протопласты эндодермальных клеток.
Из корней вода поднимается к листьям по ксилеме. Распространенной и широко принятой теорией передвижения воды к вершинам высоких растений по ксилеме является теория когезии-адгезии-натяжения. Согласно этой теории, вода в сосудах испытывает натяжение, поскольку благодаря сцеплению молекул образует непрерывные столбы, которые «тянутся» вверх в результате испарения. Показано, что вода обладает достаточной прочностью на разрыв, чтобы выдержать натяжение, создаваемое в трубках малого диаметра. Представление о натяжении воды в ксилеме подтверждают и те факты, что движение воды в деревьях начинается с самых верхних ветвей и ствол дерева слегка сжимается, когда вода начинает двигаться.
На скорость транспирации влияют такие факторы, как концентрация углекислоты в межклетниках (и содержание углекислоты в окружающем лист воздухе), свет, температура, атмосферная влажность, токи воздуха, доступность почвенной воды. Большинство этих факторов воздействует на устьица. Открывание и закрывание устьиц контролируется изменением тургора замыкающих клеток, которое тесно коррелирует с изменениями концентрации ионов калия в этих клетках. В движении устьиц играют роль абсцизовая кислота и синий свет. Устьица открываются, когда в замыкающих клетках увеличивается тургор, и закрываются, когда он снижается.
Неорганические вещества почвенных растворов доступны растениям в форме ионов. Для накопления необходимых ионов растения используют метаболическую энергию. Большинство ионов поглощается в процессе активного транспорта, другие переносятся через плазматическую мембрану пассивно благодаря водному потенциалу, который создается за счет активно двигающихся ионов и их насосов. Неорганические ионы следуют в основном по симпластному пути из эпидермы в ксилему.
Исследованию передвижения веществ по флоэме значительно способствовало использование тлей и радиоактивных меток. Анализы сока ситовидных трубок показывают, что он содержит сахар — главным образом сахарозу — и небольшое количество азотистых веществ. Скорость продольного транспорта веществ по флоэме намного превышает нормальную скорость диффузии сахарозы в воде — обычно она составляет от 50 до 100 см/ч.
Согласно гипотезе тока под давлением, ассимиляты перемещаются от источника к месту потребления (накопления) по градиенту тургорного давления, который развивается осмотически. Сахара активно секретируются (загружаются) в ситовидные трубки и поглощаются (разгружаются) из них клетками-спутниками и паренхимными клетками, расположенными соответственно в местах производства и потребления. Ситовидные трубки выполняют пассивную роль.
Приложение. Радиоактивное мечение и радиоавтография в изучении растений
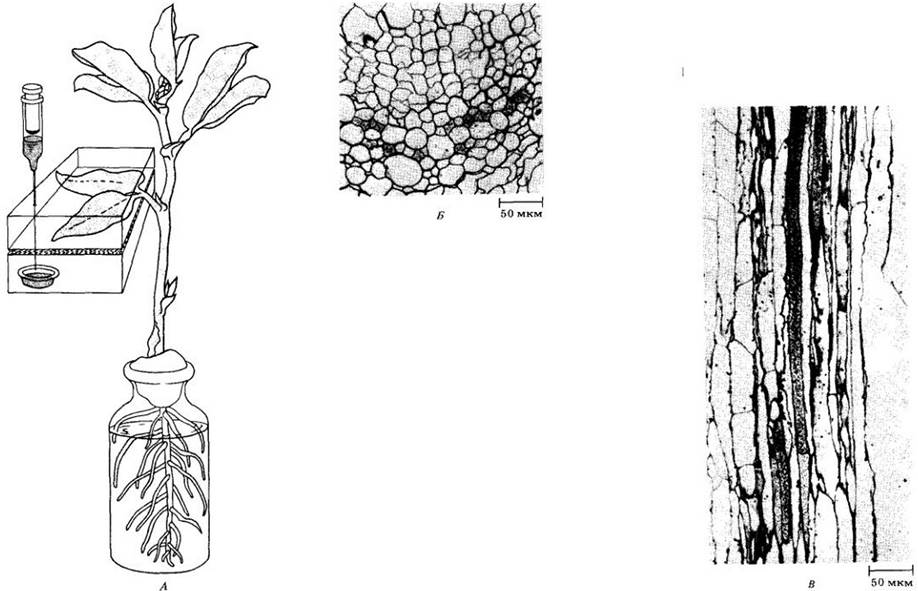
Радиоактивные метки можно использовать разными способами для изучения синтеза, транспорта и превращения веществ в растениях. Прежде всего, в любом подобном эксперименте необходимо ввести радиоактивный изотоп в растение. Радиоактивный углерод, например, будет поглощаться растением, если его листья выдерживать в атмосфере с углекислотой, содержащей ,4С; радиоактивный фосфор поступит в растение, если его корни находятся в растворе, содержащем ионы с 32Р.
Продолжительность воздействия радиоактивного материала на растение определяется тем, какую информацию исследователи хотят получить. Например, в экспериментах, имеющих целью определить время, необходимое для включения углекислоты в различные продукты фотосинтеза, должен быть использован ряд экспозиций. В опытах по обнаружению определенного метаболического продукта с использованием радиоактивных веществ длительность экспозиции будет определяться временем протекания исследуемых реакций.
При радиоавтографии целого растения его после взаимодействия с радиоактивным веществом быстро замораживают и подвергают замораживанию-высушиванию. Затем растение распластывают и прижимают к рентгеновской пленке. Радиация, испускаемая изотопом, воздействует на пленку, прилегающую к тем частям растения, в которых локализована метка. Сравнивая распластанное растение с проявленной пленкой, исследователи могут определить местонахождение радиоактивного вещества в растении.
При радиоавтографии тканей (микрорадиоавтографии) растительные ткани, подвергнутые замораживанию-высушиванию, заключают в парафин, смолу или аналогичный материал. Затем готовят очень тонкие срезы, которые помещают на предметные спекла. Срезы покрывают фотографической эмульсией или пленкой. Радиация, испускаемая изотопом, засвечивает пленку в участках, контактирующих с теми частями среза ткани, которые содержат радиоактивный материал. Через определенный промежуток времени пленку проявляют. Сравнивая под микроскопом пленку и лежащий под ней срез, выявляют точное место локализации радиоактивного вещества в растительных тканях.
А. Два листочка растения бобов русских (Vicia faba) были заключены в камеру из плексигласа, содержащую 14СО2. Листочки выдержали с радиоактивной углекислотой на свету 35 мин. За это время произошло включение 14СО3 в сахара, которые затем переместились в другие части растения. Поперечный (Б) и продольный (В) срезы стебля были покрыты радиоавтографической пленкой на 32 дня. Когда пленку проявили и сравнили с лежавшими под ней срезами, то выяснилось, что радиоактивность (обнаруживаемая в виде черных зерен на пленке) сосредоточена почти исключительно в ситовидных трубках