ФІЗІОЛОГІЯ ТА БІОХІМІЯ РОСЛИН
Опорний конспект лекцій
6. ДИХАННЯ РОСЛИН
Дихальний електронно-транспортний ланцюг (ДЕЛ)
Цикл Кребса, гліоксилатний і ПФШ-хи функціонують лише в умовах достатньої кількості кисню. В той же час О2 безпосередньо не бере участі в реакціях цих циклів. Кисень необхідний для кінцевого етапу дихання, пов'язаного з окисненням відновлених коферментів НАДН і ФАДН2 у дихальному електронному ланцюзі (ДЕЛ) мітохондрій. З перенесенням е- по ДЕЛ спряжений і синтез АТФ.
Електронно-транспортний ланцюг мітохондрій (ЕЛМ)
Б. Чанс та ін.., (США), 50-ті рр.
ДЕЛ локалізований на внутрішній мембрані мітохондрій. Служить для передавання е- від відновлених субстратів на кисень, що супроводжується трансмембранним перенесенням іонів Н+. Таким чином, ЕЛМ (як і тилакоїдів) виконує функцію окисно-відновної помпи.
Компоненти ЕЛМ можна розкласти в такому порядку:
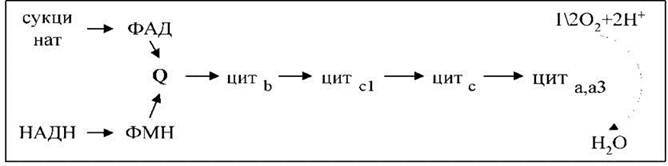
Пара е- від НАДН або сукцинату передається по електронно-транспортному ланцюзі до кисню, який, відновлюючись, утворює воду.
Згідно з сучасними даними, ЕЛМ складається з чотирьох мультиензимних комплексів і двох невеликих за молекулярною масою компонентів - убіхінону і цитохрому с.
Комплекс І здійснює транспортуваннявання е- від НАДН до убіхінону Q. До складу комплексу входить флавінова (ФМН-залежна) НАДН: убіхінон-оксидоредуктаза, яка містить 3 залізосірчані центри (FeSN 1-3). У штучній фосфоліпідній мембрані комплекс функціонує як протонна помпа.
Комплекс ІІ каталізує окиснення сукцинату убіхіноном. Цю функцію здійснює флавінова (ФАД-залежна) сукцинат: убіхінон-оксидоредуктаза, до складу якої також входять три залізосірчані центри (FeSS 1-3)
Комплекс ІІІ переносить е- від відновленого убіхінону до цитохрому с, тобто функціонує як убіхінол: цитохром с-оксидоредуктаза. У своєму складі він містить цитохроми в556 і в560, цитохром с1 і залізосірчаний білок Ріске. У присутності убіхінону комплекс ІІІ здійснює активне трансмембранне перенесення Н+.
У термінальному комплексі IV е- транспортуються від цитохрому с до кисню, тобто цей комплекс є цитохром с: кисень-оксидоредуктазою (цитохром-оксидазою). До його складу входять чотири редокскомпоненти: цитохроми а1, а3 і два атоми міді - СuА і Сuв. Цитохром а3 і Сuв здатні до взаємодії з киснем, на який передаються е- з цитохрому а-СuА. Транспорт е- через четвертий комплекс спряжений з активним транспортуванняванням іонів Н+. Функція цитохрому а3-Сuв пригнічується ціанідом, азидом і СО.
Доведено, що комплекси I, III і IV перетинають мембрану. На внутрішній поверхні мембрани з матриксу 2 е- і 2Н+ із НАДН поступають на ФМН комплексу І. Електрони передаються на FeS-центри, звідти - на убіхінон, який приймає і 2Н+, утворюючи семихінони (2QH) і дифундує до комплексу ІІІ. Тут на семихінони поступає ще пара е- від цит в560, що робить можливе приєднання ще 2Н+ із матриксу, і утворюється 2QH2. Повністю відновлений убіхінон (убіхінол) віддає 2е- цитохрому в556 і ще 2е- - FeSR-цит. с1. У результаті 4Н+ звільняються в міжмембранний простір мітохондрії.
Окиснені молекули убіхінону знову дифундують до компексу І і готові приймати від нього (чи від комп. ІІ) е- і Н+. Таким чином, цитохроми в служать донорами двох е- для перенесення двох додаткових Н+ через ліпідну фазу мембран. Водорозчинний цит. с на зовнішній поверхні мембрани, отримавши 2е- від FeSR - цит с1, передає їх на цит. а-СuА термінального комплексу (комплекс IV). Цит а3-Сuв, зв’язуючи кисень, переносить на нього ці 2е-, в результаті чого з участю двох Н+ із матриксу утворюється вода.
Таким чином, із матриксу мітохондрій при транспортуванні кожної пари е- від НАДН до 1\2 О2 в трьох ділянках ЕТЛ через мембрану переносяться щонайменше 6Н+ до міжмембранного простору.
Передача 2 е- від сукцинату на убіхінон у комплексі II не супроводжується трансмембранним переносом протонів.
Відмінністю рослинних мітохондрій від тваринних є здатність окиснювати екзогенний НАДН. Вони містять спеціальні флавінові НАДН-дегідрогенази, локалізовані на зовнішніх частинах обох мембран. Друга відмінність полягає у тому, що на внутрішній мембрані, крім основного (цитохромного) шляху перенесення електронів, є альтернативний, стійкий до дії ціаніду.
Окиснювальне фосфорилювання
Перенесення е- від НАДН до молекулярного кисню через ЕТЛ мітохондрій супроводжується втратою вільної Е. При цьому утворюється АТФ. Це було встановлено завдяки працям В. Енгельгарда, В. Беліцера (СРСР), Г. Калькара (США). Процес фосфорилювання АДФ з утворенням АТФ, спряжений з переносом е- по ЕТЛ мітохондрій, отримав назву окиснювального фосфорилювання.
Експериментально доведено, що передача е- від НАДН на кисень супроводжується утворенням хоча б трьох молекул АТФ, тобто коефіцієнт фосфорилювання Р/О=3. Таке ж значення коефіцієнту фосфорилювання випливає з величин перепадів вільної Е між різними групами переносників.
Щодо механізму окисного фосфорилювання існує три теорії:
- хімічна (через інтермедіатори білкової природи, що можуть утворювати комплекси з високоенергетичними зв'язками);
- механо-хімічна (конформаційна) - шляхом конформаційної зміни актиноміозинового компонента (фермент запасає Е і скорочується, далі відбувається розслаблення, при якому виділяється Е на синтез АТФ)

- хеміосмотична теорія англ. біохіміка П. Мітчела (1961) - користується найбільшою популярністю.
Хеміосмотична теорія
Потік е- через систему молекул-переносників супроводжується транспортуванням іонів Н+ через внутрішні мембрани мітохондрій. У результаті на мембрані створюється електрохімічний потенціал іонів Н+, який містить осмотичний (хімічний) і електричний градієнти (мембранний потенціал). Електрохімічний трансмембранний потенціал іонів Н+ і виступає джерелом енергії для синтезу АТФ за рахунок зворотного транспортування іонів Н+ через протонний канал мембранної Н+-АТФази.
Теорія Мітчела виходить із того, що переносники перешнуровують мембрану, чергуючись таким чином, що в одному напрямку можливий перенос е- і Н+, а у зворотному - лише е-. У результаті іони Н+ скупчуються на одному боці внутрішньої мембрани. Створений таким чином запас Е використовується для синтезу АТФ як результат розрядки мембрани при зворотному (за градієнтом концентрації) транспортуванні протонів через АТФазу, яка працює в даному випадку як АТФ-синтетаза.
Спряження дифузії протонів із синтезом АТФ здійснюється за допомогою АТФазного комплексу, який називається фактором спряження F1.
F1 - водорозчинний білок, який складається з дев’яти субодиниць п'яти типів. Білок F1 є АТФ-азою і пов'язаний з мембраною через інший білковий комплекс F0, який перешнуровує мембрану. F0не має каталітичної активності і служить каналом для транспортування іонів Н+ через мембрану до F1.
За останні роки хеміосмотична гіпотеза Мітчелла отримала цілий ряд експериментальних підтверджень.
Різноманітність шляхів перенесення е- і Н+
Завершальний етап багатьох процесів окиснення полягає в перенесенні е- на кисень. Він каталізується термінальними оксидазами. Оксидазні системи такого роду локалізовані в мітохондріях, в ЕР, плазмалемі, цитоплазмі.
Головна редокс-система клітини - дихальний ланцюг внутрішньої мембрани мітохондрій. Її термінальні оксидази - цитохромоксидаза й альтернативна оксидаза.
У цитоплазмі функціонують 3 редокс-системи. Одна з них окиснює/відновлює НАД(Ф)Н, глутатіон, аскорбінову кислоту ⇒ термінальна оксидаза → аскорбатоксидаза; друга окиснює НАДН, поліфеноли в хінони ⇒ термінальний фермент → поліфенолоксидаза.
У цитоплазмі наявні також флавопротеїнові оксидази, котрі окиснюють різні субстрати.
У мембранах ЕР локалізовано два редокс-ланцюги. В одному з них при окисненні НАДН з участю флавопротеїнів і цитохрому в5 відбувається оксигеназна реакція, пов'язана з гідроксилюванням, що призводить до утворення ненасичених зв’язків у жирних кислот. У другому субстратом виступає НАДФН, а завершує ланцюг цитохром Р-450, який, використовуючи кисень, гідроксилює багато різних сполук.
Кінцеві оксидази мають різні характеристики і по-різному реагують на зміну умов у клітині.
Субстрати дихання і дихальний коефіцієнт
Як головний субстрат дихання рослини використовують вуглеводи і насамперед - вільні цукри. Коли їх немає в достатній кількості, субстратом окиснення можуть бути резервні полімерні речовини.
Функцію запасних вуглеводів виконують крохмаль (картопля, злаки), інулін (жоржини, топінамбур), геміцелюлози. Деякі рослини окиснюють багатоатомні спирти: сорбіт (груша), манніт (заразиха, маслини, ясен); органічні к-ти.
Резервні жири використовуються на дихання проростків, які розвиваються з насіння, багате на жири. Використання жирів починається з їх розщеплення ліпазою на гліцерин і жирні кислоти (сферосоми). Далі гліцерин перетворюється на ФГА. Жирні кислоти окиснюються за механізмом β-окиснення, в результаті якого послідовно відщеплюються двовуглецеві залишки у формі ацетил-КоА. Цей процес відбувається в гліоксисомах. Далі ацетил-КоА залучається до гліоксилатного циклу, кінцевий продукт якого - сукцинат - покидає гліоксисому й у мітохондрії бере участь у циклі Кребса. Тут синтезується малат, який у цитозолі перетворюється в оксалоацетат і далі у ФЕП (фосфоенолпіруват).
ФЕП - вихідний матеріал для синтезу глюкози, фруктози.
Процес утворення глюкози з невуглеводних попередників називається глюконеогенезом. У цьому процесі взаємодіють сферосоми, гліоксисоми, мітохондрії, пластиди і ферментні системи цитозоля.
Резервні білки використовуються для дихання після гідролізу до амінокислот і подальшої окиснювальної деградації до ацетил-КоА, або кетокислот, які захоплюються згодом у цикл Кребса.
При окисненні всіх субстратів виділяється енергія:
- при гідролізі біополімерів виділяється 1 % Е цукрів;
- гліколіз дає 20 % Е цукрів;
- цикл Кребса та ЕТЛ → 80 % Е цукрів;
- при цьому в АТФ запасається лише до 55% Е цукрів.
Відношення кількості молей виділеного при диханні СО2 до кількості молей поглинутого О2 називається дихальним коефіцієнтом (ДК = СО2/О2).
Кількість кисню, необхідного для окиснення субстрату в процесі дихання знаходиться в оберненій залежності від його вмісту в молекулі субстрату: чим менша кількість О2 в молекулі субстрату, тим більше його витрачається на окиснення. Для гексоз ДК =1; для жирних кислот - < 1; для органічних кислот - > 1 (≈ 3-4).
Величина ДК визначається як кількістю О2, що міститься в субстраті, так і постачанням киснем рослинних тканин.
За нестачі О2 посилюється бродіння і ДК зростає. В цілому величина ДК відображає особливості процесу дихання даної тканини, органу за певних зовнішніх умов.