ФІЗІОЛОГІЯ ТА БІОХІМІЯ РОСЛИН
Опорний конспект лекцій
3. СИСТЕМИ РЕГУЛЯЦІЇ ТА ІНТЕГРАЦІЇ У РОСЛИН
Складна будова рослинного організму вимагає і досконалих систем управління. Цілісність будь-якого організму забезпечується системами регуляції, управління та інтеграції. Під регуляцією звичайно розуміють підтримання значень параметрів систем у певних межах. Управління - це процес переводу системи з одного стану в інший шляхом дії на її змінні. У широкому розумінні термін "регуляція" охоплює і процеси управління. В такому значенні цей термін уживається в біології.
Регуляція забезпечує гомеостаз організму, тобто підтримку параметрів внутрішнього середовища в заданих межах, а також створює умови для його розвитку (епігенезу). На всіх рівнях організації гомеостаз забезпечується негативними зворотними зв'язками, епігенез - переважно позитивними зворотними зв'язками.
До складу систем регуляції та інтеграції у рослин входять: внутрішньоклітинні системи регуляції, міжклітинні системи регуляції та інтеграція регуляторних механізмів на рівні цілісного організму.
Внутрішньоклітинні системи регуляції
У ході еволюції спочатку повинні були виникнути внутрішньоклітинні системи регуляції. До них належить регуляція на рівні ферментів (метаболічна), генетична та мембранна. Усі ці системи тісно пов'язані між собою. Більше того, в основі всіх форм внутрішньоклітинної регуляції лежить єдиний первинний рецепторно-конформаційний принцип (молекула певної будови + специфічний фактор → зміна конфігурації → зміна функції).
Регуляція активності ферментів
Розрізняють ізотеричну та алостеричну регуляцію активності ферментів. Ізостерична регуляція здійснюється на рівні каталітичних центрів:
· ферментативна активність залежить від наявності та кількості субстрату - закон дії мас;
· ферментативна активність залежить від наявності та кількості самого ферменту, а також інгібіторів і активаторів каталітичного центру та продуктів реакції.
Деякі ферменти, крім каталітичних (ізостеричних) центрів, мають також алостеричні→ для зв'язування алостеричних ефекторів (регуляторів - інгібіторів чи активаторів, метаболітів, гормонів, субстратів).
Інтенсивність роботи ферментів визначається також наявністю коферментів (для двокомпонентних ензимів), ко-факторів (специфічно діючих катіонів).
Активність тих чи інших ферментів може бути пов'язана з конкуренцією за спільні субстрати і коферменти, що є одним із способів взаємодії різних метаболічних циклів.
Важливим способом регуляції ферментативної активності є трансформація латентної форми ферменту (зимогена) в активну форму. Це досягається шляхом руйнування деяких ковалентних зв'язків за допомогою протеаз, відновленням дисульфідних груп, фосфорилюванням протеїнкіназами за рахунок АТФ або асоціацією неактивних субодиниць.
Є й інші способи зміни ферментативної активності. Це: різна компартментація ферментів, субстратів, речовин-регуляторів; зміна значення pH середовища, іонного складу, зміна інших фізико-хімічних умов середовища; руйнування ферментів протеазами.
Генетична система регуляції
Генетична система керування внутрішньоклітинними процесами забезпечується регуляцією на рівні реплікації, транскрипції, процесингу і трансляції. Молекулярні механізми впливу тут такі ж, як і при регуляції активності ферментів (кількість та співвідношення компонентів, рН, іонний склад, модифікація молекул, інгібітори тощо), але насиченість і складність регуляторних сіток значно зростає.
Роль генів → зберігання та передача інформації. Інформація записується й зберігається в структурі хромосомної ДНК у вигляді триплетного нуклеотидного коду. Передача інформації здійснюється шляхом: транскрипції → трансляції → процесингу (модифікація біополімерів). ⇒ У результаті утворюється активний білок, який виконує різноманітні функції: каталітичні (ферменти); рухові (скоротливі білки); транспортні (насоси, переносники); рецепторні (хемо-, фото, механорецептори); регуляторні (білки активатори, інгібітори, репресори); захисні (лектини) та ін.
Усі ці функції білків є важливими механізмами керування біохімічними та фізіологічними процесами, які відбуваються в клітині та цілому організмі.
Регуляція на рівні транскрипції та післятранскрипційного процесингу
Для отримання в певний момент конкретної інформації зі структур хромосом у клітині існує складна система регуляції, не всі механізми якої у даний час відомі.
Схема організації ділянки ядерцевої ДНК, яка кодує синтез 18S, 5,8S і 25S (28S) pРHK
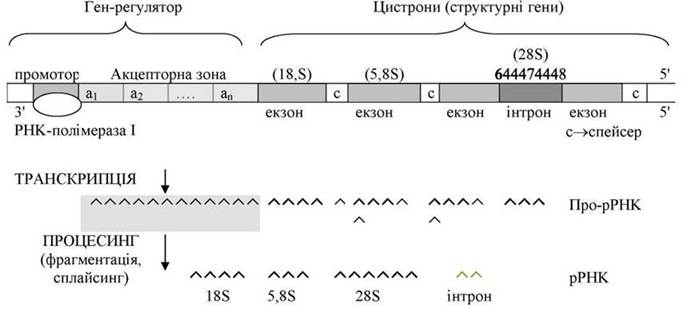
Гени, які кодують білки, складаються з гена-регулятора (промотор + акцепторна зона) та структурних генів (цистронів).
РНК-полімераза І, яка здійснює транскрипцію генів, приєднується до промотора (ділянка ініціації транскрипції) лише після того, як усі ділянки акцепторної зони будуть активовані відповідними ефекторами - фітогормонами, метаболітами та іншими речовинами. Весь процес регулюється шляхом впливу на стан РНК-полімерази (ферментативна регуляція) та на ген-регулятор (ефекторами), а також наявністю і кількістю всіх інших компонентів транскрипції.
Структурні гени (цистрони) розділені спейсерами (прокладками). В генах, крім кодуючих ділянок (екзонів), можуть бути некодуючі ділянки (інтрони). Часто блоки структурних генів у ядерцевій ДНК, слідуючи один за одним, багатократно повторюються. Тандемна організація структурних генів у евкаріот характерна для ділянок ДНК, які кодують рРНК, тРНК і білки-гістони.
В результаті «переписування» (транскрипції) структурних генів синтезується про-мРНК. Зрілі мРНК утворюються в ході процесингу про-мРНК в результаті її фрагментації, виділення ділянок, що відповідають спейсерам, а також завдяки сплайсингу (вирізання інтрону й об'єднання 2-х частин мРНК).
Інтронна структура не характерна для рибосомальних генів, однак вона представлена в генах хлоропластів, мітохондрій, нижчих грибів і у деяких інших евкаріот. Усі вищеописані процеси ферментативні й мають складну систему регуляції.
Крім того, існує декілька гіпотез про механізми посттранскрипційної регуляції експресії генів мРНК.
Згідно з однією в ядерній ДНК існують інтеграційні регуляторні гени з численними повторами. Якщо в нуклеоплазмі у великій кількості з'являються транскрипти з певних регуляторних генів, то утворюються комплементарні асоціати з відповідними про-мРНК. У результаті прискорюється процесинг про-мРНК і активовані таким чином мРНК починають функціонувати. При цьому також різко зростає швидкість їх зчитування з відповідних структурних генів. Ефектори (Еф, сигнали), які поступають до ядра з цитоплазми, індукують вибіркову експресію інтеграційних регуляторних генів. Еф1, наприклад, фітогормон, взаємодіючи зі своїм рецепторним білком (РБ1), індукує транскрипцію певного інтеграційного регуляторного гена з численними повторами а...а. Про-РНК із цього регуляторного гена піддається процесингу й утворюються регуляторні транскрипти. Вони, у свою чергу, утворюють комплементарні асоціати з про-мРНК1, індукуючи швидше новоутворення й активацію цієї мРНК1.
На відміну від мРНК1, зчитування й активація мРНК2, наприклад, залежать від одночасної наявності двох ефекторів - Еф1 і Еф2. Це можуть бути гормони різних класів або метаболіти. Таким чином, синтез мРНК2 - приклад генетичної індукції, яка знаходиться під подвійним контролем.
Так, синтез нітратредуктази в рослинах можна індукуватися нітратом (субстратна індукція) і цитокініном; до того ж кінцевий продукт відновлення нітрату - амоній - блокує розвиток нітрат-редуктазної активності.
Регуляція на рівні трансляції
Механізм трансляції набагато складніший від процесів транскрипції. В той час, як транскрипцію забезпечують десятки білків, то трансляцію - сотні. Лише в рибосомах евкаріот їх 70-100, при цьому рРНК відіграють роль каркаса для самовкладання цих білків. Регуляторні сітки тут насиченіші, а механізми - складніші. Інтенсивність і спрямованість трансляції залежать від:
1) концентрації інформаційних РНК (мРНК), рівень яких визначається їх синтезом, транспортом, зберіганням, активацією й розпадом;
2) наявності всіх компонентів апарату трансляції - рибосом, тРНК, амінокислот, АТФ, ГТФ, синтетаз, регуляторних білків.
3) фізико-хімічних умов (рН, іони, температура та ін.).
Мембранна регуляція
Мембранна регуляція здійснюється завдяки змінам у мембранному транспорті, зв’язуванню чи вивільненню ферментів, регуляторних білків, тобто шляхом зміни активності функціональних білків.
Усі функції мембран (транспортна, осмотична, енергетична та ін.) одночасно є і різними сторонами регуляторного механізму внутрішньоклітинного обміну речовин. Особливе значення у цих механізмах має система мембранних хемо-, фото- і механорецепторів, які дозволяють клітині змінювати властивості мембран, а отже, обмін речовин у залежності від змін оточуючого середовища.
В основі мембранної регуляції знаходиться той стан динамічної нерівноваги, який підтримується в кожній клітині на певному стаціонарному рівні завдяки роботі іонних насосів, локалізованих у мембранах. Особливу роль відіграють протонні помпи, які функціонують на базі мембранних Н+-АТФ-аз або редоксланцюгів, створюючи електрохімічний потенціал іонів Н+(ΔμН+). Значення мембранного потенціалу на плазмалемі сягає 100-200 мВ, причому внутрішня поверхня мембрани має від'ємний заряд. Енергія даного потенціалу використовується для поглинання клітиною катіонів, аніонів, цукрів та інших сполук.
Підтримка на стаціонарному рівні значення мембранного потенціалу є найважливішою складовою частиною гомеостазу. При зниженні мембранного потенціалу на плазмалемі його величина відновлюється внаслідок відкриття калієвих каналів і виходу іонів К+ або активацією протонного насосу.
Мембранна регуляція має вирішальний вплив на зміну концентрацій внутрішньоклітинного кальцію. Останній входить до клітини за електрохімічним градієнтом через кальцієві канали, а викачується з участю Са2+-АТФ-ази або шляхом антипорту з іонами водню. Кальцій може акумулюватися у вакуолях, в ендоплазматичному ретикулумі та звільнятися з них. Його концентрація в цитоплазмі підтримується на досить низькому рівні (10-7 М). Незначне підвищення його концентрації (до 10-6 М) впливає на активність Са2+-залежних протеїнкіназ, фосфорилювання білків, рух цитоплазми, стан цитоскелету, секреторну, мітотичну активність та інше. Кальцій регулює всі ці процеси через зв'язок із кальмодуліном та іншими кальцій-утримуючими білками.
Крім того, в рослинних клітинах, як й у тварин, у ролі регуляторної системи функціонує фосфоінозитольний цикл, який шляхом звільнення Са2+ та активації в плазмалемі протеїнкінази С фосфорилює білки іонних каналів, регулюючи їхню роботу.
Зовсім недавно (Каufman, 1994) виявлено, що в мембранній регуляції у вищих рослин значну роль відіграють ГТФ-зв’язуючі сигнальні білки. Це так звані великі ГТФ-зв’язуючі регуляторні протеїни та малі G-протеїни. Великі G-протеїни складаються із трьох (α, β, γ) субодиниць, але взаємодіють лише з одним рецептором та однією ефекторною системою. Вважають, що вони передають сигнали від семисегментних трансмембранних рецепторів до таких специфічних клітинно-ефекторних систем, як аденілциклазна. Відомо, що аденілциклазна система є універсальним механізмом передачі зовнішніх сигналів та їх реалізації на молекулярному рівні в евкаріот.
Малі G-протеїни є мономерами з молекулярною масою між 20 і 30 кДа. Виявлено три підкласи малих G-протеїнів із різноманітними регуляторними функціями — від транспортування білків, везикул до регуляції клітинного циклу, росту клітин, їх диференціації, організації мікрофіламентних структур цитоскелету.
За участю мембран відбувається:
- контактна регуляція ферментативної активності (стосується фіксованих ензимів на мембранах ендоплазматичного ретикулуму, АГ і т.д.);
- дистанційна регуляція ферментативної активності (доставка субстратів, коферментів, продуктів реакції у везикулах, зсуви іонні, рН та ін. процеси, що відбуваються з участю мембран). Так, мембрани регулюють вміст іонів кальцію в різних компартментах клітини, а Са2+ + регуляторний білок кальмодулін зумовлюють активацію протеїнкінази, яка фосфорилює різні білки, змінюючи їхню функціональну активність.
Мембранна регуляція генної активності на рівні реплікації, транскрипції, процесингу і трансляції здійснюється:
- контактним способом⇒ у результаті наявності функціонально-активної подвійної ядерної оболонки та існування зв’язків хромосом із мембранами (просторова організація хромосомного апарату в нуклеоплазмі) і зв’язків рибосом із мембранами (гранулярний ЕР);
- дистанційним способом ⇒ транспорт попередників синтезу ДНК, РНК, ферментів, регуляторних білків і т.д. за допомогою мембран; зміна іонних потенціалів та рН у міжмембранних просторах (зростання іонної сили до 0,4 моль/л, наявність Mn і рН 7,5 активують РНК-полімеразу ІІ, яка синтезує мРНК; а при низькій іонній силі, наявності Mg та рН 8,5 активується РНК-полімераза І, яка відповідає за синтез рРНК); (для ініціації трансляції сприятлива низька концентрація іонів К+ і рН 7,5, а для подальшого процесу елонгації поліпептиду в рибосомальному комплексі - підвищена концентрація К+ і рН 8,4).
Існує думка, що зсуви в іонному гомеостазі клітин у відповідь на зовнішні впливи служать первинним внутрішньоклітинним індуктором процесів мітозу та диференційної активності генів.
Ієрархія систем регуляції у багатоклітинних рослин
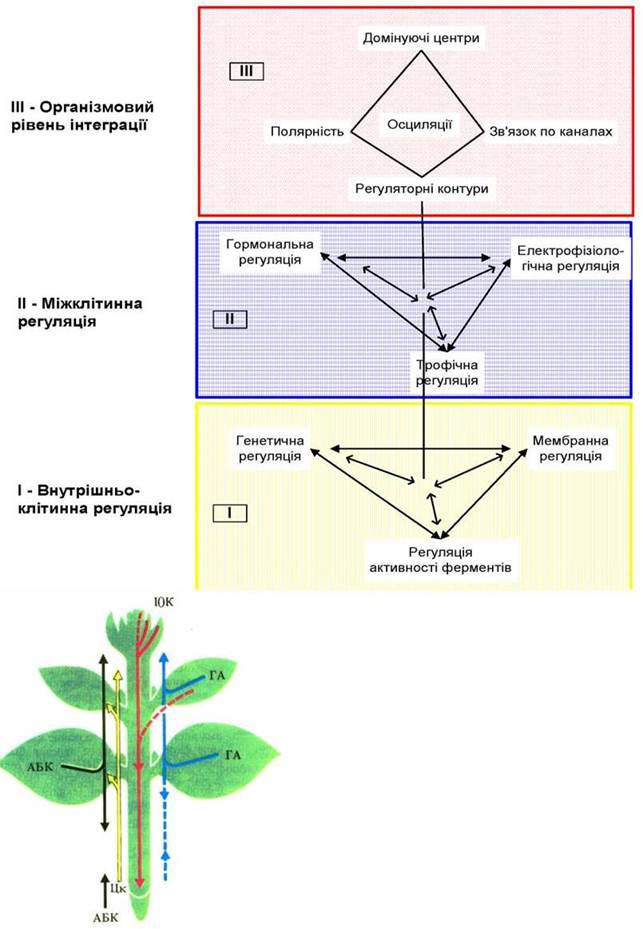
Рис. 2. Основні ділянки синтезу фітогормонів і напрямок їх транспортування у рослин.