БОТАНИКА ТОМ 2 - ФИЗИОЛОГИЯ РАСТЕНИЙ - 2007
6. ФИЗИОЛОГИЯ ОБМЕНА ВЕЩЕСТВ
6.8. Транспорт ассимилятов в растении
Доставка синтезированных растением органических веществ (ассимилятов) от мест их производства к местам потребления (в общем и целом, от донорных органов к акцепторным, см, 6.8.3) осуществляется у кормофитов почти целиком по ситовидным элементам флоэмы (см. 3.2.4.1). Для преодоления коротких расстояний ассимиляты могут переходить от клетки к клетке также симпластически или апопластически, механизмом для этого служит диффузия1; передача и получение ассимилятов через плазмалемму осуществляется при помощи специальных транс- локаторов. Только в виде исключения ассимиляты транспортируются по ксилеме. Это происходит весной у деревьев, когда зеленые листья еще не развиты (пасока, см. 6.3.5). Кроме того, по ксилеме в побег транспортируются синтезированные в процессе ассимиляции нитратов аминокислоты, такие, как глутамин и аспарагин, и биологически активные вещества, например, фитогормоны (см. 7.6), которые также входят в состав сока ксилемы (см. 6.3.5).
1 Как симпластический транспорт, так и транспорт через апопласт от клетки к клетке — активные процессы, идущие с затратой энергии. Например, при симпластическом транспорте главную роль играет везикулярный транспорт с участием цитоскелета, так что приписывать транспорт ассимилятов исключительно диффузии нельзя, — Примеч. ред.
В основном все вещества (или их соответствующие предшественники), которые не могут синтезироваться в неавтотрофных клетках, должны туда доставляться. Главными транспортными метаболитами являются сахар и обнаруженные наряду с ним в соке ситовидных трубок аминокислоты, а также другие азотистые соединения, нуклеотиды (в основном высокие концентрации АТФ), витамины, фитогормоны, органические кислоты и минеральные вещества. Из более чем 200 значимых белков, обнаруженных в содержимом ситовидных трубок, большая часть специфична для ситовидных клеток, а соответственно и ситовидных трубок.
Анализ содержимого ситовидных трубок проводится с помощью афидной методики. Для, производящая медвяную росу, прокалывает своим сосущим хоботком отдельные ситовидные трубки, под действием тургорного давления содержимое флоэмы попадает в пищеварительную систему тли, где некоторые азотистые соединения, витамины и минеральные вещества усваиваются организмом насекомого, а избыточный сахар выделяется в виде медвяной росы (10 — 15%-й водный раствор сахара). При помощи лазера отделяют хоботок тли, получая таким образом доступ к чистому содержимому ситовидных трубок, и анализируют его. Прикрепляя к хоботку зонд, измеряющий давление, можно также определить величину тургора в ситовидных трубках.
Сахар составляет, как правило, более 90 % сухого вещества «сока ситовидных трубок» Принимая во внимание типы транспортного сахара флоэмы, можно выделить три основные группы растений
1. Виды, которые в качестве основного транспортного сахара содержат сахарозу. Сюда относится большинство изученных видов, например, все известные ныне папоротники, голосеменные и однодольные растения, из двудольных — все известные бобовые.
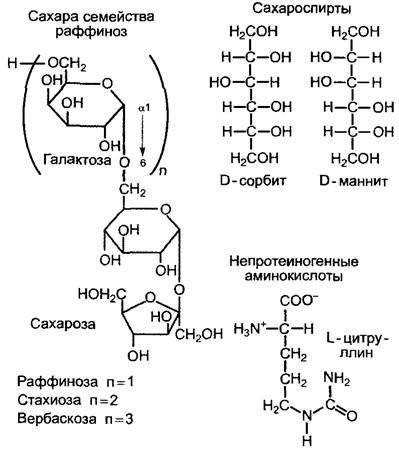
2. Виды, которые наряду с сахарозой содержат значительное количество олигосахаридов семейства раффиноз, например, раффинозы, стахиозы, вербаскозы, аюгозы (при этом имеются в виду сахарозогалактозиды, рис 6 91). К данной группе относятся также представители многочисленных семейств растений, из отечественных, например, Betulaceae(бывшие Corylaceae), Malvaceae (бывшие Tihaceae), Ulmaceae и Cucurbitaceae.
3. Виды, которые наряду с названными сахарами содержат в ситовидных трубках большие количества сахароспиртов (см рис 6 91), например, Oleaceae содержат маннит («ясеневая манна» с высоким содержанием маннита получают из Fraxinus ornus), растения из некоторых подсемейств Rosaceae содержат сорбит, Celastraсеае — дульцит.
Восстановленный азот транспортируется по флоэме преимущественно в форме протеиногенных аминокислот (в основном глутамина, глутамата, аспартата) У Betulaceae и Juglandaceae важнейшей транспортной формой азота является непротеиногенная аминокислота L-цитруллин (см рис 6 91), она служит также для запасания азота
Рис. 6.91. Структура некоторых дополнительных транспортных ассимилятов, которые имеются у определенных групп растений (см текст) наряду с общими транспортными метаболитами (сахарозой как углеводом, протеиногенными аминокислотами, в основном глутамином, глутаматом, аспартатом)
Ассимиляты, образованные в фотосинтезирующих тканях листа (в основном углеводы и аминокислоты), попадают из клеток мезофилла в ситовидные элементы тончайших листовых жилок и пересекают при этом окружающие проводящий пучок клетки обкладки пучка и паренхиму флоэмы; таких клеток совсем немного: 3 — 5. Транспорт осуществляется путем диффузии через многочисленные плазмодесмы между этими клетками. Загрузка ситовидных элементов (ситовидных трубок или клеток) начинается отсюда и происходит двумя способами (см. рис. 6.72): либо апопластически, либо симпластически. Вероятно, эти два пути могут комбинироваться
Апопластическая загрузка флоэмы преобладает у видов, которые используют в качестве транспортного сахара сахарозу. По пути из мезофилла в паренхиму флоэмы сахароза проникает в апопласт. Это происходит благодаря пассивной диффузии, так как в данных клетках концентрация сахарозы намного выше, чем в апопласте. Транспортная система неизвестна. Из апопласта сахароза с помощью специального транслокатора, сахарозо-протонного симпортера, попадает в клетки-спутницы (или их функциональные эквиваленты) и далее — в ситовидные клетки. Движущую силу для поглощения сахарозы флоэмой поставляет транслоцирующая ионы водорода АТФаза, которая относится к Р-типу (см. 6.1.5, рис. 6.5); поступление сахарозы во флоэму является вторично активным процессом, который ведет к концентрированию сахарозы в ситовидных трубках. Необходимую для поддержания протонного градиента АТФ дает митохондриальное дыхание. В результате действия дыхательных ядов процесс загрузки флоэмы у растений с апопластическим типом загрузки эффективно тормозится. Сахарозо-протонный симпортер удалось клонировать (см. бокс 7.3) и локализовать в плазматической мембране клеток-спутниц (например, у подорожника) или ситовидных клеток (у картофеля, томатов, табака) с помощью специфичных антител. Безъядерные ситовидные элементы часто получают сахарозу от клеток-спутниц, в плазмалемме которых содержится много молекул транспортеров сахарозы. В клетках-спутницах поглощенная сахароза должна посредством диффузии1 попасть через плазмодесмы в ситовидные трубки.
1 См. примечание к подразделу 6.8. — Примеч. ред.
Симпластическая загрузка флоэмы свойственна видам, которые наряду с сахарозой транспортируют значительные количества олигосахаридов семейства раффиноз (см. рис. 6.91). При цитологическом изучении у этих видов можно обнаружить многочисленные плазмодесмы, которые симпластически связывают все клетки транспортного пути. Как достигается наблюдаемое в ситовидных клетках повышение концентрации углеводов, неясно. Согласно новой гипотезе, синтез раффинозных сахаров из сахарозы и галактозы у этих видов должен происходить исключительно в клетках, окружающих ситовидные, поэтому концентрация сахарозы в этих клетках сохраняется на низком уровне, что обеспечивает ее диффузию из мезофилла. Данная модель дает представление о чрезвычайно селективной проводимости плазмодесм (см. 7.4.4.1), т.е. раффинозные сахара могут диффундировать в ситовидные трубки, но не обратно в мезофилл1. Однако это до сих пор не подтверждено экспериментально.
1 Можно также предположить, что селективность обеспечивается компартментацией сахарозы и раффинозных сахаров в разных частях ЭПР. По этой модели концентрирование сахаров идет за счет везикулярного транспорта с участием цитоскелета. — Примеч. ред.
У растений с апопластической загрузкой флоэмы аминокислоты, вероятно, также поступают в ситовидные трубки с помощью вторично активного аминокислотно-протонного симпортера. Эти транслокаторы все же не обладают особой специфичностью в выборе субстрата, т.е. все синтезированные в данном месте аминокислоты попадают во флоэму. Примечательно, что растения с симпластической загрузкой флоэмы используют также специальные транспортные аминокислоты (Сucurbitасеае, например, транспортируют непротеиногенную аминокислоту цитруллин (см. рис. 6.91), промежуточный продукт в биосинтезе аргинина). Причину нужно искать в том, что эффективная симпластическая загрузка флоэмы аминокислотами, как и в случае с углеводами, требует направленного синтеза специфических транспортных веществ.
6.8.3. Транспорт ассимилятов по флоэме
В пределах ассимилирующих органов производятся осмотически активные метаболиты в высоких концентрациях (около 0,2 — 0,7 моль • л-1 углеводов и около 0,05 моль • л-1аминокислот). Пассивный приток воды из окружающих тканей (из ксилемы в том числе) создает в месте загрузки флоэмы высокий тургор. Ситовидные клетки в эксперименте можно подвергнуть плазмолизу. Это означает, что они имеют интактную плазмалемму с избирательной проницаемостью. С другой стороны, в местах потребления ассимилятов происходит их изъятие из флоэмы (см. 6.8.4; рис. 6.72), которое является причиной последующего пассивного оттока воды и соответствующего понижения тургора. Вода при этом поступает в ксилему. Таким образом, тесное соседство ксилемы и флоэмы вполне объяснимо.
Между местами загрузки и разгрузки флоэмы в ситовидных трубках (клетках) в итоге возникает градиент давления. Этот градиент давления, согласно гипотезе тока под давлением, изначально сформулированной Мюнхом, ведет к массовому потоку содержимого ситовидных трубок от органов-доноров к органам-акцепторам (англ. source-to-sink). В массовом токе по флоэме переносятся растворенные вещества. При этом скорость течения достигает от 0,5 — 1,5 м/ч, что позволяет быстро доставлять ассимиляты на далекие расстояния (содержимое одного звена ситовидной трубки у липы, например, меняется 5 раз за секунду!). При средней скорости течения от 0,6 м • ч-1 и 0,5 моль • л-1 сахарозы поток составляет около 100 кг сахарозы в ч-1 • м-2 поперечного среза ситовидных трубок.
Градиент тургора в ситовидных трубках в направлении транспорта ассимилятов можно определить разными экспериментальными способами. Для преодоления сопротивления течению ситовидной трубки необходим градиент давления от -0,04 МПа • м-1 (если принять за основу типичные размеры клеток и вязкость содержимого ситовидных трубок), около половины сопротивления течению приходится на ситовидные пластинки ситовидных трубок, т. е. на наклонные пористые поперечные стенки ситовидных клеток (см. 3.2.4.1). Считается, что сопротивление течению ситовидных пластинок/ поперечных стенок благоприятствует выравниванию градиента тургора, приводящего в движение массовый ток по флоэме, так как в непрерывном столбе жидкости градиент давления очень быстро снижается. Движущей силой массового тока по флоэме могут быть очень многие локальные осмотические градиенты между ситовидными элементами и окружающими источниками ассимилятов и их потребителями.
Согласно теории тока под давлением, направление движения транспорта веществ во флоэме определяется осмотическими перепадами концентраций ассимилятов (и одновременно градиентом тургора) от доноров к акцепторам. В качестве органов-поставщиков (source) функционируют, например, фотосинтезирующие взрослые листья или запасающие органы во время мобилизации запасных веществ (например, стволы или корни во время разворачивания листьев; семядоли или эндосперм во
время прорастания семян; клубни, луковицы, корнеплоды в процессе роста побега)- Особенно интенсивный экспорт азотсодержащих веществ начинается в листьях многолетних растений перед листопадом; он возвращает многолетние (переживающие зиму) органы большую часть белкового азота листьев после его гидролиза до аминокислот. Общая концентрация аминокислот во флоэме в течение этой фазы может достигать 0,5 моль л-1; углеводов в содержимом флоэмы в это время почти нет.
В качестве органов-потребителей(sink) функционируют все развивающиеся части растения (например, верхушечная меристема побега и корня; камбий; молодые растущие листочки — вплоть до половины и* конечного размера; созревающие плоды)- В одном большом растении может находиться несколько меняющихся в разное время органов-доноров и органов-акцепторов. Так, например, нижние листья часто снабжают корни, верхние, напротив, — верхушку побега, цветки и плоды. Поэтому противоположено направленные транспортные потоки обнаруживаются в одном и том же отрезке побега, но никогда — в одной и той же ситовидной трубке.
Разгрузка флоэмы может также происходить либо симпластическим путем, либо ацопластическим (см. рис. 6.72). В первом случае отток ассимилятов из ситовидных элементов в клетки органа-акцептора происходит по плазмодесмам. Это, скорее всего, имеет место в основном в незапасаю- щцх тканях, например, в растущих корнях и добегах. Благодаря метаболическим процессам в их клетках, предположительно, сохраняется постоянным нужный для разгрузки флоэмы градиент концентрации. При апопластической разгрузке, важеной для запасающих тканей, ассимиляты сначала попадают в апопласт, а оттуда — в запасающие клетки. Транспортные белки в отдельности еще не охарактеризованы. Протонные симпортеры метаболитов, возможно, все же играют роль при поглощении ассимилятов запасающими клетками.
С одной стороны, сахароза вступает в метаболический процесс в клетках согласно последовательности реакций, представленной на рис. 6.72 (начинается с сахарозосинтазной реакции), образованный при этом глюкозо-6-фосфат (у некоторых видов также глюкозо-1 -фосфат) транспортируется в лейкопласты посредством фосфатного транслокатора, где вовлекается в синтез запасного крахмала. С другой стороны, гидролизуется с помощью фермента инвертазы, т. е. разлагается в апопласте на глюкозу и фруктозу. Образованные гексозы поступают в клетки с помощью гексозо- протонного симпортера, фосфорилируются и используются в синтезе запасного крахмала (см. рис. 6.72).
Некоторые виды запасают углеводы в форме сахарозы (сахарная свекла, сахарный тростник) или глюкозы (некоторые плоды, например, виноград). Запасание этих растворимых сахаров происходит в вакуолях. Наряду с крахмалом дополнительные полисахариды выступают в роли запасных углеводов (см. 6.17.1.2).
Многие процессы обмена веществ, расходующие и мобилизующие ассимиляты, регулируются ростовыми и ингибирующими веществами, поэтому не приходится удивляться, что соответствующее размещение доноров и акцепторов ассимилятов тесно связано с локальной активностью регуляторов роста: так, например, фитогормоны могут побуждать камбий к делению и определяют его деятельность в качестве ткани-акцептора. Цитокинины (группа фитогормонов, см. 7.6.2) должны способствовать синтезу апопластической инвертазы, что приводит к усилению гидролиза сахарозы в апопласте соответствующих клеток и способствует изъятию сахарозы из флоэмы. Следовательно, цитокинины регулируют «акцепторную силу» (англ, sink strength) органа или ткани.
Трансгенные растения (см. бокс 7.3), которые аккумулируют больше инвертазы в апопласте запасающих органов, способны к усиленному запасанию крахмала в этих органах. Это свидетельствует о том, что активность инвертазы в органе-акцепторе может служить ограничивающим фактором для разгрузки флоэмы.