Фізіологія людини - Вільям Ф. Ґанонґ 2002
Ендокринна система, метаболізм і репродуктивна функція
Ендокринні функції підшлункової залози й регулювання метаболізму вуглеводів
Вплив інших гормонів та фізичних навантажень на метаболізм вуглеводів
Фізичні навантаження безпосередньо впливають на метаболізм вуглеводів. Багато гормонів, окрім інсуліну, ІФР-І, ІФР-ІІ, глюкагону та соматостатину, також відіграють важливу роль у регулюванні процесів метаболізму вуглеводів. До них належать адреналін, тиреоїдні гормони, глюкокортикоїди та гормон росту. Інші функції цих гормонів розглянуто в інших розділах, тут лише підсумовано їхній вплив на метаболізм вуглеводів. Місце дії цих гормонів на окремі ланки обміну речовин описано в Розділі 17.
Фізичні навантаження
Надходження глюкози в скелетні м’язи збільшується під час фізичних навантажень без інсуліну, що зумовлено інсулінонезалежним збільшенням кількості транспортерів GLUT 4 у мембранах м’язових клітин (див. вище). Це збільшення чутливості простежується протягом кількох годин після навантажень, і регулярні тренування дають змогу виробити тривале збільшення чутливості до інсуліну. Фізичні навантаження можуть прискорювати гіпоглікемію в діабетиків не лише внаслідок збільшеного поглинання глюкози в м’язах, а й тому, що поглинання введеного інсуліну швидше у разі навантажень. Пацієнти з діабетом повинні споживати додаткові калорії або зменшити дозу інсуліну у випадку фізичних навантажень.
Катехоламіни
Активування фосфорилази в печінці за допомогою катехоламінів розглянуто в Розділах 17 і 20. Цей процес відбувається через ß-адренергічні рецептори, які збільшують внутрішньоклітинний цАМФ, та а-адренергічні рецептори, які збільшують внутрішньоклітинний Са2+. Печінковий вихід глюкози збільшується, створюючи гіперглікемію. В м’язах фосфорилаза також активована через цАМФ і, можливо, через Са2+, однак сформований глюкозо-6-фосфат може катаболізуватись лише до пірувату, оскільки нема глюкозо-6-фосфатази. З причин, які остаточно нез’ясовані, великі кількості пірувату перетворюються в лактат, який дифундує з м’язів у кров’яне русло (рис. 19-19). Лактат окислюється в печінці до пірувату і перетворюється в глікоген. Отже, відповіддю на введення адреналіну є початковий глікогеноліз, що супроводжується підвищенням печінкового вмісту глюкози. Окиснення лактату може відповідати за калоригенний ефект адреналіну (див. Розділ 20). Адреналін та норадреналін також вивільняють ВЖК в кров’яне русло, а адреналін знижує периферійну утилізацію глюкози.
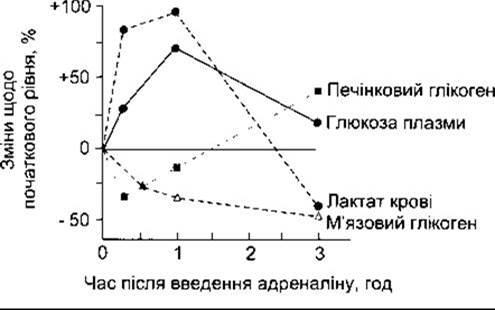
Рис. 19-19. Вплив адреналіну на тканинний глікоген, глюкозу плазми та рівні лактату у крові годованих щурів (відтворено за дозволом з Ruch ТС, Patton HD [editors]: Physiology and Biophysics, 20th ed. Vol. 3. Saunders, 1973).
Надниркові медулярні пухлини (феохромоцитоми), що секретують адреналін, спричинюють гіперглікемію, глюкозурію та підвищення рівня метаболізму. Проте гіперглікемічна дія адреналіну є загалом надто короткотривалою, щоб спричинити постійний діабет, і метаболічні аномалії зникають після видалення пухлин.
Тиреоїдні гормони
Тиреоїдні гормони погіршують експериментальний діабет: тиротоксикоз загострює клінічний діабет; а метатиреоїдний діабет можна зумовити у тварин зі зменшеним резервом підшлункової залози. Головним діабетогенним ефектом тиреоїдних гормонів є збільшене поглинання глюкози з кишки, однак вони також спричинюють (можливо, шляхом підсилення дії катехоламінів) певний ступінь виснаження глікогену печінки. Гепатоцити із глікогеновим виснаженням легко ушкоджуються. Якщо печінка пошкоджена, то крива толерантності до глюкози набуває діабетичного вигляду, оскільки печінка поглинає менше абсорбованої глюкози. Тиреоїдні гормони також можуть прискорювати розпад інсуліну. Усі ці дії мають гіперглікемічний ефект і, якщо резерви підшлункової залози низькі, можуть призвести до виснаження В-клітин.
Надниркові глюкокортикоїди
Глюкокортикоїди з кори наднирників (див. Розділ 20) підвищують рівень глюкози в крові і зумовлюють діабетичний тип кривої толерантності до глюкози. В людей така дія може виявлятись лише в осіб з генетичною схильністю до діабету. Толерантність до глюкози зменшена у 80% людей з синдромом Кушінґа (див. Розділ 20); 20% з них мають явний діабет. Глюкокортикоїди потрібні для глюконеогенної дії глюкагону під час голодування. Вони є глюконеогенними самі по собі, однак їхня роль головно факультативна. У разі наднирникової недостатності рівень глюкози в крові є в межах норми під час споживання їжі, однак голодування спричинює гіпоглікемію і колапс. Глюкозознижувальна дія інсуліну значно підсилена в пацієнтів з наднирниковою недостатністю. У тварин з експериментальним діабетом адреналектомія помітно поліпшує діабет.
Складні дії глюкокортикоїдів, що впливають на метаболізм вуглеводів, підсумовані в табл. 19-9. Головними діабетогенними ефектами є підвищення катаболізму білків зі збільшенням глюконеогенезу в печінці; збільшення печінкового глікогенезу та кетогенезу; зменшення периферійної утилізації глюкози щодо рівня інсуліну в крові, що може бути наслідком сповільненого фосфорилювання глюкози (див. нижче).
Гормон росту
Гормон росту людини погіршує клінічний діабет, а 25% пацієнтів з пухлинами передньої частки гіпофіза, що секретують гормон росту, мають діабет. Гіпофізектомія поліпшує діабет і збільшує чутливість до інсуліну навіть більше, ніж адреналектомія, тоді як дія гормону росту зменшує здатність реагувати на інсулін.
Крім того, гормон росту мобілізує ВЖК з жирової тканини, сприяючи кетогенезу; зменшує поглинання глюкози в деяких тканинах (антиінсулінова дія); збільшує печінковий вихід глюкози і може зменшувати тканинне зв’язування інсуліну. Зроблено припущення, що кетонемія і зменшена толерантність до глюкози, утворені під час голодування, є наслідком гіперсекреції гормону росту. Цей гормон прямо не стимулює секреції інсуліну, однак гіперглікемія, яку він спричинює, вторинно стимулює підшлункову залозу і врешті-решт може виснажити В-клітини.
Таблиця 19-9. Дії глюкокортикоїдів, що впливають на метаболізм вуглеводів

Є докази, що гормон росту зменшує кількість інсулінових рецепторів, а глюкокортикоїди зменшують їхню спорідненість (до інсуліну). Однак зменшення утилізації глюкози, спричинене цими гормонами, є більше наслідком пригнічення фосфорилювання глюкози, ніж зменшення надходження глюкози в клітини. Вхід у клітини - це обмежувальний у швидкості етап метаболізму глюкози, однак якщо є достатня кількість інсуліну, то зменшення фосфорилювання може зменшити утилізацію.