ОСНОВЫ МИКРОБИОЛОГИИ - Е. Ю. Тюменцева - 2015
ТЕМА 7. МИКРОБИОЛОГИЯ ПРОДОВОЛЬСТВЕННЫХ ТОВАРОВ
Плоды, овощи, мясо, рыба, молоко и молочные продукты играют значительную роль в питании человека, и в то же время они наиболее подвержены микробной порче в связи с благоприятным химическим составом.
Для быстрого обнаружения и выявления путей проникновения микроорганизмов-вредителей в производство, очагов и степени размножения их на отдельных стадиях технологического процесса, предотвращения развития посторонней микрофлоры путем использования различных профилактических мероприятий проводят микробиологический контроль по стандартным методикам.
7.1. Микробиологический контроль
Плоды и овощи являются живыми организмами и обладают способностью противостоять воздействию микроорганизмов. Иммунитет плодов и овощей определяется некоторыми их свойствами: высокой кислотностью сока мякоти, наличием глюкозидов, эфирных масел, дубильных веществ, фитонцидов и др. Иммунитет плодов и овощей определяется также веществами фенольного характера, образующимися в местах ранений и местах внедрения возбудителей болезней. Эти вещества подавляют многих возбудителей болезней плодов и овощей.
Изучая микробиологию мяса, необходимо уяснить, что по физико-химическим свойствам оно представляет собой благоприятную среду для развития микроорганизмов и может легко подвергаться бактериальной порче.
При изучении микробиологии рыбы нужно отметить, что рыба хранится целиком, в связи с чем она является носителем самых разнообразных микробов, находящихся не только на ее поверхности - в слое слизи, но и внутри - в кишечнике, жабрах. В больной рыбе еще при жизни содержится больше микроорганизмов, чем в здоровой, и после вылова она портится быстрее.
Изучая микробиологию молока и молочных товаров, следует уяснить, откуда в молоко попадают микроорганизмы, чем определяются бактерицидные свойства свежего молока и при каких условиях эти свойства сохраняются длительно, что такое нормальная и анормальная микрофлора молока; какова динамика изменения микрофлоры молока при хранении; каким бактериологическим требованиям должно удовлетворять пастеризованное молоко, направляемое в реализацию.
При изучении микрофлоры баночных консервов необходимо уяснить, что представляет собой остаточная микрофлора консервов, какие виды микроорганизмов наиболее часто обнаруживаются в консервах после стерилизации, какими микроорганизмами и при каких условиях вызывается биологический бомбаж консервов, каким другим видам бактериальной порчи могут подвергаться консервы.
Задача микробиологического контроля - быстрое обнаружение и выявление путей проникновения микроорганизмов-вредителей в производство, очагов и степени размножения их на отдельных стадиях технологического процесса, предотвращение развития посторонней микрофлоры путем использования различных профилактических мероприятий.
Микробиологический контроль проводится заводскими лабораториями систематически. При отсутствии микробиологической лаборатории на предприятии указанный контроль может осуществляться по хоздоговору с органами Госсанэпиднадзора или лабораториями, аккредитованными для проведения микробиологических исследований. Он осуществляется на всех этапах технологического процесса, начиная с сырья и кончая готовым продуктом на основании утвержденных государственных стандартов (ГОСТ), технических условий (ТУ), инструкций, медикобиологических требований и санитарных норм качества продовольственного сырья и пищевых продуктов, а также другой нормативной документации. Для отдельных производств имеются свои схемы микробиологического контроля, в которых определены объекты контроля, точки отбора проб, периодичность контроля, указаны микробиологические показатели, которые необходимо определять, приводятся нормативы по этим микробиологическим показателям.
Многие пищевые продукты являются благоприятной средой для роста и развития посторонних микроорганизмов. Несоблюдение и нарушение технологических режимов переработки сырья, санитарногигиенических условий на производстве, нарушение режимов хранения и сроков реализации пищевой продукции может привести к интенсивному накоплению в них микроорганизмов, способных образовывать токсины, что является причиной пищевых отравлений.
Кроме того, при несоблюдении санитарных правил и норм работниками пищевого предприятия в продукты могут попасть патогенные микроорганизмы - возбудители пищевых инфекций. Поэтому важнейшими характеристиками продовольственных товаров являются их безопасность и микробиологическая стойкость.
Под безопасностью понимают отсутствие вредных примесей химической и биологической природы, в том числе патогенных микроорганизмов и ядовитых продуктов их жизнедеятельности. Понятие «микробиологическая стойкость» подразумевает потенциальные возможности сохранения продукта без порчи.
Микрофлора пищевых продуктов представляет собой сложную динамическую систему, связанную с внешней средой. Это значительно осложняет способы ее исследования и трактовку полученных результатов.
Для оценки качества пищевых продуктов, а также условий их производства и хранения пользуются количественными и качественными показателями. Количественные показатели указывают общее число микроорганизмов определенных групп в 1 г (см3) продукта. Качественные показатели указывают на отсутствие (присутствие) микробов конкретных видов в определенной массе продукта.
При проведении микробиологического исследования пищевых продуктов можно руководствоваться медико-биологическими требованиями и санитарными нормами качества продовольственного сырья и пищевых продуктов (СанПиН 2.3.2.560-96). Микробиологические нормативы для продуктов детского питания представлены в методических указаниях (МУК 4.2.577-96) «Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов».
7.2. Группы микробиологических критериев безопасности пищевых продуктов
1. Группа показателей санитарного состояния.
Непосредственное выявление патогенных микроорганизмов (возбудителей пищевых инфекций) в пищевых продуктах невозможно из-за низкого их содержания в продукте по сравнению с содержанием сапрофитной микрофлоры. Поэтому при санитарной оценке пищевых продуктов используют косвенные методы, позволяющие определить уровень загрязнения продукта выделениями человека. Чем выше этот уровень, тем вероятнее попадание в объект патогенных микроорганизмов - возбудителей кишечных инфекций.
Санитарная оценка пищевых продуктов проводится по двум микробиологическим показателям: общей бактериальной обсемененности (КМАФАнМ) и наличию бактерий группы кишечной палочки (БГКП).
Общая бактериальная обсемененность (КМАФАнМ) - количество мезофильных аэробных и факультативно-анаэробных микроорганизмов в 1 г или 1 см3 продукта. В нормативной документации указывают предельное содержание этих микроорганизмов в единицах КОЕ (колониеобразующих единицах).
Высокая бактериальная обсемененность пищевых продуктов свидетельствует о недостаточной термической обработке сырья, недостаточно тщательной мойке и дезинфекции оборудования, неудовлетворительных условиях хранения и транспортировки продукции.
Общую бактериальную обсемененность определяют в продуктах, в которых отсутствует технически полезная микрофлора (микрофлора заквасок). Для определения этого показателя используют универсальные питательные среды: мясопептонный агар (МПА) или среду для определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов.
Наличие бактерий группы кишечной палочки (БГКП) определяется во всех жидких продуктах, во всех продуктах животного происхождения (за исключением стерилизованных), во многих продуктах растительного происхождения. БГКП объединяют представителей нормальной микрофлоры кишечника человека и относятся к семейству Enterobacteriaceae родов Escherichia, Citrobacter, Enterobacter, Klebsiella, Serratia. БГКП выполняют функцию индикатора фекального загрязнения и относятся к санитарно-показательным микроорганизмам.
Выбор БГКП в качестве санитарно-показательных микроорганизмов для оценки санитарного состояния пищевых продуктов не случаен. Санитарно-показательные микроорганизмы должны отвечать следующим требованиям:
- эти микроорганизмы должны являться представителями нормальной микрофлоры организма, в нем развиваться и размножаться;
- они должны в больших количествах выделяться из организма;
- в окружающей среде они должны длительное время сохранять свою жизнеспособность, но не размножаться;
- они не должны изменяться под действием факторов внешней среды, подавляться или стимулироваться другими микроорганизмами;
- эти микроорганизмы должны равномерно распределяться в исследуемых объектах внешней среды;
- определение этих микроорганизмов должно осуществляться простыми методами.
В нормативных документах обычно указывается количество продукта, в котором БГКП не допускаются. При высоком уровне загрязнения продукта БГКП возрастает вероятность нахождения в нем патогенных микроорганизмов - возбудителей кишечных инфекций (дизентерии, брюшного тифа, холеры и др.). Для определения БГКП применяют накопительную среду Кесслера, а идентификацию этих бактерий проводят с использованием дифференциально-диагностической среды Эндо.
2. Группа условно-патогенных микроорганизмов.
К этой группе относятся микроорганизмы - возбудители пищевых отравлений, таких как Proteus vulgaris, Clostridium perfringens, Bacillus cereus, Staphylococcus aureus, Clostridiumbotulinum.
Условно-патогенные микроорганизмы являются микроорганизмами, которые постоянно присутствуют в окружающей среде и в живых макроорганизмах. Благоприятной средой для роста и развития этих микроорганизмов является мясо и мясопродукты, поэтому именно эти продукты чаще всего являются причиной пищевых отравлений. Таким образом, многие из вышеперечисленных микроорганизмов нормируются в колбасных изделиях и других мясных продуктах.
В мясных и многих растительных консервах нормируют содержание сульфитредуцирующих клостридий, которые развиваются в анаэробных условиях.
В молочных продуктах, богатых белком (например, твороге, сыре), нормируется содержание коагулазоположительного золотистого стафилококка (Staphylococcus aureus) - возбудителя пищевой интоксикации.
При определении условно-патогенных микроорганизмов используют элективные питательные среды. Например, наличие золотистого стафилококка выявляют с помощью молочно-солевого (МСА) или желточно-солевого (ЖСА) агара.
3. Группа патогенных микроорганизмов (приложение 2).
Из патогенных микроорганизмов в пищевых продуктах определяют сальмонеллы. Проводят исследования на наличие сальмонелл органы Санэпиднадзора. Обычно сальмонеллы не допускаются в 25 г (см3) продукта. В некоторых продуктах детского и диетического питания не допускается наличие сальмонелл в 50 и даже в 100 г (см3).
Для определения сальмонелл используют накопительные питательные среды (селенитовую, Кауфмана, Мюллера) и дифференциально-диагностические среды (Плоскирева, Левина).
4. Группа показателей микробиологической стабильности продукта.
К этой группе относятся микроскопические грибы и дрожжи, которые, как известно, являются возбудителями порчи продукта. Этот показатель нормируется во многих продуктах из растительного сырья, а также в продуктах животного происхождения с растительными добавками. Динамику роста грибов и дрожжей обязательно исследуют при установлении сроков годности и режимов хранения новых видов продуктов. Плесени и дрожжи определяют с использованием сусло-агара или среды Сабуро, причем количество колоний грибов и дрожжей, выросших на плотных средах, подсчитывают отдельно.
Кроме вышеперечисленных нормируемых микробиологических показателей для прогнозирования качества выпускаемой пищевой продукции целесообразно определять отдельные группы микроорганизмов, которые являются представителями технически полезной и технически вредной микрофлоры.
Так, в производстве сыров периодически определяют гнилостные бактерии как основные возбудители порчи сыров, а также следят за развитием полезных микроорганизмов (молочнокислых и пропионовокислых бактерий) в процессе выработки сыров.
7.3. Понятие о системе критических контрольных точек (НАССР)
В целях гарантии качества выпускаемой пищевой продукции, ее безопасности за рубежом активно внедряется система критических контрольных точек (НАССР) в качестве основы экспертизы пищевых продуктов. НАССР расшифровывается как Hazard Analysis Critical Control Paint (критические пределы надзора вредных факторов).
Характерной особенностью данной системы является планомерный надзор и контроль пищевых продуктов при предварительном определении всех возможных факторов, связанных с полным циклом обращения с пищевыми продуктами. Этот надзор начинается с контроля условий выращивания животных и контроля условий произрастания растений; с контроля среды обитания промысловых животных и гидробионтов. Далее проводят контроль условий получения сырья, и контроль производства определенного продукта из этого сырья. Заканчивается надзор исследованием готового продукта после его приготовления, хранения, транспортировки и реализации.
Эта система существенно отличается от ранее применявшегося метода санитарно-гигиенического контроля и надзора, в котором основное внимание было уделено надзору лишь конечных продуктов.
Хотя система критических контрольных точек была разработана для микробиологического контроля пищевых продуктов, в последнее время она успешно применяется и для контроля и предотвращения остаточных химических веществ, в том числе и химикатов сельскохозяйственного назначения (удобрений, гербицидов, пестицидов и др.), антибактериальных веществ, гормонов, а также включений инородных веществ в пищевые продукты.
Международным комитетом по стандартизации микроорганизмов пищевых продуктов (ICMSF) рекомендовано Всемирной организации здравоохранения (ВОЗ) внедрить НАССР в международный стандарт. В настоящее время в странах ЕС считается обязательным обработка и производство импортированных мяса и морепродуктов с применением системы НАССР.
7.4. Схема разведения пищевого продукта и проведения микробиологического исследования
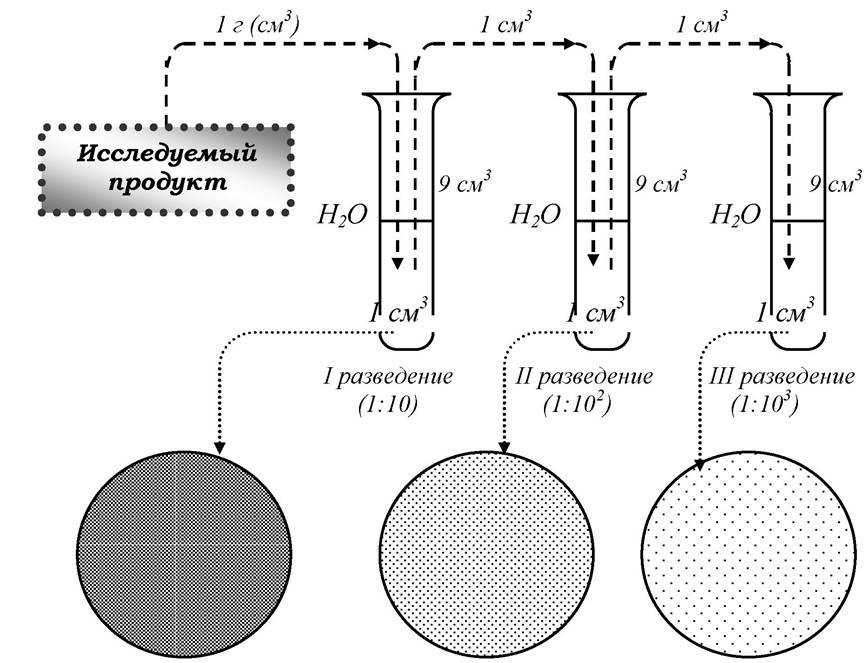
Для приготовления разведений продукта используют пробирки с 9 см3 стерильной воды. Иногда для приготовления разведений используются стерильные растворы разбавленного фосфатного буфера, изотонического раствора хлорида натрия, пептонной воды или лимоннокислого натрия. В первую пробирку стерильной пипеткой вносят 1 см3 продукта. Новой стерильной пипеткой тщательно перемешивают содержимое пробирки (разведение 1:10). Затем этой же пипеткой из пробирки с разведением 1:10 отбирают 1 см3 жидкости и переносят во вторую пробирку с водой (разведение 1:100). Количество разведений рассчитывают таким образом, чтобы в чашках Петри выросло от 30 до 300 колоний.
Так, при исследовании пастеризованного молока рекомендуется готовить I, II и III разведение продукта, так как нормируемое значение количества мезофильных аэробных и факультативноанаэробных микроорганизмов в питьевом молоке не более 50-200 тыс. КОЕ/см3.
На рисунке 5 представлена схема приготовления разведений продукта и высева его в чашки Петри.
Рис. 5. Схема приготовления разведений продукта и высева его в чашки Петри
Рекомендации при приготовлении I разведения (1:10):
1) из кондитерских изделий с кремом, из маргарина.
1 г крема или маргарина взвешивают с соблюдением правил асептики и вносят в пробирку с 9 см3 воды. Затем пробирку помещают в водяную баню с температурой 50-55 °С. Выдерживают пробирку на водяной бане до полного расплавления крема. Содержимое пробирки тщательно перемешивают и для последующих разведений отбирают 1 см3жидкости, находящейся под слоем масла;
2) из продуктов, имеющих плотную и неоднородную консистенцию (например, из колбасных изделий, овощных консервов).
1 г средней пробы исследуемого продукта взвешивают с соблюдением правил асептики, помещают в стерильную ступку. В ступку также вносят 9 см3 стерильной воды, и материал растирают с песком в течение 10-15 мин вблизи пламени горелки до получения однородной массы. Далее дают взвесям осесть и отбирают 1 см3 надосадочной жидкости для приготовления разведения 1:100.
7.5. Чашечные методы количественного учета микроорганизмов
Сущность чашечных методов количественного учета микроорганизмов заключается в посеве разведений продукта на стерильные плотные питательные среды в чашки Петри с последующим культивированием и подсчетом выросших в чашках колоний. При этом считается, что каждая колония является результатом размножения одной клетки.
Учет результатов при использовании чашечных методов. Количество выросших колоний подсчитывают в каждой чашке, поместив ее вверх дном на темном фоне, пользуясь лупой с увеличением от 4 до 10 раз. При большом количестве колоний и равномерном их распределении дно чашки делят на сектора, подсчитывают число колоний в 2-3 секторах, находят среднеарифметическое число колоний и умножают на разведение (10 - при первом разведении продукта, 100 - при втором разведении и т. д.).
Если инкубированные чашки с первым разведением (1:10) не содержат колоний, то результат выражают так: меньше 1х10 КОЕ/см3 (КОЕ - колониеобразующие единицы).
Если в чашках Петри с I разведением (1:10) содержится меньше, чем 15 колоний, то результат выражается так: количество микроорганизмов менее Мх10 КОЕ/г, где М - число выросших колоний.
Если количество колоний более 15, то подсчитывают количество колоний в чашках, умножают на разведение и полученный результат округляют в соответствии с ГОСТ 26670-91 «Продукты пищевые. Методы культивирования микроорганизмов»:
- до числа, кратного 5, если количество колоний в чашке менее 100;
- числа, кратного 10, если количество колоний в чашке более 100.
Пример: посеяно I разведение продукта 1:10. В чашке Петри выросло 194 колонии. Полученный результат округляем до 200.
Количество микроорганизмов в продукте: 200x10 = 2,0х103 КОЕ/г. Чашечными методами определяют следующие микробиологические показатели: КМАФАнМ, количество спор грибов и дрожжей, содержание гнилостных бактерий, коагулазоположительных стафилококков.
7.6. Практическое определение микроорганизмов
Определение мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ)
Перед посевом чашки маркируют.
По 1 см3 разведений продукта вносят в чашки Петри. Пипетку с посевным материалом держат под углом 45 °С, касаясь концом пипетки дна чашки. Затем в каждую чашку наливают по 12-15 см3 мясопептонного агара или среды для определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов, расплавленной и охлажденной до 45 °С. Сразу после заливки агара содержимое тщательно перемешивают путем легкого вращательного покачивания для равномерного распределения посевного материала. Если ожидают ползучий рост микроорганизмов, посевы после застывания агара заливают вторым слоем питательной среды или 3-5 см3 водного раствора агара. После застывания среды чашки Петри переворачивают крышками вниз и помещают в термостат при (30±1) °С на 72 часа (допускается предварительный учет через 48 часов с последующим окончательным учетом через 24 часа).
Определение количества грибов и дрожжей.
Ведут так же, как и определение КМАФАнМ, только в качестве питательной среды используют сусло-агар или среду Сабуро. Инкубацию посевов ведут при температуре 24 °С в течение 5 суток с предварительным учетом через 3 суток.
Определение протеолитических (гнилостных) бактерий
Соответствующее разведение продукта засевают на молочный агар, инкубацию посевов проводят при 30 °С в течение 72 часов. Протеолитические бактерии на молочном агаре при своем росте образуют зоны просветления агара (зоны протеолиза). Пептонизирующие бактерии образуют узкие зоны пептонизации.
Определение коагулазоположительных стафилококков.
Ведут так же, как и определение КМАФАнМ. В качестве питательной среды используют молочно-солевой или желточносолевой агар. Культивирование проводят при 37 °С в течение 24-48 часов. При росте на желточно-солевом агаре вокруг колоний образуются перламутровые зоны помутнения агара, а на молочносолевом агаре - небольшие зоны пептонизации.
Определение аэробных спорообразующих бактерий рода Bacillus
Исследуемый материал или разведение продукта перед посевом пастеризуют при 75-85 °С в течение 20 мин. Далее ведут определение так же, как и при определении КМАФАнМ. После пастеризации вегетативные клетки погибают, а споры после посева на МПА и культивирования при 37 °С прорастают и в течение 24-48 часов образуют колонии.
Методы, основанные на накоплении микроорганизмов с последующей их идентификацией
Эти методы используются для выявления микроорганизмов, содержание которых незначительно в сравнении с общим количеством микроорганизмов. Сущность этих методовзаключается в посеве продукта или его разведений на накопительные жидкие среды. Если после культивирования обнаруживают рост микроорганизмов (образование осадка, помутнение среды, накопление газа в поплавках), то в дальнейшем, проводят пересев из пробирок, в которых замечен рост на дифференциально-
диагностические среды для идентификации выросших на накопительной среде микроорганизмов.
К таким методам относятся определение наличия БГКП, сальмонелл.
Определение бактерий группы кишечной палочки
Для посева используют то количество продукта, в котором предусматривается отсутствие БГКП (1 см3 молока или 1 см3 первого разведения молока). Посев проводят в пробирки со средой Кесслера с поплавками. Посевы помещают в термостат с температурой 37°С на 24 часа.
При отсутствии признаков роста (газообразования в поплавках, помутнения среды) дают заключение об отсутствии БГКП и соответствии исследуемого продукта нормативу на БГКП.
При положительной бродильной пробе для окончательного заключения о наличии в продуктах БГКП из подозрительных пробирок производят посев на чашки со средой Эндо или Левина. Посев производят петлей из каждой пробирки так, чтобы получить рост изолированных колоний. Чашки помещают в термостат.
Учет результатов. При отсутствии на среде Эндо или Левина колоний, типичных для БГКП (на среде Эндо - красных с металлическим блеском, на среде Левина - черных с металлическим блеском, темных с черным центром, сиреневых с темным центром) считают, что продукт соответствует нормативу. При наличии на среде Эндо или Левина типичных колоний их окрашивают по Граму и микроскопируют. Обнаружение грамотрицательных, не содержащих спор палочек указывает на наличие БГКП в анализируемой пробе и несоответствие продукта микробиологическому нормативу.
Определение сальмонелл
Асептически взвешенные навески сухих компонентов или стерильно отмеренные объемы жидких компонентов (обычно 25 г или 25 см3) засевают в колбы с магниевой средой или средой Мюллера (накопительные среды для сальмонелл), соблюдая соотношение продукта и среды не менее 1:9.
Для жидких продуктов допускается использование среды с двойной концентрацией ингредиентов при соотношении продукта и среды 1:1.
Колбы с посевами помещают в термостат с температурой 37 °С на 18-24 часа.
После инкубации в термостате производят высев из колб с накопительными средами на поверхность дифференциальнодиагностических сред (среду Плоскирева или висмут-сульфитный агар). Для получения отдельных колоний петлей берут минимальное количество посевного материала и производят посев штрихом. Чашки с посевами помещают в термостат с температурой 37 °С. Проверку посевов осуществляют дважды: через 24 и 48 часов после инкубации в термостате.
Учет результатов. На среде Плоскирева колонии сальмонелл бесцветные, прозрачные, плоские, на висмут-сульфитном агаре - черные, с характерным металлическим блеском, зеленоватые с черным ободком, при этом наблюдается прокрашивание в черный цвет участка среды под колонией.
При отсутствии типичных колоний сальмонелл на каждой из сред конечный результат анализа записывают как «отрицательный», т. е. в исследуемой массе продукта сальмонеллы отсутствуют.
При наличии на любой из питательных сред на чашках Петри типичных или подозрительных колоний на сальмонеллы, производят их дальнейшее изучение по биохимическим и другим признакам.
Другие методы определения качественных микробиологических показателей
Для определения качества продовольственных товаров используют также и другие методы определения качественных микробиологических показателей, такие как определение анаэробных сульфитредуцирующих клостридий, определение бактерий рода Proteus.
Определение анаэробных сульфитредуцирующих клостридий
В пробирки, содержащие 9 см3 расплавленной и охлажденной до 45 °С плотной среды Вильсона-Блера, вносят, соблюдая правила асептики, 1 см соответствующих разведений исследуемого продукта. Тщательно перемешивают содержимое пробирки, помещают в термостат и культивируют при 37 °С в течение 24 часов. За положительный титр принимают то максимальное разведение продукта, в посеве которого произошло почернение среды.
Определение бактерий рода Proteus
Ведут методом Шукевича. Для определения 0,5 см анализируемой взвеси (разведения) вносят в конденсационную воду свежескошенного агара, не касаясь поверхности среды.
Вертикально поставленные пробирки термостатируют при 37 °С в течение 24 часов. На скошенном агаре палочка протея прорастает в виде голубоватого вуалеобразного налета. При микроскопии препарата обнаруживаются грамотрицательные неспорообразующие палочки.
Методика выполнения лабораторной работы
Цель работы: изучить микрофлору отдельных образцов продовольственных товаров (плодов и овощей, муки, молока, мяса, рыбы и т. д.), используя ранее освоенные методы качественного и количественного анализа.
Материалы, реактивы, оборудование: исследуемые пищевые продукты (крем, маргарин, майонез, питьевое молоко, колбасное изделие, детская молочная смесь, овощные консервы); пробирки с 9 см3 стерильной воды; стерильные пипетки на 1 см3 и чашки Петри; пробирки со стерильными питательными средами: с МПА или средой для определения КМАФАнМ; со средой Сабуро или сусло-агаром; средой Кесслера с поплавками; с солевым агаром и т. п.; набор красок по Граму; бактериологические петли и препаровальные иглы; фильтровальная бумага; предметные и покровные стекла; микроскоп; спиртовка; лоток с рельсами; промывалка; термостаты.
Опыт № 1. Кремовые кондитерские изделия
Кремы, используемые для изготовления тортов и пирожных, являются скоропортящейся продукцией, которая может послужить причиной пищевых отравлений. Помимо различных споровых и неспоровых бактерий, дрожжей, спор плесеней, в кремах могут присутствовать патогенные микроорганизмы. Особенно опасен заварной крем, который отличается от других кремов низкой концентрацией сахара, повышенной влажностью и содержанием муки. Помимо того, что заварной крем быстро закисает в результате развития кислотообразующих бактерий, в нем могут развиваться токсигенный золотистый стафилококк (Staphylococcus aureus) и некоторые условно-патогенные микроорганизмы (например, энтеропатогенные кишечные палочки). Следует помнить, что накопление токсинов в кремовых изделиях происходит при температуре от 15 до 22 °С.
Причинами инфицирования крема может быть сырье (молоко, сливки, сахар, масло, яйца). Нарушение технологического режима и санитарных правил при изготовлении и хранении крема и кремовых изделий приводит к интенсивному развитию микроорганизмов, внесенных с сырьем и микроорганизмов, попадающих в крем в процессе его производства и хранения. Поэтому в соответствии с требованиями по хранению и реализации скоропортящихся продуктов торты и пирожные с различными кремами разрешается хранить при температуре не выше 6 °С в течение ограниченного времени (например, с белково-сбивным кремом не более 72 часов).
Готовые кремовые изделия подвергают микробиологическому контролю. КМАФАнМ в зависимости от вида крема должно быть не выше значения 1х104 - 1х105 КОЕ/г; БГКП не допускаются в 0,01 г; золотистый стафилококк - в 1 г заварного и в 0,01 г сливочного крема. Патогенные микроорганизмы, в том числе сальмонеллы, должны отсутствовать в 25 г крема.
Опыт № 2. Питьевое молоко
Микрофлора питьевого молока состоит из остаточной микрофлоры пастеризованного молока (представлена спорами бацилл и клостридий, а также термоустойчивыми молочнокислыми палочками) и микрофлоры вторичного обсеменения (бактериями группы кишечной палочки, психрофильными гнилостными бактериями, мезофильными молочнокислыми стрептококками и палочками, дрожжами и др.). Микроорганизмы, попадающие в питьевое молоко, могут вызвать пороки консистенции, вкуса и цвета молока. Нормируемые показатели качества питьевого молока представлены в приложении 5. Так, для пастеризованного молока в бутылках и пакетах группы А общая бактериальная обсемененность (КМАФАнМ) не должна превышать значения 5х10 КОЕ/см3, БГКП и золотистый стафилококк не допускаются в 1 см3 молока, а патогенные микроорганизмы, в т. ч. сальмонеллы - в 25 см3.
Опыт № 3. Маргарин и майонез
а) маргарин. Микроорганизмы в производстве маргарина играют двоякую роль. Молочнокислые бактерии, которые входят в состав водно-молочной фазы, являются полезной микрофлорой маргарина, так как придают ему специфический вкус и аромат. Все остальные микроорганизмы, которые попадают с сырьем, из внешней среды являются вредителями производства, снижающими качество маргарина и его стойкость при хранении. Основными источниками посторонней микрофлоры маргарина являются компоненты водномолочной фазы, так как жиры и растительные масла являются неблагоприятной средой для развития микроорганизмов. Микробную порчу маргарина вызывают гнилостные бактерии, которые попадают в маргарин с молоком (вызывают порок горького вкуса), грибы, дрожжи, флуоресцирующие бактерии (вызывают прогорклый вкус и неприятный запах, грибы также являются причиной образования пигментных пятен на маргарине), термоустойчивые молочнокислые бактерии (вызывают излишне кислый вкус). Качество маргарина оценивается по наличию БГКП - не допускаются в 0,01 г, по содержанию в маргарине дрожжей (не более 5х103 КОЕ/г) и плесеней (не более 20 КОЕ/г). Сальмонеллы не допускаются в 25 г маргарина.
б) майонез. В производстве майонеза не используются промышленно полезные микроорганизмы. В этом продукте может находиться только технически вредная микрофлора, попадающая в майонез с поверхности оборудования, и остаточная микрофлора компонентов майонеза. Представители технически вредной микрофлоры майонеза вызывают его газообразование (возбудители порчи - гетероферментативные молочнокислые бактерии и дрожжи), бомбаж банок (возбудитель - маслянокислые бактерии рода Clostridium), горький вкус (возбудители порчи гнилостные бактерии). В маргарине нормируется наличие БГКП (не допускаются в 0,1 см3), содержание дрожжей (не более 5х102 КОЕ/см3), количество плесеней (не более 10 КОЕ/см3), наличие сальмонелл (не допускаются в 25 см3).
Опыт № 4. Овощные консервы
В зависимости от рН и химического состава овощные консервы можно отнести к четырем группам А, Б, В, Г.
Перед тем как проводить микробиологическое исследование овощных консервов, нужно определить к какой их вышеперечисленных групп они относятся. Особо тщательно проверяют консервы с рН более 4,2-4,4, в которых возможно развитие возбудителей пищевых отравлений.
Допустимая общая бактериальная обсемененность (КМАФАнМ) консервов перед их стерилизацией нормируется. Общее число бактерий в 1 г (1 см3) продукта не должно превышать 10 000-50 000 (в зависимости от вида продукта), а в консервах для детского питания - 200. Клостридии должны отсутствовать в 0,5 см3 содержимого банки. Мезофильных бацилл допускается не более 100-300/г.
При исследовании готовых консервов проверяют банки на герметичность, термостатируют банки при 37 °С в течение 5 суток, далее отбирают пробы из банок и проводят микробиологическое исследование. Сохранение нормального внешнего вида тары после термостатирования является одним из показателей микробиологической стабильности консервов. Содержимое дефектных банок с признаками микробной порчи (содержание таких банок допускается не более 0,2 %) анализируют для установления природы дефекта.
Опыт № 5. Колбасные изделия
Колбасы относятся к продуктам, употребляемым в пищу без предварительной термической обработки. В связи с этим колбасы должны отвечать высоким санитарным требованиям. Источниками микрофлоры колбасных изделий являются сырье и микрофлора вторичного обсеменения, попадающая в колбасные изделия в процессе переработки сырья. Поэтому технологические процессы выработки колбасных изделий направлены на придание им соответствующих свойств и на уничтожение микроорганизмов.
Количественный и качественный состав микрофлоры колбас зависит от вида и сорта колбасы. В вареных колбасах, подвергнутых действию высоких температур (68-70 °С внутри батона), погибают бесспоровые бактерии, но остаются невредимыми споры и частично кокковые формы и единичные палочки, т. к. они бывают защищены слоем жира. Стойкость колбасных изделий при хранении зависит от содержания в них влаги, поваренной соли, степени пропитки антисептическими веществами дыма, а главное - от микробного загрязнения колбас. При соблюдении в колбасном производстве санитарно-гигиенических требований и использовании доброкачественного сырья бактериальная обсемененность свежевыработанных готовых изделий составляет: вареных колбас - 103 в 1 г, полукопченых - 102, ливерных - 104-105. Порчу колбас вызывают молочнокислые бактерии (прокисание колбас), гнилостные не спорообразующие палочковидные бактерии и микрококки (ослизнение оболочек), плесени (плесневение колбас) и другие микроорганизмы.
Нормируемыми микробиологическими показателями колбасных изделий являются КМАФАнМ, наличие БГКП, золотистого стафилококка, сульфитредуцирующих клостридий и патогенных микроорганизмов, в т. ч. сальмонелл (приложение 5).
Опыт № 6. Сухие детские смеси
Как видно из таблицы приложения 5, к продуктам детского и лечебного питания предъявляются более жесткие требования, чем к продуктам массового потребления. Соответственно, к промышленному сырью и компонентам, используемым для изготовления продуктов детского питания, также предъявляются повышенные микробиологические требования.
Так, в сухих молочных продуктах, предназначенных детей грудного возраста, нормируются КМАФАнМ (от 2х103 до 2,5х104 КОЕ/г), количество плесеней (от 5х10 до 1х102 КОЕ/г), содержание дрожжей (от 10 до 5х10 КОЕ/г), количество спор Bacillus cereus (не более 1х102-2х102 КОЕ/г), не допускается наличие БГКП в 1 г, E. соli - в 10 г, золотистый стафилококк - в 1-10 г, патогенные микроорганизмы, в т. ч. сальмонеллы - в 50-100 г.
Оформление и анализ результатов исследований
Выполнить микробиологические исследования пищевых продуктов и оформить в тетради по схеме:
1. Подготовка образца к микробиологическому исследованию.
2. Способ выделения микроорганизмов.
3. Способ культивирования микроорганизмов.
4. Способ учета микроорганизмов.
5. Способ идентификации микроорганизмов.
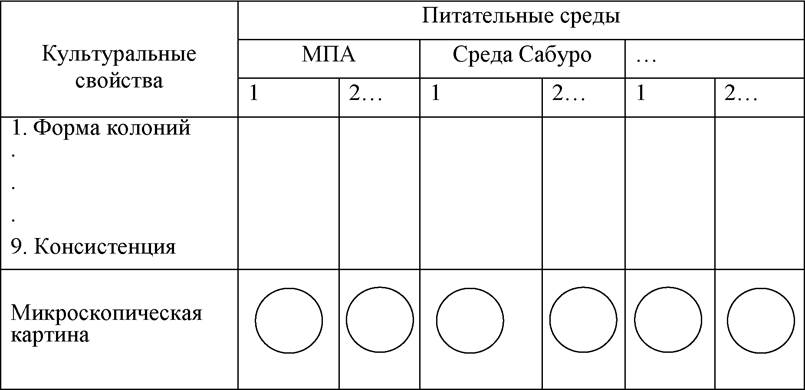
6. Заполнить таблицу 3.
7. Сделать заключение о микробиологическом состоянии изучаемого продукта.
Таблица 3. Культуральные и морфологические признаки выросших в чашках колоний
После ознакомления с данной темой студенты могут оценивать качество и микробиологическую безопасность продукции различного типа.
Контрольные вопросы
1. Какова главная задача микробиологического контроля сырья, полуфабрикатов и готовой продукции на предприятиях пищевой промышленности?
2. Кем и на основании каких документов проводится микробиологическое исследование пищевых продуктов?
3. Дайте определение понятиям «безопасность» и «микробиологическая стойкость» пищевых продуктов.
4. Перечислите группы микробиологических критериев безопасности пищевых продуктов.
5. Какие микробиологические показатели относятся к группе показателей санитарного состояния пищевых продуктов?
6. Что такое общая бактериальная обсемененность (КМАФАнМ)? С какой целью определяется этот показатель?
7. В каких продуктах КМАФАнМ не определяется?
8. С какой целью в пищевых продуктах определяют БГКП?
9. Какие требования предъявляются к санитарно-показательным микроорганизмам?
10. Какие патогенные микроорганизмы нормируются в пищевых продуктах?
11. С какой целью и в каких продуктах определяются условно-патогенные микроорганизмы?
12. Как готовятся разведения пищевых продуктов?
13. С какой целью в пищевых продуктах определяют содержание грибов и дрожжей? Во всех ли пищевых продуктах эти показатели нормируются?
14. Дайте понятие о системе критических контрольных точек (НАССР).
15. Какие микробиологические показатели нормируются в пищевых продуктах: в кремовых изделиях, в колбасных изделиях, в питьевом молоке, в маргарине, детском питании, баночных консервах и др.?
16. В чем сущность чашечных методов определения микроорганизмов в пищевых продуктах?
17. Какие микробиологические показатели определяются чашечными методами?
18. В чем сущность методов, основанных на накоплении микроорганизмов с последующей идентификацией? Какие микробиологические показатели определяются этими методами?
19. Какими методами определяются КМАФАнМ, наличие БГКП, титр анаэробных сульфитредуцирующих клостридий?
20. Как описываются культуральные свойства выросших в чашках колоний микроорганизмов?
21. Каким образом проводят определение коагулазоположительных стафилококков?
22. Что представляет собой эпифитная микрофлора плодов и овощей?
23. Какие виды микробной порчи картофеля и овощей наиболее распространены?
24. Объясните, почему возбудителями порчи плодов и овощей являются в основном плесневые грибы?
25. Какова роль микробов при квашении (солении) и мочении плодов и овощей?
26. Каким образом происходит обсеменение микроорганизмами поверхности мяса?
27. Какое значение имеет бактериоскопическое исследование мяса, и как оно проводится?
28. Какие микроорганизмы встречаются в мясе наиболее часто?
29. Какова микрофлора рыбы?
30. Почему рыба менее стойка при хранении, чем мясо теплокровных животных?
31. Что такое нормальная и анормальная микрофлора молока?
32. Какие заболевания могут распространяться через молоко?
33. Что собой представляет остаточная микрофлора баночных консервов?
34. Какие бактерии вызывают порчу колбасных изделий?
35. От чего зависит стойкость колбасных изделий при хранении?
36. Что является основными источниками посторонней микрофлоры маргарина?