Основы биоинформатики - Огурцов А.Н. 2013
Информационные принципы в биотехнологии
Секвенирование биологических последовательностей и экспрессия генов
Анализ белковой экспрессии
Секвенирование белков. Современные методы секвенирования белков опираются на масс-спектрометрию - методику, позволяющую точно определить отношение массы иона к его заряду в вакууме (m/е или m/z) и по нему вычислить массу молекулы.
Структуру белка определяют путём рентгеноструктурного анализа или спектроскопии ядерного магнитного резонанса (ЯМР-спектроскопии).
Рентгеноструктурный анализ заключается в восстановлении положений атомов на основании анализа дифракционной картины прохождения рентгеновских лучей через точно ориентированный кристалл белка. Рассеянные рентгеновские лучи вызывают положительную и отрицательную интерференцию и создают регулярную картину сигналов, или отражений. Результат зависит от трёх переменных:
1) амплитуда рассеяния;
2) фаза рассеяния (амплитуда и фаза зависят от числа электронов в каждом атоме);
3) длина волны падающих рентгеновских лучей.
Для получения информации о структуре белка методом рентгеноструктурного анализа сначала из раствора, содержащего исследуемую молекулу, выращивается кристалл. Важными параметрами при этом являются концентрация биообъекта, тип и концентрация соли, pH, тип и концентрация поверхностно-активного вещества и прочие добавки, а также температура и скорость кристаллизации. Иногда кристаллы белка удаётся получить лишь после опробования более тысячи различных условий кристаллизации. Затем полученный кристалл облучают рентгеновским пучком.
Дифракционная картина, которая представляет собой сложное, но специфическое для каждого образца распределение пятен, регистрируется детектором и после компьютерной обработки превращается в карту распределения электронной плотности, которая отражает пространственное положение и форму компонентов молекулы.
Самые лучшие кристаллы из биомолекул обеспечивают данные с очень высоким разрешением, и особенности молекулярной структуры, отстоящие друг от друга на 0,1 нм (1 Ангстрем, 1 Å), могут быть легко распознаны на таких картах. Обычно белки исследуются с худшим разрешением в диапазоне 1,5-3,0Å. При разрешении 1,5 Ä легко различимы отдельные атомы, однако при разрешении 3,0 Å, уже надо предварительно знать структуру ковалентных связей, чтобы расшифровать такую карту. Трёхмерная схема распределения электронной плотности затем интерпретируется в терминах атомной структуры. Данные, полученные с высоким разрешением, достаточно легко интерпретируются и могут быть уверенно использованы.
Главным недостатком метода рентгеноструктурного анализа является необходимость выращивания кристалла. При этом конформации молекул в кристалле могут не соответствовать конформациям свободных молекул в растворе, точнее молекулы в кристалле соответствуют какой-либо одной, замороженной, конформации свободной молекулы.
Основанием метода ЯМР-спектроскопии послужил тот факт, что некоторые атомы, включая природные изотопы азота, фосфора и водорода, ведут себя подобно крошечным магнитам и изменяют свой спиновый магнитный момент в приложенном переменном магнитном поле. Эти процессы обусловлены поглощением коротковолнового электромагнитного излучения. Для определения структуры белка применяют также некоторые другие методы: например, ЯМР-спектроскопию с магическим углом вращения и спектроскопию кругового дихроизма.
Предсказание вторичной структуры белка производят с помощью одного из трёх подходов:
1) эмпирические статистические методы, основанные на оценке параметров известных пространственных структур;
2) методы, опирающиеся на физико-химические критерии (такие как компактность свёртки, гидрофобность, заряд, энергия водородной связи и т. д.);
3) алгоритмы предсказания, приписывающие полипептиду вторичную структуру по данным его сравнения с известными структурами гомологичных белков.
Одним из стандартных эмпирико-статистических методов является метод Чоу-Фасмена (Chou-Fasman method), основанный на оценке наблюдаемых в негомологичных белках конформационных предпочтений аминокислот (п. 14.2). Однако, несмотря на стандартность такого подхода, его надёжность при определении конформационных потенциалов аминокислот оказалась неудовлетворительной. Что касается алгоритмов предсказания, то, напротив, за счёт анализа данных множественного выравнивания последовательностей точность предсказаний в данной предметной области существенно возрастает.
Предсказание третичной структуры белка (особенно построенное на предсказанных вторичных структурах молекулы) все ещё лежит за пределом возможного современных компьютеров.
Анализ белков. Общепринятым биохимическим методом анализа белков, в котором белки разделяют по двум независимым параметрам: (1) по изоэлектрической точке (pI) (заряду) и (2) по молекулярной массе - является двумерный электрофорез в полиакриламидном геле (2d-PAGE, или SDS-PAGE - Sodium Dodecyl Sulfate Eolyacrylkmide Gel Electrophoresis).
Разделение в первом измерении выполняют с помощью изоэлектрофокусировки в неподвижном градиенте pH.
Градиент pH образуется рядом буферов, а неподвижный градиент pH создаётся ковалентным связыванием буферных групп с гелем, что предотвращает миграцию самого буфера в ходе электрофореза.
Изоэлектрофокусировка означает принудительную миграцию белков под действием электрического поля до тех пор, пока pH буфера не станет равной pI белка.
Изоэлектрическая точка белка - это величина pH, при которой белок не несет никакого избыточного заряда и поэтому не движется в приложенном электрическом поле.
По окончании миграции гель уравновешивают поверхностно-активным веществом додецилсулъфатом натрия (ДСН, sodium dodecyl sulfate, SDS) (рисунок 72), который однородно связывается со всеми белками и придаёт им избыточный отрицательный заряд.
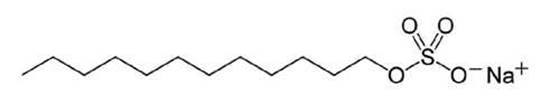
Рисунок 72 - Схема молекулы ДСН (SDS)
Благодаря этому может быть выполнено разделение во втором измерении - по молекулярной массе.
После разделения во втором измерении гель белка окрашивают универсальным красителем, чтобы проявить расположение всех белковых пятен.
Затем для сравнения уровней экспрессии белка могут быть выполнены воспроизводимые сеансы SDS-PAGE с аналогичными образцами (тканей). Таким методом получают диагностический белковый индикатор белка для данного образца.
На рисунке 73 представлен пример результата двумерного электрофореза в полиакриламидном геле. Каждое пятно соответствует определённому белку. Белки в образце были разделены по изоэлектрической точке (по горизонтали) и по молекулярной массе (по вертикали рисунка).

Рисунок 73 - Двумерная электрофореграмма метода SDS-PAGE
Затем окрашенный гель с белками сканируют и получают цифровое изображение, на котором находят и измеряют отдельные белковые пятна и корректируют интенсивность сигнала каждого пятна по интенсивности окружающего фона. Для выполнения этих операций было разработано несколько алгоритмов, основанных на Гауссовом приближении или определении лапласианов Гауссовых пятен. Пятна, морфология которых отклоняется от единой Гауссовой формы, могут быть интерпретированы с помощью модели перекрывающихся форм.
Более простой метод анализа полученного изображения - это линейный цепной анализ, в котором программа сканирует столбцы пикселей цифрового изображения и регистрирует пики плотности сигнала. Этот процесс повторяется для смежных столбцов пикселей, что позволяет алгоритмически определять как центры пятен, так и общую интенсивность сигнала каждого пятна.
Другой метод известен под названием "преобразование водораздела" (watershed transformation). В этом методе интенсивности пикселей представлены в виде топографической карты, так что по ней могут быть определены холмы и долины. Этот метод полезен для отделения групп, цепей и маленьких пятен, перекрывающихся с большими (боковых пятен, или лепестков), а также для слияния областей одного пятна.
На выходе программы, использующей любой из подобных методов, мы получаем список пятен.
Метод 2D-PAGE может быть применён также для анализа дифференциальной экспрессии белка. С его помощью можно определять белки, которые активируются или подавляются определённым курсом лечения или различными лекарствами, искать белки, связанные с теми или иными болезненными состояниями, или отслеживать изменения в экспрессии белка, происходящие в течение развития клетки или целого организма. После регистрации данные анализа экспрессии белка организуются в виде матрицы экспрессии данного белка. Результаты экспериментов 2D-PAGE хранятся в базах данных 2D-PAGE. Они могут быть найдены по адресу - WORLD-2DPAGE List Index to 2-D PAGE databases and services -http://world-2dpage.expasy.org/list/.