Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Трансгенные животные
Трансгенные мыши: применение
Трансгенные мыши могут служить модельными системами для изучения болезней человека и тест-системами для исследования возможности синтеза продуктов, представляющих интерес для медицины. Используя целых животных, можно моделировать и возникновение патологии, и ее развитие. Однако мышь — не человек, хотя она тоже относится к классу млекопитающих, поэтому данные, полученные на трансгенных моделях, не всегда можно экстраполировать на человека в том, что касается медицинских аспектов. Тем не менее в некоторых случаях они позволяют выявить ключевые моменты этиологии сложной болезни. Принимая во внимание все это, ученые разработали «мышиные» модели таких генетических болезней человека, как болезнь Альцгеймера, артрит, мышечная дистрофия, образование опухолей, гипертония, нейродегенеративные нарушения, дисфункция эндокринной системы, сердечно-сосудистые заболевания и многие другие.
Болезнь Альцгеймера — это дегенеративный процесс, приводящий к утрате клеток различных отделов головного мозга. Наиболее ранним проявлением служит ухудшение памяти. Этот процесс прогрессирует, к нему присоединяются утрата способности к абстрактному мышлению, изменение личности, нарушения речи, снижение физического статуса. Патология наблюдается у 1% людей возрастной группы от 60 до 65 лет и у 30% людей старше 80 лет. При патоморфологическом исследовании в теле нейронов обнаруживаются нейрофибриллярные клубочки, а у синаптических окончаний — плотные агрегаты. называемые сенильными бляшками (рис. 19.10). Кроме того, в кровеносных сосудах мозга обнаруживаются конгломераты — амилоидные бляшки. Основным компонентом сенильных и амилоидных бляшек является белок Aß (амилоид ß, ß-белок, ß-амилоидный белок, ß/A4) мол. массой 4 кДа. Существуют Aß-белки с разным числом аминокислотных остатков, например Aß40 и Aß42. Все они образуются в результате протеолитического расщепления белка-предшественника (АРР). Причины аккумуляции Aß-белка не установлены. Члены некоторых семей, в которых с высокой частотой встречается болезнь Альцгеймера, несут мутации в гене АРР, что наводит на мысль об участии этого гена в возникновении данной патологии. К сожалению, проследить в деталях за возникновением и развитием болезни Альцгеймера на человеке не удается. Неоценимую помощь в этом могла бы оказать какая-нибудь «животная» модель.

Рис. 19.10. Схематическое изображение нейрона коры головного мозга человека с указанием некоторых гистологических особенностей, характерных для болезни Альцгеймера. У синапсов образуются сенильные бляшки, содержащие амилоидные скопления и обломки клеток, В теле нейрона накапливаются нейрофибриллы, включающие агрегаты из белков цитоскелета и других белков. Происходят и другие изменения, здесь не показанные.
Было получено множество трансгенных мышей, несущих полноразмерный ген АРР или его часть под контролем нейроспецифичного промотора. При этом у большинства животных образование амилоидных бляшек, нейрофибриллярных клубочков, гибель нейронов или нарушение поведения не отмечались. Однако у животных, несущих трансген, кодирующий участок из 100 последних аминокислот АРР, который включал и Aß-белок, обнаруживалась дегенерация нервных тканей, аналогичная таковой при болезни Альцгеймера.
Более адекватные «животные» модели, позволяющие изучать болезнь Альцгеймера, были созданы с использованием трансгенов, содержащих мутации в гене АРР, характерные для некоторых семей с высокой частотой встречаемости болезни Альцгеймера в раннем возрасте (<50 лет). У одной группы таких семей в положении 717 АРР (АРР-717) вместо валина присутствовал фенилаланин, в другой группе в положениях 670 и 671 АРР (АРР-670/671) лизин и метионин были заменены на аспарагин и лейцин соответственно.
Трансген с мутацией АРР-717 был создан на основе кДНК АРР встраиванием между экзонами 6 и 7, 7 и 8,8 и 9 модифицированных нитронов. Интроны вводились потому, что, согласно данным эксперимента, содержащие их трансгены транскрибируются более эффективно, чем трансгены без нитронов. Конструкция «кДНК АРР—интроны» находилась под контролем промотора гена ß-фактора роста из тромбоцитов, экспрессирующегося в тканях мозга (рис. 19.11). Вся она была названа мини-геном PDAPP. У стареющих трансгенных мышей (старше 6 месяцев), несущих около 40 копий PDAPP, образовывались амилоидные бляшки, отмечались гибель нейронов и дефекты памяти. Конструкция АРР-670/671 под контролем нейроспецифичного промотора вызывала у трансгенных мышей симптомы, подобные симптомам болезни Альцгеймера, в том числе образование избыточных количеств Aß42. Интересно, что ни у стареющих мышей, несущих PDAPP-мини-ген, ни у трансгенных мышей АРР-670/671 нейрофибриллярные клубочки не обнаруживались. Возможно, эти структуры возникают у человека как следствие сверхпродукции Aß42. В развитии болезни Альцгеймера у человека участвуют еще три гена — АроЕ4, гены пресенилина 1 (PS1) и пресенилина 2 (PS2). Наличие аллеля АроЕ4 локуса АроЕ, который ответствен за транспорт липидов, коррелирует с увеличением вероятности возникновения болезни Альцгеймера у людей старше 60 лет. В семьях, где отмечается развитие этой болезни в молодом возрасте, обнаруживаются мутации в генах пресенилинов, однако роль каждого из них в развитии данной патологии не выяснена. По данным разных авторов, мутации в генах пресенилинов приводят к увеличению аккумуляции Aß42. Например, у дважды трансгенных мышей, полученных скрещиванием трансгенных мышей, которые несли полноразмерный человеческий ген АРР, с мышами, несущими мутантный ген пресенилина 1, отмечалась сверхпродукция Aß42. Пока о патогенезе болезни Альцгеймера мало что известно, но есть надежда, что животные модели помогут ответить на некоторые важные вопросы о ее молекулярных основах. В США эта болезнь поражает ежегодно около 4 млн. человек, и наносимый ею ущерб составляет порядка 100 млрд. долларов.
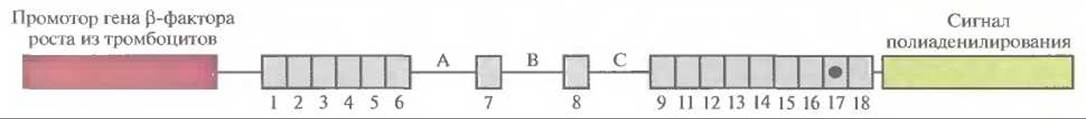
Рис. 19.11. Генетическая конструкция, называемая мини-геном PDAPP, с помощью которой можно моделировать развитие болезни Альцгеймера у трансгенных мышей. 1—10 — экзоны кДНК белка-предшественника амилоида, А—С — введенные интроны. Регуляторными элементами являются промотор гена ß-фактора роста из тромбоцитов и сигнал полиаденилирования вируса SV40.
Трансгенных мышей использовали также в качестве модельных систем для изучения экспрессии генов, кодирующих трансгенные продукты, которые секретируются в молоко. Так, для изучения функций белка, нарушения в котором приводят к муковисцидозу (CFTR), и для разработки подходов к лечению муковисцидоза (CF) необходимы большие количества аутентичного CFTR-белка.
Муковисцидоз — распространенная генетическая болезнь, поражающая в странах Европы одного из 2500 новорожденных. Первичный эффект дефектного CF-гена — это изменение функции CFTR, который в норме служит каналом для ионов хлора. В результате блокирования потока этих ионов в клетку и из клетки в протоках некоторых органов, особенно в легких и поджелудочной железе, скапливается слизь. Она становится источником бактериальной инфекции, которая с трудом поддается лечению антибиотиками. ДНК, высвобождающаяся из лизировавших бактерий, делает слизь очень густой. Загустевшая слизь забивает протоки, нарушается нормальная работа органа и симптомы муковисцидоза еще более усиливаются. Продолжительность жизни больных муковисцидозом составляет в настоящее время 25—30 лет.
Для того чтобы лучше изучить механизм действия CFTR, необходимо иметь этот белок в достаточном количестве. Все известные клеточные системы экспрессии in vitro не обеспечивали его эффективного синтеза. Возможно, это связано с аккумуляцией CFTR в мембранах трансфицированных клеток. Решить эту проблему можно было бы постоянным удалением плазматических мембран из хозяйских клеток. В такой системе гетерологичный трансмембранный белок связывался бы с отдельными фрагментами плазматической мембраны, что значительно облегчало бы его концентрирование и очистку. Аналогичный механизм используется клетками молочной железы для образования глобул жира в период вскармливания. Жировые капельки инкапсулируются в плазматической мембране и в таком виде секретируются в молоко.
Чтобы проверить действенность этой системы, полноразмерную кДНК CFTR встроили в середину дефектного гена ß-казеина козы, из которого был удален участок от конца экзона 2 до начала экзона 7 (рис. 19.12). Получившаяся конструкция содержала промотор и сигнал терминации транскрипции гена ß-казеина козы. При этом кДНК CFTR была встроена в структурный ген с интронами, благодаря которым повышалась эффективность транскрипции трансгена. Ген ß-казеина активно экспрессируется в клетках молочных желез в период вскармливания, и этот белок является основным белком молока.

Рис. 19.12. Генетическая конструкция «кДHK CFTG — ген ß-казеина козы». Полноразмерная кДНК CFTR встроена между экзонами 2 (ЕХ2) и 7 (ЕХ7) гена ß-казеина козы. Сохранены промотор, терминатор и экзоны 1, 8 и 9 (ЕХ1, EX8 и ЕХ9) гена казеина.
Были получены линии трансгенных мышей, несущих кДНК CFTR под контролем регуляторных последовательностей гена ß-казеина. Как и ожидалось, в молоке трансгенных самок содержался CFTR-белок, связанный с мембранами глобул жира. Никаких отрицательных побочных эффектов у кормящих CFTR-трансгенных самок или у мышат, вскормленных их молоком, не наблюдалось. CFTR был гликолизирован и легко экстрагировался из жировой фракции молока. Остается только выяснить, является ли он аутентичным белком. Исследовалась также возможность получения других мембраносвязанных белков с молоком. В клетках молочных желез трансгенных мышей в период лактации синтезируется множество белков, представляющих интерес для медицины. Но чтобы иметь возможность получать CFTR, другие трансмембранные белки и различные белки человека в больших количествах, соответствующие трансгенные конструкции необходимо встраивать в геном более крупных млекопитающих — коровы, овцы или козы.