Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Основы молекулярной биотехнологии
Химический синтез, определение нуклеотидной последовательности и амплификация ДНК
Методы секвенирования ДНК
Исчерпывающую информацию о молекуле ДНК можно получить, только определив ее нуклеотидную последовательность. Так, секвенировав ген, часто удается установить его функцию, сравнив его нуклеотидную последовательность с таковыми для генов, функция которых уже известна. Без данных о нуклеотидной последовательности невозможно проводить исследования по молекулярному клонированию. Секвенирование того или иного фрагмента ДНК можно провести либо химическим методом, разработанным А. Максамом и В. Гилбертом, либо ферментативным, предложенным Ф. Сангером, но в настоящее время наиболее широко используется так называемый дидезоксинуклеотидный метод.

Дидезоксинуклеотидный метод секвенирования ДНК
Дидезоксинуклеотид — это полученный искусственным путем нуклеотид, лишенный 2'- и 3'- гидроксильных групп при углеродных атомах сахарного кольца (рис. 5.11, А). У дезоксинуклеотида, входящего в норме в состав ДНК, отсутствует только 2'-гидроксильная группа (рис. 5.11, Б). Удлинение цепи во время репликации ДНК происходит в результате присоединения очередного нуклеозидтрифосфата к 3'-гидроксильной группе последнего нуклеотида растущей цепи (рис. 5.12). И если таким очередным присоединяемым звеном является дидезоксинуклеотид, то синтез ДНК останавливается, поскольку следующий нуклеотид не может образовать фосфодиэфирную связь (рис. 5.13). Остановка синтеза ДНК — это ключевой этап дидезокси-метода, но чтобы осуществить секвенирование в полном объеме, необходимо выполнить целый ряд условий.
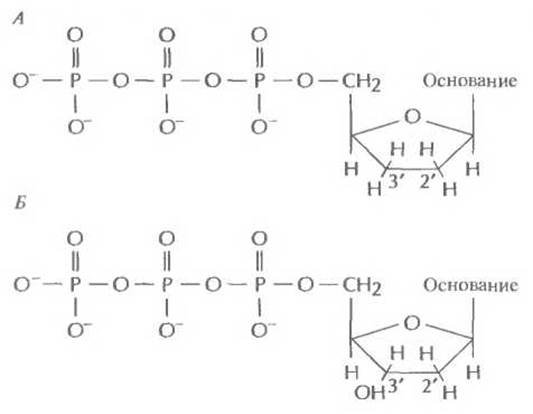
Рис. 5.11. А. Дидезоксинуклеотид (отсутствуют 2’ - и 3'-гидроксильные группы в кольце). Б. Дезоксинуклеотид (отсутствует только 2’ -гидроксильная группа).
Первый шаг стандартной процедуры дидезокси-секвенирования состоит в гибридизации синтетического олигонуклеотида длиной 17—20 звеньев со специфическим участком одной из цепей клонирующего вектора, соседствующим со вставкой. Этот олигонуклеотид является праймером, поставляющим 3'-гидроксильную группу для инициации синтеза. Раствор с праймером распределяют по четырем пробиркам, в каждой из которых находятся четыре дезоксинуклеотида, dATP, dCTP, dGTP и dTTP (один из них — изотопно меченный), и один из четырех дидезоксинуклеотидов (ddATP, ddCTP, ddGTP или ddTTP). Концентрацию каждого дидезоксинуклеотида подбирают таким образом, чтобы он оказался включенным по всем позициям в смеси растущих цепей, а не только в первой встретившейся ему позиции. (Напомним, что после присоединения дидезоксинуклеотида рост цепи сразу останавливается, поэтому каждая цепь оканчивается 3'-дидезоксинуклеотидом.) Но окончании ферментативного синтеза при участии ДНК-полимеразы в каждой пробирке оказывается уникальный набор олигонуклеотидов, каждый из которых содержит праймерную последовательность (рис. 5.14).

Рис. 5.12. Синтез ДНК в обычных условиях. Очередной дезоксирибонуклеотид (дезоксирибонуклеозидтрифосфат; dNTP) спаривается с комплементарным нуклеотидом матричной цепи. Между 3'-гидроксильной группой последнего нуклеотида в растущей цепи и а-фосфатной группой присоединяемого нуклеотида образуется фосфодиэфирная связь.
Далее в пробирки добавляют формамид, чтобы обеспечить расхождение цепей, и проводят электрофорез в полиакриламидном геле на четырех дорожках (по числу пробирок). Это позволяет разделить одноцепочечные фрагменты ДНК, даже если они различаются по длине всего на один нуклеотид. На радиоавтографе обнаруживается набор полос, отвечающих меченым фрагментам ДНК, сопоставление которых позволяет прямо «прочитать» нуклеотидную последовательность секвенируемого сегмента ДНК. В примере, приведенном на рис. 5.15, первые шесть нуклеотидов этого сегмента, начиная с 5'- конца, — это AGCTGC. Самая «быстрая» полоса (радиоактивно меченный фрагмент в самом низу геля) соответствует самому короткому фрагменту и находится в дорожке ddATP; следующие полосы располагаются соответственно в дорожках ddGTP, ddCTP, ddTTP и т. д. На большинстве радиоавтографов четко различаются от 250 до 350 полос. Праймерная последовательность находится на фиксированном расстоянии (10—20 нуклеотидов) от того сайта, по которому встроена клонированная ДНК, что позволяет легко распознать начало клонированного фрагмента.

Рис. 5.13. Остановка синтеза ДНК после присоединения дидезоксинуклеотида к концу растущей цепи. Фосфодиэфирная связь между концевым дидезоксинуклеотидом и следующим нуклеотидом не может образоваться из-за отсутствия 3'-гидроксильной группы.
Секвенирование ДНК с помощью вектора на основе фага М13
Для определения нуклеотидной последовательности клонированных ДНК используются разные подходы. Один из первых основывался на применении фага М13 Е. coli в качестве вектора. ДНК этого фага представляет собой одноцепочечную кольцевую молекулу. Когда им инфицируют Е. coli, сначала образуется двухцепочечная репликативная форма фаговой ДНК, а одноцепочечные кольцевые молекулы, которые затем упаковываются в вирионы, синтезируются на этой двухцепочечной молекуле как на матрице. Клетки, инфицированные М13, не подвергаются лизису; в них непрерывно образуются новые одноцепочечные молекулы ДНК М13, которые, проходя через клеточную мембрану, одеваются белковой оболочкой и выходят в окружающую среду. ДНК М13 содержит несущественную часть, которую можно заменить нужным фрагментом ДНК; при этом инфекционность рекомбинантных вирусных частиц сохранится. М13 - система имеет следующие преимущества: выделенная двухцепочечная репликативная форма может функционировать как плазмида, а одноцепочечная фаговая ДНК — использоваться в качестве матрицы для секвенирования ДНК.
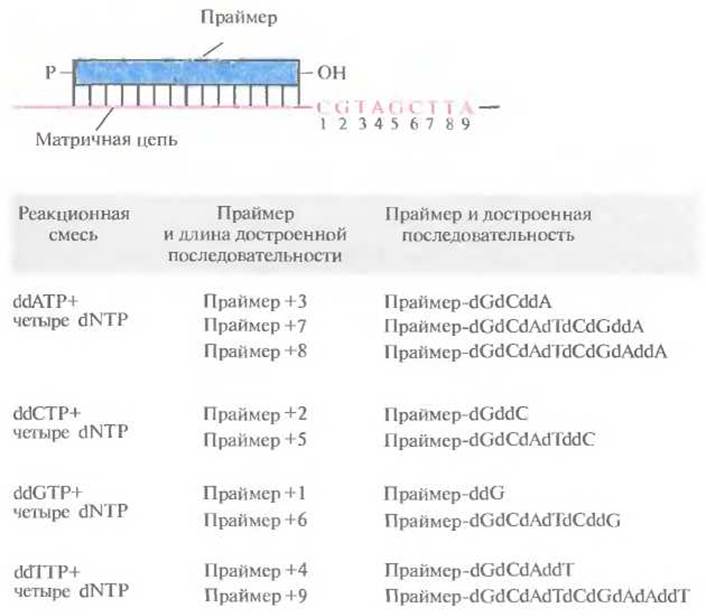
Рис. 5.14. Удлинение праймера при синтезе цепи в присутствии дидезоксинуклеотидов. В каждой из четырех пробирок образуется уникальный набор олигонуклеотидов разной длины, включающих праймерную последовательность. При этом образуется и какое-то число полноразмерных молекул ДНК. dNTP — дезоксинуклеозидтрифосфат
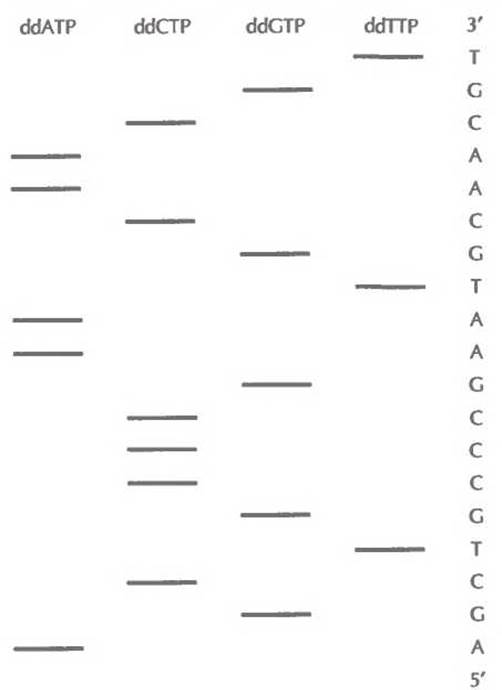
Рис. 5.15. Схематическое изображение радиоавтографа, получающегося при секвенировании ДНК с помощью дидезокси-метода. В каждую из лунок вносили содержимое одной из четырех пробирок, в которых находился один из дидезоксинуклеотидов: ddATP, ddCTP, ddGTP или ddTTP. Нуклеотидная последовательность считывается с радиоавтографа снизу вверх. На рисунке она приведена справа.
Все это позволяет использовать фаг М13 как комбинированную систему для клонирования и секвенирования ДНК. Обычно нужный фрагмент ДНК длиной примерно 500 п. н. встраивают в полилинкер, который является частью клонированного в РФ-ДНК фага М13 модифицированного гена lacZ'. Рекомбинантной вирусной ДНК трансформируют компетентные клетки Е. coli и высевают их на чашки со средой, содержащей субстрат X-Gal. При его гидролизе ß-гaлактозидазой образуется продукт, имеющий синюю окраску. На чашках появляются белые (бесцветные) и синие колонии. Первые отвечают клеткам, инфицированным фагом М13 со вставкой, нарушившей рамку считывания гена lacZ', вторые — клеткам, инфицированным фагом М13 с функциональным геном lacZ', не несущим вставки. Из белых колоний выделяют фаговые частицы, а из них — одноцепочечную ДНК со вставкой (рис. 5.16). Для секвенирования последней отжигают выделенную ДНК с праймером, который гибридизуется с последовательностью вблизи вставки, затем проводят дидезоксисеквенирование, электрофорез и радиоавтографию и «прочитывают» нуклеотидную последовательность вставки. Для секвенирования крупных фрагментов ДНК (примерно 2000 п. н.) используют другие стратегии. Одна из них состоит в следующем. Встраивают этот фрагмент в соответствующий плазмидный вектор и строят его подробную рестрикционную карту. Идентифицируют перекрывающиеся фрагменты вставки длиной от 100 до 500 п. н., субклонируют каждый из них в ДНК М13, секвенируют и воссоздают нуклеотидную последовательность всего исходного фрагмента. Чтобы быть уверенным в правильности полученного результата и идентификации какого-либо нуклеотида, необходимо секвенировать обе цепи по нескольку раз. Секвенирование обеих цепей облегчается тем, что каждый из субклонированных фрагментов исходной ДНК может быть встроен в ДНК М13 в противоположных ориентациях. В результате в одном случае праймер будет иницировать синтез первой цепи, а в другом — второй.
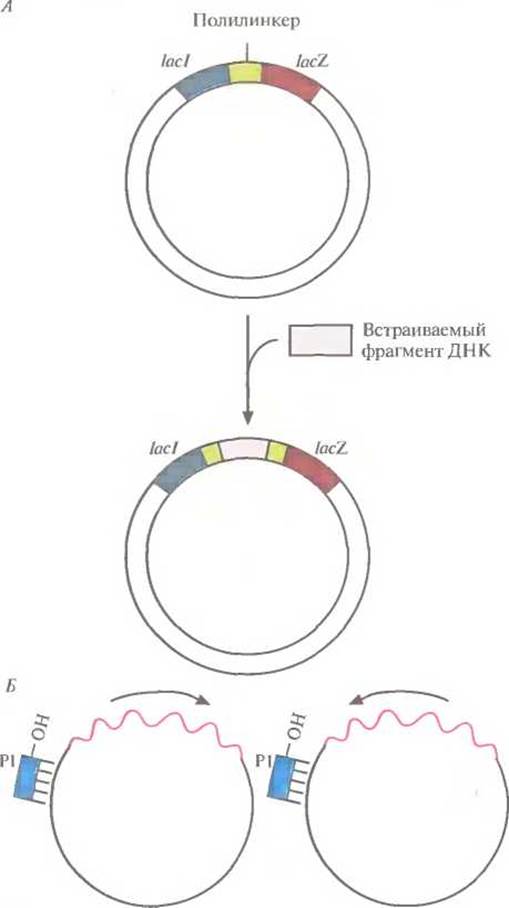
Рис. 5.16. Использование бактериофага М13 для клонирования и секвенирования. А. Встраивание фрагмента ДНК в двухцепочечную репликативную форму ДНК М13. Б. Секвенирование комплементарных цепей клонированного фрагмента ДНК с помощью одного и того же праймера (Р1). Стрелками показана ориентация вставки в векторе.
Праймер-опосредованная прогулка («Блуждающая затравка») Для секвенирования очень длинных фрагментов ДНК (>5000 и. н.) описанный выше подход уже не может быть использован, поскольку число M13-векторов, содержащих перекрывающиеся субклонированные последовательности, значительно увеличивается. Чтобы решить эту задачу, были разработаны методы секвенирования двухцепочечных плазмидных ДНК, не требующие субклонирования. Плазмидную ДНК, содержащую нужную вставку, выделяют и отжигают с синтетическим олигонуклеотидным праймером, который гибридизуется с последовательностью в одной из цепей векторной ДНК, находящейся вблизи вставки. Затем осуществляют дидезокси-секвенирование, позволяющее идентифицировать первые 250—350 нуклеотидов вставки. Исходя из этих данных синтезируют второй олигонуклеотидный праймер, комплементарный сегменту вставки, отстоящему примерно на 300 нуклеотидов от места связывания первого праймера, и секвенируют следующие 250—350 нуклеотидов. Аналогичным образом синтезируют третий праймер и определяют нуклеотидную последовательность следующих 250—350 нуклеотидов (рис. 5.17). Эту процедуру, называемую праймер-опосредованной прогулкой, продолжают до тех пор, пока не секвенируют весь фрагмент. Аналогичным образом секвенируют вторую цепь, начиная с праймера, который гибридизуется с этой цепью вблизи вставки.
К сожалению, в результате ошибочного спаривания праймера заданной длины с более чем одним участком внутри вставки могут быть получены неоднозначные результаты. Чтобы избежать этого, используют праймеры длиной не менее 24 нуклеотидов и стараются строго соблюдать условия отжига. Именно таким образом были секвенированы фрагменты ДНК, клонированные в бактериофагеλ (~20 т. п. н.) или в космидном векторе (~40 т. п. н.).
Некоторые этапы этого процесса недавно были автоматизированы. Это позволило проводить рутинное секвенирование фрагментов длиной несколько десятков тысяч пар нуклеотидов. Во многих случаях праймеры, добавляемые в реакционную смесь в разных пробирках, метят различными флуоресцентными красителями с разной длиной волны флуоресценции. Затем содержимое всех четырех пробирок соединяют и проводят электрофорез на одной дорожке. Дорожку сканируют в луче лазера и регистрируют положение каждой флуоресцирующей полосы. Все данные вводят в компьютер, который сопоставляет их и выводит на дисплей нуклеотидную последовательность.
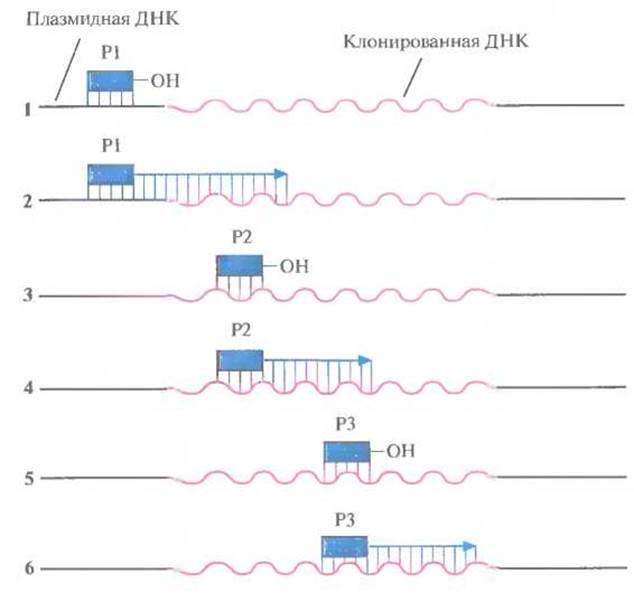
Рис. 5.17. Секвенирование ДНК методом праймер-опосредованной прогулки. 1. Инициация синтеза цепи ДНК с помощью праймера (Р1), комплементарного участку плазмиды, находящемуся вблизи вставки. 2. Секвенирование фрагмента клонирован ной ДНК длиной 250—350 нуклеотидов. 3. Подбор второго праймера, комплементарного концевому участку уже секвенированной последовательности длиной примерно 20 нуклеотидов. 4. Секвенирование следующего сегмента клонированной ДНК с помощью второго праймера (Р2). 5. Подбор третьего праймера, комплементарного концевому участку этого сегмента размером 20 нуклеотидов. 6. Третий праймер (Р3) используется для секвенирования следующего сегмента клонированной ДНК. Эту процедуру продолжают до тех пор, пока не будет секвенирована вся вставка.