Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Основы молекулярной биотехнологии
Химический синтез, определение нуклеотидной последовательности и амплификация ДНК
Полимеразная цепная реакция
Полимеразная цепная реакция (ПЦР) — это эффективный способ получения in vitro большого числа копий специфических нуклеотидных последовательностей. Их амплификация — иногда в миллионы раз — осуществляется в ходе трехэтапного циклического процесса. Для ПЦР необходимы: I) два синтетических олигонуклеотидных праймера (длиной примерно по 20 нуклеотидов), комплементарные участкам ДНК из противоположных цепей, фланкирующим последовательность-мишень; их 3'-гидроксильные концы после отжига с ДНК должны быть ориентированы навстречу друг другу; 2) ДНК-мишень длиной от 100 до ~35 000 п. н.; 3) термостабильная ДНК-полимераза, которая не теряет своей активности при температуре 95° и выше; 4) четыре дезоксирибонуклеотида.
Типичная ПЦР-амплификация состоит в многократном повторении следующих трех реакций.
1. Денатурация. Первый этап ПЦР состоит в тепловой денатурации образца ДНК выдерживанием его при температуре 95 °С в течение по крайней мере 1 мин. Помимо ДНК, в реакционной смеси содержатся в избытке два праймера, термостабильная ДНК-полимераза Taq, выделенная из бактерий Thermus aquaticus, и четыре дезоксирибонуклеотида.
2. Ренатурация. Температуру смеси медленно понижают до ~55 °С, при этом праймеры спариваются с комплементарными последовательностями ДНК.
3. Синтез. Температуру повышают до ~75 °С — величины, оптимальной для ДНК-полимеразы Taq. Начинается синтез комплементарной цепи ДНК, инициируемый 3’-гидроксильной группой праймера (рис. 5.18).
Все реакции проводят в пробирках, погруженных в термостат. Смена температурного режима и его поддержание осуществляются автоматически. Каждый цикл обычно длится 3—5 мин. Чтобы понять, как именно происходит амплификация определенного сегмента ДНК в ходе ПЦР, нужно четко представлять положение всех праймеров и комплементарных им последовательностей в амплифицируемых цепях в каждом раунде. В первом раунде каждая из новосинтезированных цепей имеет гораздо большую длину, чем расстояние от 3'-гидроксильной группы «ее» праймера до концевого нуклеотида последовательности, комплементарной второму праймеру. Такие цепи называют «длинными матрицами», именно на них будет идти дальнейший синтез (рис. 5.18).

Рис. 5.18. Первый раунд ПЦР. ДНК-мишень фланкирована последовательностями 1'—2 в одной цепи и последовательностями 1—2' — в другой. К образцу ДНК добавляют праймеры (Р1 и Р2), ДНК-полимеразу Tag и четыре дезоксирибонуклеозидтрифосфата (dNTP). Смесь нагревают до 95 °С, инкубируют в течение 1 мини медленно охлаждают до 55 °С. При этой температуре праймеры, добавленные в избытке, спариваются с разделенными цепями. Повышают температуру до 75 °С. В этих условиях происходит синтез обеих цепей ДНК, начинающийся с 3'-гидроксильных концов праймеров. Каждая из синтезированных цепей имеет гораздо большую длину, чем расстояние от 3'-гидроксильной группы «ее» праймера до концевого нуклеотида последовательности, комплементарной второму праймеру. Эти цепи служат матрицами во втором раунде ПЦР.
Во втором раунде двухцепочечную ДНК, состоящую из исходной и новосинтезированной («длинная матрица») цепей, опять подвергают денатурации, а затем отжигают с праймерами. Во время синтеза в этом раунде вновь синтезируются «длинные матрицы», а также некоторое количество цепей с праймером на одном конце и с последовательностью, комплементарной второму праймеру, на другом («короткие матрицы») (рис. 5.19). Во время третьего раунда все гетеродуплексы, образовавшиеся ранее, одновременно подвергаются денатурации и отжигу с праймерами, а затем реплицируются (рис. 5.20). В последующих раундах «коротких матриц» становится все больше, и к 30-му раунду их число уже в 106 раз превышает число исходных цепей или «длинных» матриц (рис. 5.21).
Метод ПЦР получил широкое распространение. Разнообразные случаи его применения мы рассмотрим в последующих главах. Здесь упомянем лишь некоторые из них. Один из важнейших — идентификация патогенных микроорганизмов, возбудителей заболеваний человека, животных и растений. С появлением ПЦР отпала необходимость в выделении и очистке ДНК-мишени; для анализа можно использовать очень небольшое количество неочищенного материала. Для синтеза праймеров, специфичных в отношении исключительно ДНК-мишени, нужно знать нуклеотидную последовательность ДНК предполагаемого патогенного микроорганизма. В этом случае в ходе ПЦР будет амплицицироваться только фрагмент ДНК, длина которого равна суммарной длине двух праймеров и фрагмента ДНК между ними.
ПЦР — высокочувствительный метод, поэтому при наличии в исследуемом образце даже ничтожного количества ДНК, случайно попавшей из одной реакционной смеси в другую, могут быть получены ложноположительные результаты. Это заставляет тщательно контролировать все используемые для ПЦР растворы и посуду.
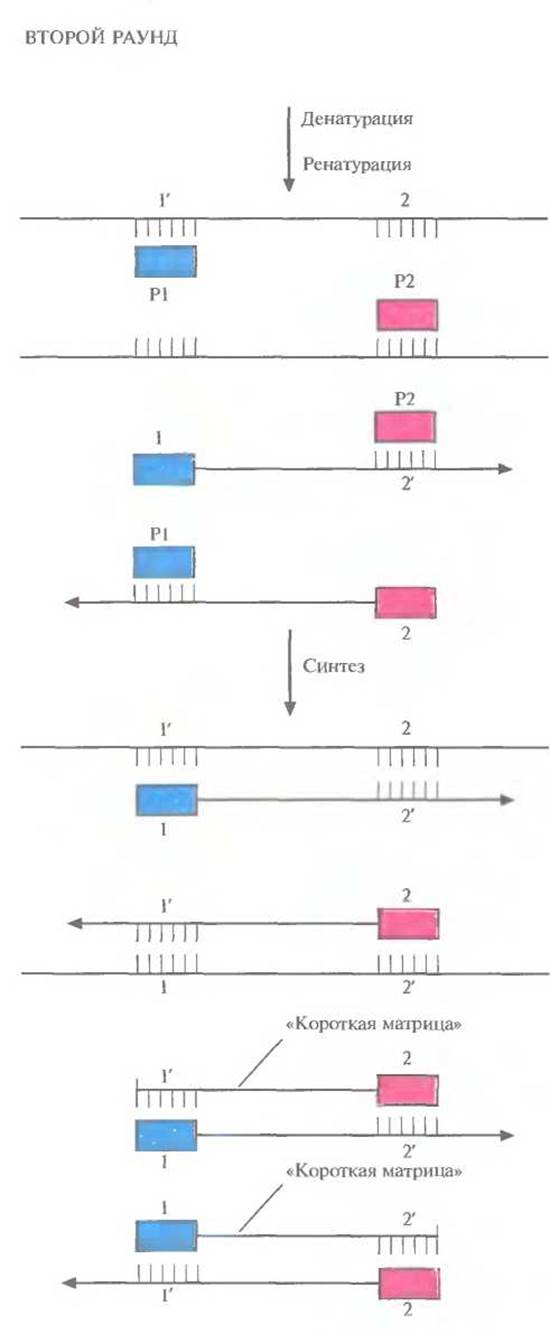
Рис. 5.19. Второй раунд ПЦР. Исходным материалом в этом случае является смесь молекул ДНК, образовавшихся в первом раунде (рис. 5.18). При отжиге праймеры гибридизуются с комплементарными им участками как исходных цепей, так и «длинных матриц», синтезированных в первом раунде. В результате ферментативного синтеза in vitro на исходных цепях синтезируются «длинные матрицы», а на «длинных матрицах» — «короткие». Последние начинаются с одного праймера, а заканчиваются последовательностью, комплементарной второму праймеру.
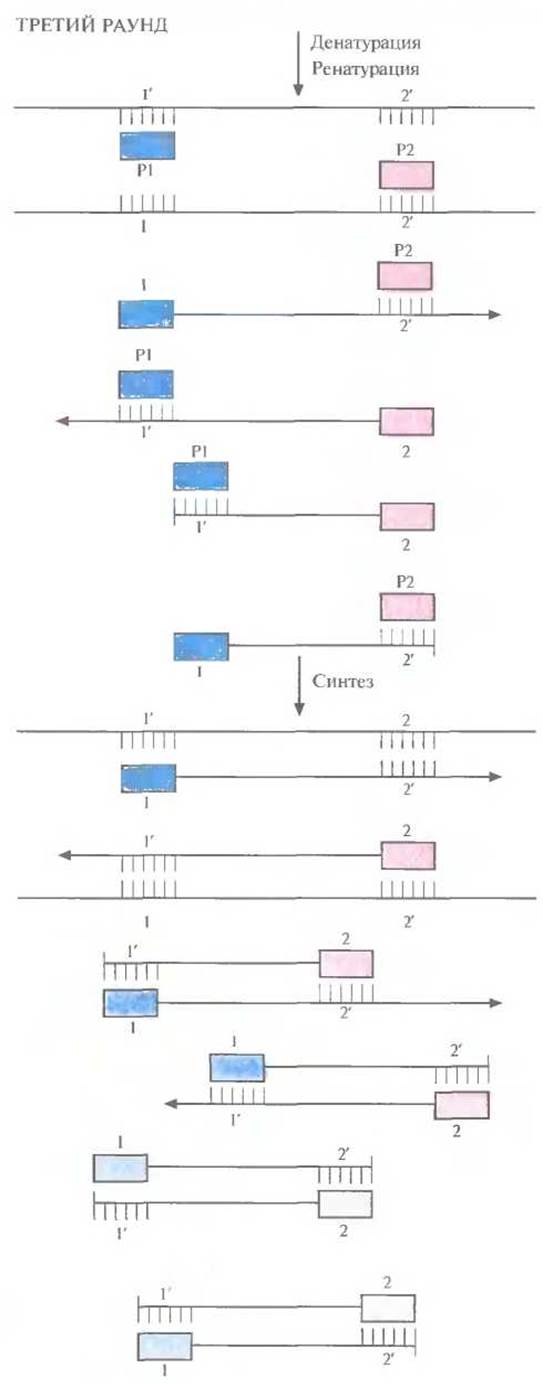
Рис. 5.20. Третий раунд ПЦР. При отжиге праймеры гибридизуются с комплементарными участками исходных цепей, а также «длинных» и «коротких» матриц. При ферментативном синтезе in vitro на исходных цепях синтезируются «длинные» матрицы», а на «длинных» и «коротких» матрицах — только «короткие матрицы».
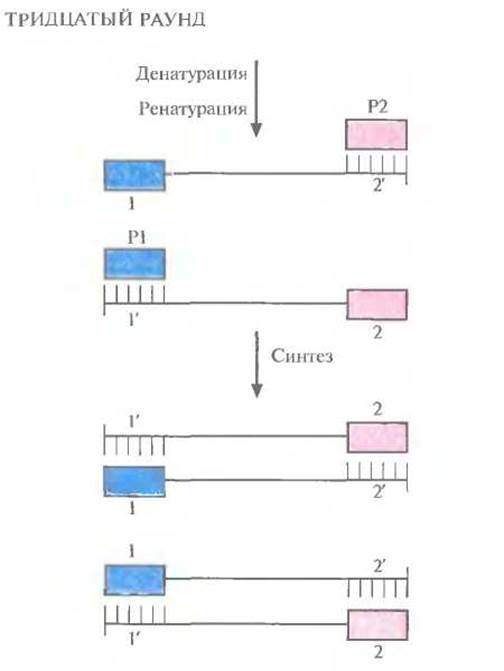
Рис. 5.21. Тридцатый раунд ПЦР. На этом этапе в реакционной смеси содержатся практически одни «короткие матрицы».
Метод ПЦР применяется также для выявления спонтанных мутаций, внесения специфических мутаций in vitro, сборки полноразмерных генов из синтетических олигонуклеотидов, секвенирования ДНК. Во многих случаях возникает необходимость в клонировании ПЦР-продукта. Однако прямое клонирование с помощью лигирования по тупым концам затруднено, поскольку полимераза Taq присоединяет к 3'-концу синтезируемой цепи лишний адениннуклеотид, что снижает эффективность лигирования. Но если вектор для клонирования обработать рестрицирующей нуклеазой с образованием новых тупых концов и затем проинкубировать с полимеразой Taq в присутствии dTTP, то к обоим 3'-концам фрагментов добавится по одному тимидиннуклеотиду. Взаимной комплементарности концевых участков вектора и ПЦР-продукта протяженностью в один-единственный нуклеотид оказывается достаточно для спаривания молекул и их последующего лигирования.
Получение с помощью ПЦР кДНК, отвечающих концам молекул мРНК
С помощью ПЦР можно получать комплементарные ДНК (кДНК), отвечающие 3'- или 5'- концевым участкам специфических информационных РНК (мРНК). Для обозначения этого метода используется сокращение RACE — от англ. rapid amplification of сDNA ends (быстрая
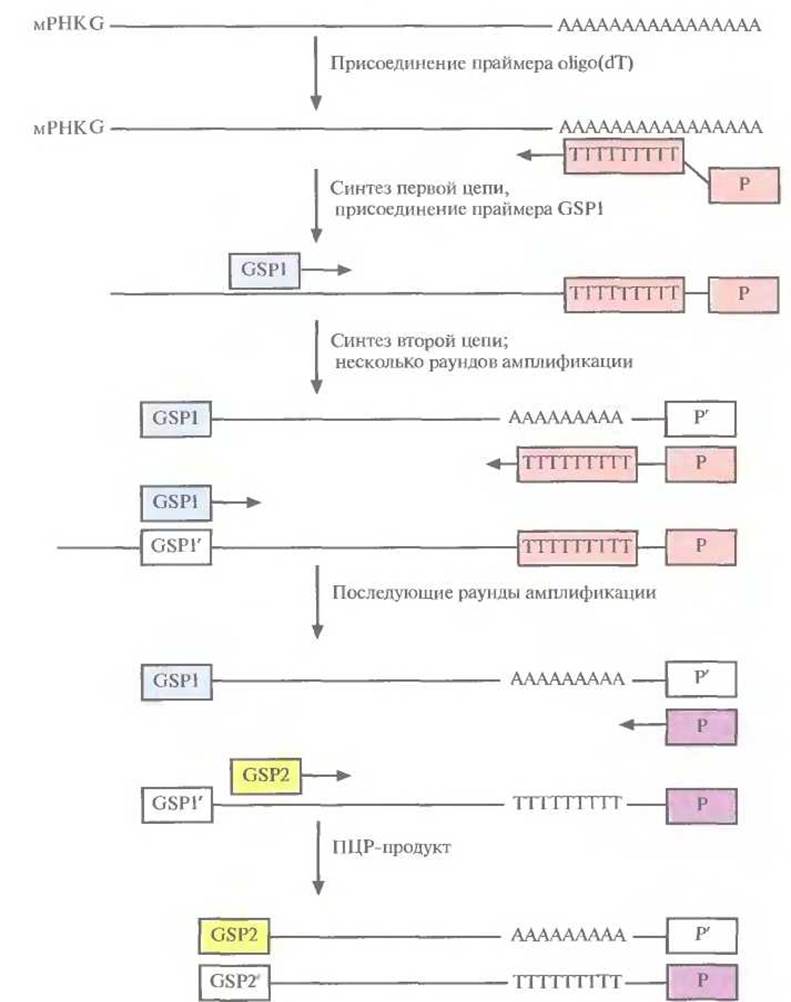
Рис. 5.22. ПЦР-амплификация кДНК, комплементарной 3'-концевой части мРНК. Первая цепь кДНК образуется в результате обратной транскрипции мРНК при участии oiigo(dT) в качестве праймера. Вторая цепь синтезируется на первой цепи как на матрице с помощью полимеразы Taq и генспецифичного праймера (GSP1). В последующих раундах ПЦР используются праймеры GSP2 и Р.
амплификация концов кДНК). Обозначения 3' RACE и 5' RACE относятся к амплификации кДНК, отвечающих соответствующим концам мРНК. В обоих случаях для проведения ПЦР- амплификации нужно знать нуклеотидную последовательность кодирующей области мРHК-мишени, чтобы синтезировать генспецифичный праймер (GSP). В случае 3' RACE праймером для синтеза первой цепи кДНК служит oligo(dT) с присоединенным к нему вторым праймером (Р) (рис. 5.22). Oligo(dT) спаривается с poly(A)- хвостом мРНК, и обратная транскриптаза синтезирует цепь, комплементарную мРНК. Вторая цепь кДНК синтезируется на первой при участии GSP, комплементарного кодирующей области данной мРНК, с помощью полимеразы Taq. По завершении нескольких раундов ПЦР, в которых использовались указанные выше праймеры, добавляют вторую пару праймеров, которые связываются по соседству с двумя первыми. Такие тесно расположенные праймеры называются внутренними. Вторая пара праймеров необходима, поскольку без них нельзя амплифицировать полноразмерную молекулу-мишень. Конечным ПЦР-продуктом является кДНК, соответствующая 3'-концу искомой мРНК.

Рис. 5.23. ПЦР-амплификация кДНК, комплементарной 5'-концевой части мРНК первой цепи, осуществляемая обратной транскриптазой, инициируется праймером GSP. Затем к этой цепи с помощью концевой дезоксинуклеотидилтрансферазы присоединяется роlу(А)-хвост. Для синтеза второй цепи в качестве праймера используется oligo(dT). Проводят несколько раундов амплификации при участии указанных праймеров, добавляют вторые праймеры (GSP2 и Р) и получают кДНК, отвечающую 5'-концу мРНК.
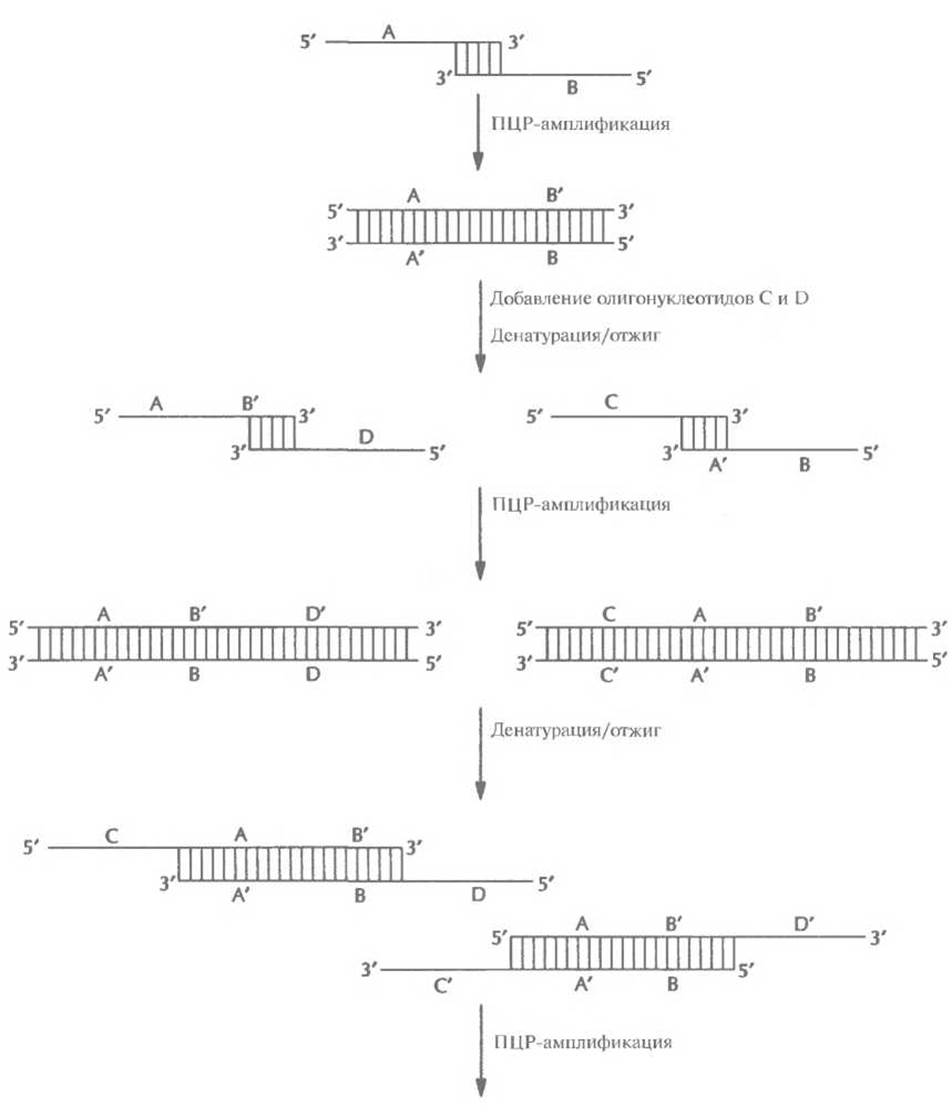
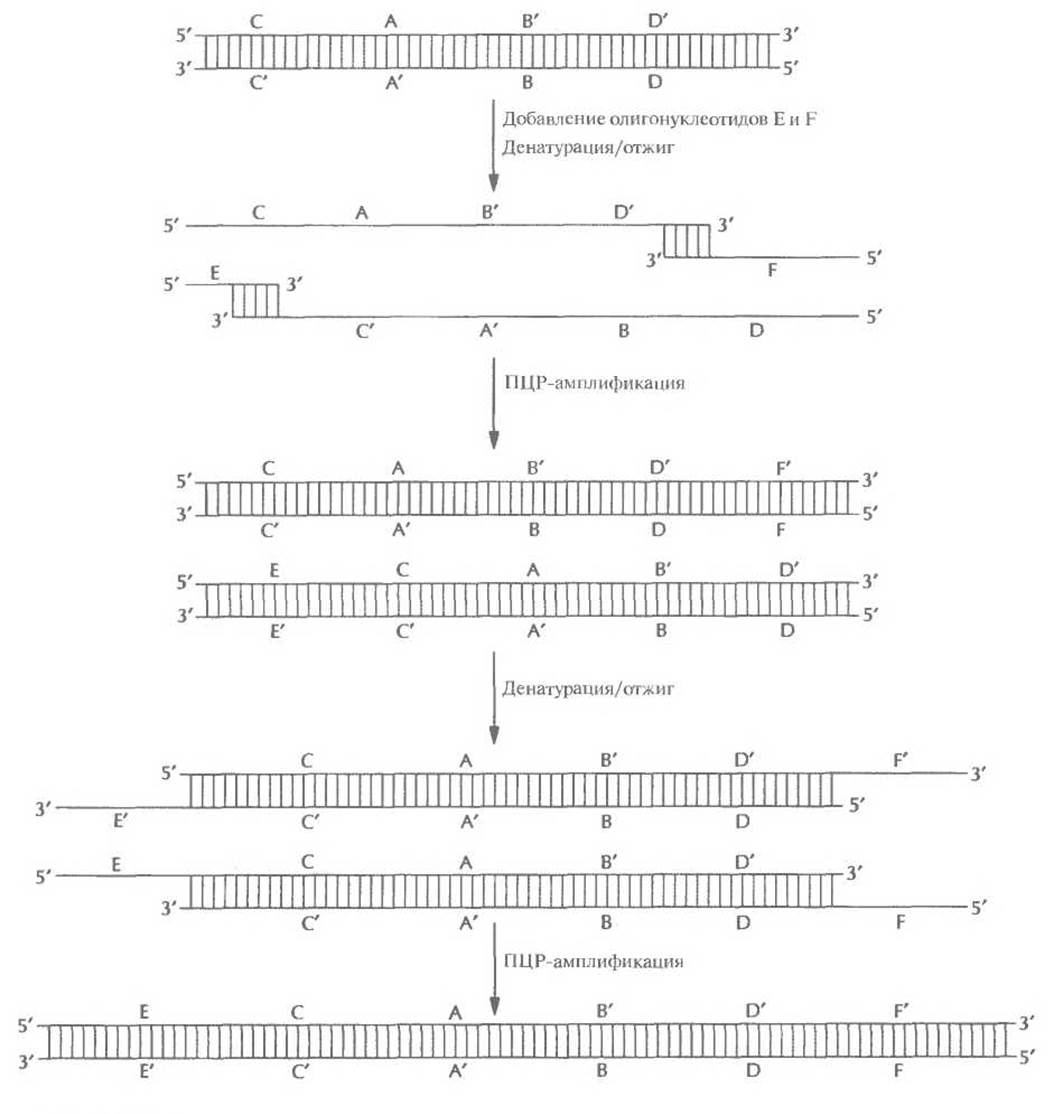
Рис. 5.24. Синтез генов с помощью ПЦР. Перекрывающиеся олигонуклеотиды (А и В) отжигают и достраивают образовавшийся дуплекс с заглубленными 3-гидроксильными концами. Двухцепочечные молекулы денатурируют. добавляют в реакционную смесь вторую пару олигонуклеотидов (С и D), перекрывающихся с продуктами первого раунда ПЦР, и отжигают. Осуществляют второй раунд ПЦР, добавляют следующую пару олигонуклеотидов (Е и F), осуществляют третий раунд ПЦР и т. д. В результате образуется двухцепочечная ДНК, идентичная искомому гену. Одинаковыми буквами со штрихом или без (А' и А, Ви В' и т. д.) обозначены комплементарные участки ДНК. Нуклеотидная последовательность каждого олигонуклеотида соответствует таковой определенных сегментов ДНК.
В случае 5'RACE праймером для синтеза первой цепи кДНК служит GSP (рис. 5.23). Новосинтезированную цепь обрабатывают концевой дезоксинуклеотидилтрансферазой в присутствии dATP. Этот фермент случайным образом присоединяет дезосирибонуклеотиды к 3'-концу цепи. Поскольку в данном случае в реакционной смеси присутствует только dATP, на этом конце появляется цепочка адениновых остатков — роlу(А)-хвост. С ним спаривается праймер P-oligo(dT), инициирующий синтез второй цепи. Проводят ограниченное число раундов ПЦР с указанными праймерами, а затем добавляют вторые праймеры и амплифицируют кДНК, отвечающую 5'-концу мРНК.
RACE-метод широко применяется по ряду причин. Обычно бывает очень трудно обнаружить кДНК, соответствующую мРНК, которая присутствует в данной ткани в маленькой концентрации. С помощью RACE-метода можно быстро получить кДНК, отвечающие концевым участкам этой мРНК, и при необходимости использовать их в качестве зондов для скрининга кДНК- и геномных библиотек. Кроме того, поскольку неполноразмерные 3'-концевые фрагменты кДНК значительно преобладают над полноразмерными, 5'RACE может восполнить недостающие 5'-концевые сегменты.
Синтез генов с помощью ПЦР
Получение генов с помощью ПЦР — гораздо более быстрый и экономичный метод, чем тот, который основан на отжиге олигонуклеотидов с перекрывающимися концами, заполнении брешей с помощью ДНК-полимеразы и сшивании разрывов ДНК-лигазой. В одной из методик конструирование гена начинается с отжига двух перекрывающихся олигонуклеотидов (А и В), отвечающих центральной части гена (рис. 5.24). После отжига образуется дуплекс с заглубленными 3'-гидроксильными группами, служащими точками инициации синтеза комплементарных цепей при ПЦР. Затем в реакционную смесь добавляют еще два олигонуклеотида, С и D. 3'-конец олигонуклеотида С идентичен 5'- концу олигонуклеотида А, а сам этот олигонуклеотид отвечает участку конструируемого гена, непосредственно примыкающему к его центральной части слева. Аналогично, 3'-конец олигонуклеотида D идентичен 5'-концу олигонуклеотида В и отвечает участку гена, примыкающему к его центральной части справа. После денатурации смеси и отжига образуются дуплексы с протяженными выступающими одноцепочечными сегментами, достраивающимися с 3'-концов В ходе последующих раундов ПЦР образуется двухцепочечный продукт, состоящий из указанных выше сегментов, расположенных в порядке CABD. Молекула ДНК с заглубленными 5'-концами не достраивается.
На следующем этапе в реакционную смесь добавляют еще два олигонуклеотида, Е и F. 3'- конец олигонуклеотида Е идентичен 5'-концу олигонуклеотида С, а сам он отвечает участку реконструируемого гена, примыкающему слева к сегменту С. Аналогичными свойствами обладает олигонуклеотид F, если его соотносить с олигонуклеотидом D. После денатурации и ренатурации смеси образовавшиеся дуплексы с выступающими одноцепочечными участками достраиваются с 3'-гидроксильных концов. В ходе последующих раундов ПЦР образуется двухцепочечный продукт ECABDF.
Следующие пары олигонуклеотидов — один «достраивающий» ген слева, другой справа - последовательно добавляют в смесь до тех пор, пока не будет синтезирован весь ген. Длина этих олигонуклеотидов обычно бывает равна 50 звеньям. Каждый «блок» ПЦР состоит из двадцати 4-минутных раундов. Для синтеза гена длиной 1000 п. н. нужно 10 «блоков», так что ген можно получить в течение одного дня. При этом, как и в случае синтеза генов другими методами, последнюю пару нуклеотидов (т. е. 5'- и 3'-концы) можно снабдить дополнительными последовательностями, фланкирующими кодирующий участок и облегчающими последующее встраивание гена в вектор.