Молекулярная биотехнология. Принципы и применение - Глик Б., Пастернак Дж. 2002
Молекулярная биотехнология микробиологических систем
Микробиологическое производство лекарственных средств
Производство антител с помощью Е. coli
Гибридомы, подобно большинству других клеточных культур животных, растут относительно медленно, не достигают высокой плотности и требуют сложных и дорогих сред. Получаемые таким образом моноклональные антитела очень дороги, что не позволяет широко использовать их в клинике. Чтобы решить эту проблему, были предприняты попытки создания своего рода «биореакторов» на основе генетически модифицированных бактерий, растений и животных. Для эффективной доставки и функционирования некоторых иммунотерапевтических средств зачастую достаточно одной антигенсвязывающей области антитела (Fab- или Fv-фрагмента), т. е. присутствие Fc-фрагмента антитела необязательно.
Нарис. 10.12 представлена методика получения функциональных антител с помощью Е. coli (рис. 10.12).
1. Используя мРНК, выделенную из вырабатывающих антитела клеток (В-лимфоцитов) мыши или человека, синтезируют кДНК.
2. Проводят раздельную ПЦР-амплифицикацию кДНК, кодирующих Н- и L-цепи.
3. Амплифицированные кДНК обрабатывают специфическими рестрицирующими эндонуклеазами, а затем встраивают в вектор на основе бактериофага λ. кДНК Н- и L-цепей содержат разные, характерные для каждой из них эндонуклеазные сайты, что облегчает специфическое встраивание каждой нуклеотидной последовательности в свой вектор. На этом этапе происходит клонирование множества разных сегментов Н- и L-цепей (рис. 10.13, А и Б).
4. кДНК одной Н- и одной L-цепи встраивают в общий «комбинаторный» вектор, так что в бактериофаге синтезируются обе цепи и образуется «полноценный» Fv-фрагмент (рис. 10.13, В).
Синтез Н- и L-цепей происходит во время литического цикла бактериофага λ, поэтому можно провести скрининг библиотеки клонов комбинаторных бактериофагов с целью определения их антигенсвязывающей активности.
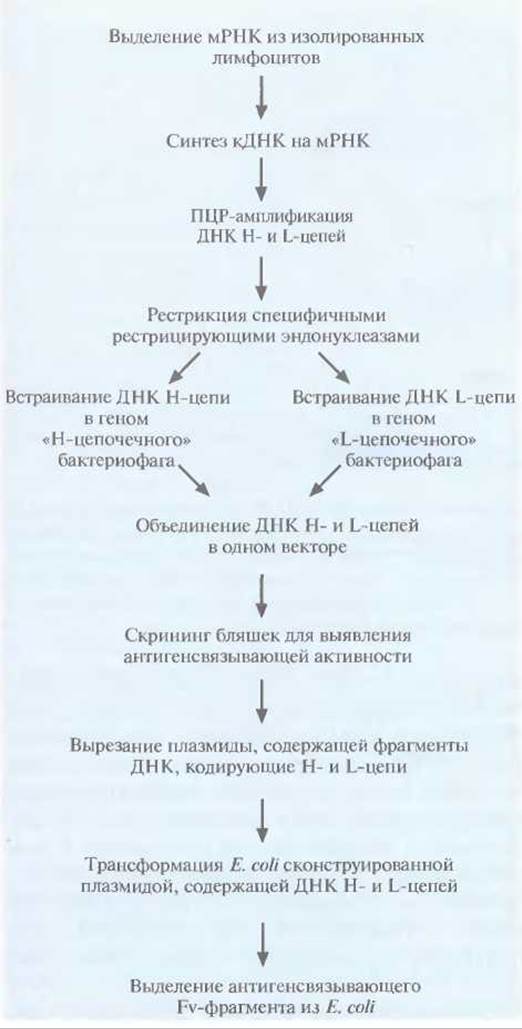
Рис. 10.12. Создание с помощью Е. coli комбинаторной библиотеки кДНК VL- и VH-областей антитела.
На этапе соединения кДНК Н- и L-цепей в одном векторе образуется широкий спектр генов различных антител. Некоторые из них кодируют уникальные сайты связывания, получить которые с помощью обычной гибридомной технологии было бы невозможно. Пул антител млекопитающих включает 106—108 разных антител. Фаговая библиотека содержит примерно столько же клонов, поэтому можно ожидать, что одна комбинаторная библиотека будет вырабатывать такое же количество различных антител (Fv-moлекул), как любое млекопитающее. Кроме того, однажды создав исходную комбинаторную библиотеку, можно комбинировать L- и Н-цепи и получать Fv-фрагменты, распознающие необычные эпитопы. Еще большего разнообразия можно достичь, используя неспецифический мутагенез. Поскольку за относительно короткое время можно провести скрининг миллионов фаговых бляшек, идентификация Fv-фрагментов с нужной специфичностью занимает от 7 до 14 дней. Для сравнения: скрининг нескольких сотен гибридомных клеточных линий обычно занимает месяцы.
Векторы на основе бактериофага X не очень пригодны для получения больших количеств белковых молекул. Чтобы решить эту проблему, сконструировали такой вектор, в котором ДНК Н- и L-цепей встраиваются в сайт, фланкированный плазмидной ДНК. Такую плазмиду, содержащую ДНК Н- и L-иепи, можно вырезать из вектора и трансформировать ею Е. coli (рис. 10.12). Являясь частью плазмиды, ДНК Fv-фрагментов будет многократно реплицироваться в клетках Е. coli с образованием большого количества продукта, который можно использовать как в диагностических, так и в терапевтических целях.При создании комбинаторных библиотек вместо фага λ можно использовать нитевидные бактериофаги М13 или fd (рис. 10.14). В этих случаях соответствующий фрагмент антитела синтезируется как часть химерного белка, локализованного на поверхности фаговой частицы. Скрининг комбинаторной библиотеки фрагментов антител можно провести при помощи ферментного иммуносорбентного анализа (ELISA). Суть метода состоит в следующем: образцы (аликвоты) из библиотеки помещают в ячейки планшеты, содержащие антиген-мишень. Ячейки промывают, чтобы удалить несвязанные фаговые частицы. В каждую ячейку вносят конъюгат, состоящий из антитела, связывающегося с белком фаговой оболочки, и фермента. Ячейки промывают для удаления несвязанного конъюгата и добавляют в каждую из них хромогенный субстрат, который расщепляется ферментом, связанным с фагом, и окрашивает те ячейки, в которых находятся фаговые частицы, несущие антитела к антигену-мишени. Процесс отбора и последующая очистка бактериофагов, синтезирующих фрагмент антитела, специфичный к нужному антигену, в этом случае гораздо проще, чем тогда, когда проводится подсчет бляшек бактериофага λ. Выделив фаг, синтезирующий желаемый фрагмент антитела, можно экстрагировать кодирующую этот фрагмент ДНК и субклонировать ее в экспрессирующем векторе. Разные варианты антител с повышенным сродством к антигену-мишени можно получать замещением фрагментов ДНК VL - и VH-областей или с помощью неспецифического мутагенеза.

Рис. 10.13. Сконструированные участки ДНК из комбинаторной библиотеки кДНК Fv-фрагмента, клонированные в бактериофаг а. А и Б. Фрагменты ДНК I -(А) и H-(Б) цепей раздельно встроили в векторы на основе бактериофага а. В. Провели рестрикцию каждой ЕcoRІ-библиотеки и лигировали фрагменты ДНК из библиотеки Н-цепи с фрагментами ДНК из библиотеки L-цепи, в результате чего получили комбинаторную библиотеку, содержащую все возможные сочетания фрагментов L- и Н-цепей с экспрессией соединенного фрагмента в одном векторе. pLac — laс-промотор Е. coli, ССР — сайт связывания с рибосомой.
Разработав методы получения Fv-фрагментов, исследователи попытались определить, способна ли отдельная белковая цепочка, состоящая только из VL- и VH доменов, образовать функциональную молекулу, связывающую антиген. Компьютерное моделирование трехмерной структуры предполагаемого одноцепочечного антитела показало, что для образования конформации, необходимой для связывания антигена, VL - и VH-домены должны быть разделены линкерным пептидом. Имея это в виду, VL- и VH-ДНК, синтезированные на кДНК-матрице клонированного моноклонального антитела, присоединили к химически синтезированному ДНК-линкеру, создав конструкцию VL-ДHK—линкер—VH-ДНК. Соответствующий одноцепочечный белок синтезировали в Е. coli, очистили и обнаружили, что его сродство и специфичность к антигену сходны с таковыми интактного моноклонального антитела. Таким образом, с помощью Е. coli можно без труда получать функциональные одноцепочечные антитела.
Одноцепочечные антитела могут найти широкое применение в клинике в тех случаях, когда проявление Fc-эффекторных функций не является необходимым, а малый размер молекулы (мол. масса одноцепочечного антитела составляет примерно 27 кДа, а иммуноглобулина G — 150 кДа) дает определенные преимущества. Кроме того, к одноцепочечному антителу можно присоединить последовательность, кодирующую тот или иной белок, получив бифункциональную молекулу, которая сможет связываться с определенной мишенью, проявляя при этом специфическую активность.

Рис. 10.14. Создание комбинаторной библиотеки кДНК Fv-фрагментов антител с помощью нитевидного бактериофага М13. кДНК VL- и VH-областей амплифицировали методом ПЦР, а затем лигировали, используя ДНК короткого линкерного пептида. Полученные фрагменты ДНК, составляющие комбинаторную библиотеку кДНК одноцепочечных антител, встроили в геном фага М13 с присоединением их к фаговому гену 3, который кодирует поверхностный фаговый белок. В М13 с гена 3 синтезируется три белковых молекулы, поэтому каждый рекомбинантный фаг М13, содержащий комбинаторную библиотеку кДНК однонепочечных антител, будет нести гри молекулы химерного белка, состоящего из продукта гена 3 и одноцепочечного антитела.
Был проведен также еще один эксперимент: вместо того чтобы соединять VL- и VH-цепи коротким пептидом, аминокислоты каркасной области модифицировали таким образом, чтобы между ними образовывался дисульфидный мостик. Эффективность такой стабилизированной дисульфидной связью Fv-молекулы, связанной с токсином, разрушающим раковые клетки, сравнили с эффективностью одноцепочечной Fv-молекулы, связанной с тем же токсином (рис. 10.15). Обнаружилось, что стабилизированный дисульфидной связью и одноцепочечный Fv-иммунотоксины обладают одинаковой активностью и специфичностью, но первый в несколько раз стабильнее. Можно предположить, что в каких-то ситуациях стабилизированные Fv-молекулы могут оказаться предпочтительнее одноцепочечных Fv-молекул.

Рис. 10.15. Схематическое изображение одноцепочечного Fv-иммунотоксина (А) и Fv-иммунотоксина, стабилизированного дисульфидной связью (Б).
Лекарственные средства против ВИЧ
Ученым пока не удалось получить вакцину, достаточно эффективную против вируса иммунодефицита человека (ВИЧ), который вызывает развитие синдрома приобретенного иммунодефицита (СПИД). Параллельно с созданием такой вакцины идет поиск других средств, позволяющих замедлить патологический процесс.
ВИЧ поражает один из видов лимфоцитов, а именно Т-хелперы (ТН-клетки). В норме в процессе развития иммунного ответа Тн-клетки связывают продукты деградации специфических антигенов и высвобождают факторы, стимулирующие другие клетки иммунной системы к участию в иммунном ответе. ТН-клетки играют в этом процессе ключевую роль, а при ВИЧ-инфекции они перестают функционировать. Как только вирус внедряется в ТН-клетку, он становится защищенным от иммунной системы организма и начинает оказывать свое разрушающее действие на ТН-клетки.
✵ В результате размножения вируса в инфицированной клетке происходит ее лизис.
✵ Пораженная клетка действует как фабрика по производству ВИЧ-гликопротеина (gp120), который вызывает разрушение ТН-клеток и других Т-лимфоцитов.
✵ Пораженная клетка сливается с другими ТН-клетками, формируя синцитий, который не способен выполнять функции, свойственные индивидуальным ТН-клеткам.
Основным следствием ВИЧ-инфекции является неспособность иммунной системы организма обеспечивать его защиту от обычных бактериальных и вирусных инфекций, которые в конце концов приводят к гибели больного, несмотря на лечение антибиотиками и другими средствами.
На первом этапе ВИЧ-инфекции происходит взаимодействие между гликопротеином оболочки вируса мол. массой 120 кДа (gp120) и рецептором на поверхности ТН-клеток — CD4 (рис. 10.16, A). In vitro поражение Тн-клеток блокируется антителами к CD4; процесс замедляется также при избытке свободного белка CD4. Однако ни один из этих способов не приводит к уничтожению вируса. Один из подходов, обеспечивающих как защиту ТН-клеток, так и инактивацию вируса, заключается в создании химерного белка, состоящего из фрагмента молекулы CD4 и Fc-фрагмента иммуноглобулина. Свойства этого белка, называемого СD4-иммуноадгезином, определяются составными частями его молекулы: СD4-компонент связывает gp120 и блокирует ВИЧ, а иммуноглобулиновый обеспечивает замедление разрушения молекулы в плазме и ее связывание с клетками, несущими рецептор к антителу. После присоединения СD4 - иммуноадгезина к свободной вирусной частице или к инфицированной клетке запускается реакция опосредованной антителами клеточной цитотоксичности, которая обеспечивает уничтожение вируса или пораженной им клетки.

Рис. 10.16. ВИЧ-инфекция и ее терапия. А. Связывание ВИЧ с ТН-клеткой опосредуется контактированием вирусного белка gp120 с ТН-клеточным поверхностным белком CD4. Б. На поверхности ВИЧ-инфицированной клетки находится белок gp120, с которым может связываться свободный химерный комплекс CD4—токсин. Попав внутрь инфицированной клетки, токсиновая часть химерной молекулы убивает ее
Другой подход, позволяющий контролировать развитие ВИЧ-инфекции, заключается в создании системы мечения ВИЧ-пораженных клеток для их специфического уничтожения. Например, если сшить два фрагмента ДНК, один из которых кодирует рецептор CD4, а другой — внутриклеточный токсин Pseudomonas (экзотоксин А), то мы получим ген, кодирующий химерный белок с комбинированными свойствами (рис. 10.17). Экзотоксин A Pseudomonas — это белок с мол. массой 66 кДа, состоящий из трех доменов: домен I отвечает за связывание с клеткой, Ц — за проникновение белка в клетку, III — за присоединение ADP-рибозы к эукариотическому фактору элонгации (EF-2), что приводит к его инактивации. Химерный белок CD4—экзотоксин A Pseudomonas вместо домена I содержит большую часть последовательности CD4 (рис. 10.17), в результате чего обладает и цитотоксической активностью экзотоксина Pseudomonas, и gp120-связывающей активностью CD4. На поверхности всех ВИЧ-пораженных клеток находится гликопротеин gp120, поэтому СD4-домен химерного белка соединяется исключительно с этими клетками. Присоединившись к инфицированной клетке, химерный белок проникает внутрь нее при участии домена II экзотоксина A Pseudomonas. Затем экзотоксиновая часть химерного белка инактивирует фактор элонгации EF-2, участвующий в синтезе белка. Это препятствует дальнейшему синтезу белка, что в конце концов приводит к гибели клетки. Таким образом, СD4-домен «помечает» ВИЧ-пораженные клетки, а экзотоксин выступает в роли «наемного убийцы».
Синтезируясь в Е. coli, химерный белок образует нерастворимые цитоплазматические включения. Их растворяют в гуанидингидрохлориде и выделяют с помощью быстрого разведения и анион-обменной хроматографии. Полученный таким образом белок с успехом выдержал проверку в контрольной культуре клеток. Однако в организме человека на Pseudomonas-компонент химерного белка может возникнуть иммунная реакция, и не исключено, что его придется вводить вместе с каким-либо иммуносупрессантом, например циклоспорином. Нужно иметь в виду, что описанный выше способ борьбы с ВИЧ-инфекцией находится на начальной стадии разработки, хотя в будущем и может оказаться весьма эффективным. Подобные иммунопрепараты обладают достаточно высокой эффективностью, что позволяет применять их в низких дозах и свести к минимуму побочное действие на иммунную систему. Кроме того, они могут оказаться полезными для лечения различных новообразований, а иногда и заменять химиотерапию. На пораженные клетки можно «нацелить» и другие цитотоксичные белки, например дифтерийный токсин или растительный токсин рицин. Впрочем, даже при оптимальном развитии событий пройдет еще несколько лет, прежде чем терапевтическое применение рекомбинантных экзотоксинов станет рутинным.

Рис. 10.17. Генетически сконструированный химерный комплекс CD4—экзотоксин A Pseudomonas. Использован промотор бактериофага Т7 Е. coli.