Молекулярная биология клетки - Том 1 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1994
Молекулярная организация клеток
Плазматическая мембрана
Перенос через мембрану макромолекул и частиц: экзоцитоз и эндоцитоз
Транспортные белки опосредуют проникновение через клеточные мембраны многих полярных молекул небольшого размера, однако они не способны транспортировать макромолекулы, например белки, полинуклеотиды или полисахариды. Тем не менее в большинстве клеток макромолекулы могут как поглощаться, так и секретироваться, а некоторые специализированные клетки способны захватывать даже крупные частицы. Механизмы, с помощью которых клетки осуществляют эти процессы, сильно отличаются от механизмов, опосредующих транспорт небольших молекул и ионов. При переносе макромолекул происходит последовательное образование и слияние окруженных мембраной пузырьков (везикул). Например, для того чтобы секретировать инсулин, клетки, продуцирующие этот гормон, упаковывают его в специализированные секреторные пузырьки. В ответ на внеклеточные сигналы эти пузырьки сливаются с плазматической мембраной и открываются во внеклеточное пространство, высвобождая при этом инсулин. Подобный процесс слияния называется экзоцитозом. Клетки способны также поглощать макромолекулы и частицы, используя сходный механизм, только в обратной последовательности. Поглощенное вещество постепенно окружается небольшим участком плазматической мембраны, который сначала впячивается, а затем отщепляется, образуя внутриклеточный пузырек, содержащий захваченный клеткой материал. Этот процесс называется эндоцитозом. Процессы экзоцитоза и эндоцитоза представлены для сравнения на рис. 6-68. Оба механизма включают слияние первоначально разделенных участков липидного бислоя и осуществляются по крайней мере в две стадии: на первой два бислоя склеиваются (слипание бислоев), а затем сливаются (слияние бислоев). Обе стадии, по-видимому, опосредуются специализированными белками, что будет обсуждаться ниже (см. разд. 6.5.16).
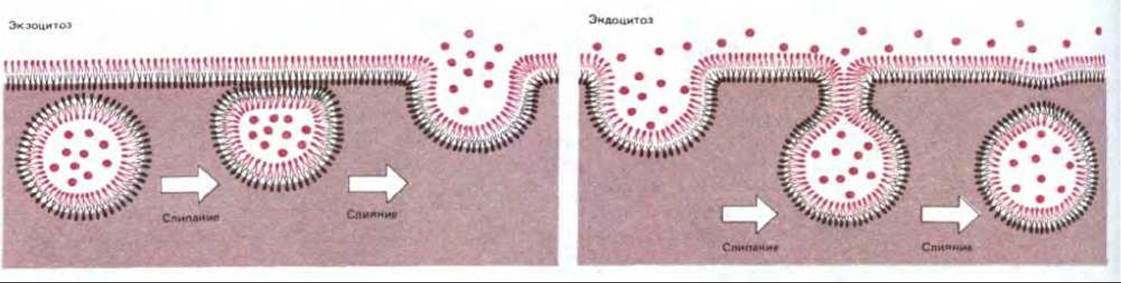
Рис. 6-68. Слипание и объединение бислоев при экзоцитозе и эндоцитозе. Внеклеточное пространство находится сверху; оно отделено от цитоплазмы (снизу) плазматической мембраной. Обратите внимание, что из-за наличия стадии слипания бислоев экзоцитоз и эндоцитоз не повторяют друг друга в обратном порядке: при экзоцитозе слипаются два монослоя плазматической мембраны, обращенные к цитоплазме, тогда как при эндоцитозе два наружных монослоя мембраны. В обоих случаях сохраняется асимметрический характер мембран и монослой, обращенный к цитоплазме, всегда контактирует с цитозолем.
Важная особенность как экзоцитоза, так и эндоцитоза заключается в том, что секретируемые или поглощаемые макромолекулы локализуются в пузырьках и обычно не смешиваются с другими макромолекулами или органеллами клетки. Пузырьки могут сливаться только со специфическими мембранами, что обеспечивает направленный перенос макромолекул между внеклеточным пространством и содержимым клетки. Аналогичный процесс осуществляется во время переноса новосинтезированных макромолекул из эндоплазматического ретикулума в аппарат Гольджи и затем к другим компартментам клетки (см. гл. 8). Хотя ясно, что быстрое и повсеместное образование и слияние пузырьков - это фундаментальная особенность всех эукариотических клеток, молекулярные механизмы, обеспечивающие приведение в действие и направление этого транспорта по специфическим путям, во многом еще требуют изучения.
6.5.1. Существуют два пути экзоцитоза - конститутивный и регулируемый [38]
Во всех эукариотических клетках транспортные пузырьки непрерывно переносят новые компоненты плазматической мембраны из аппарата Гольджи к плазматической мембране посредством экзоцитоза. В то же время клетки секретируют различные типы молекул с помощью процесса экзоцитоза. Некоторые из этих молекул могут оставаться на поверхности клетки и становятся частью клеточной мембраны, другие выходят во внеклеточный матрикс. При этом часть из них диффундирует во внутритканевую жидкость и/или в кровь для питания или переноса сигнала к другим клеткам.
Как описано в гл. 8, секретируемые белки синтезируются на рибосомах, связанных с мембранами шероховатого эндоплазматического ретикулума (ЭР). Эти белки проходят в полость ЭР и транспортируются к аппарату Гольджи с помощью отпочковавшихся от ЭР транспортных пузырьков. В аппарате Гольджи белки модифицируются, концентрируются, сортируются и затем упаковываются в пузырьки, которые отщепляются в цитозоль и в конце концов сливаются с мембраной. В отличие от макромолекул секретируемые молекулы малых размеров, например гистамин (см. ниже), активно транспортируются из цитозоля в уже сформировавшиеся пузырьки, где они зачастую связываются со специфическими макромолекулами (в случае гистамина - с протеогликанами) и в результате могут накапливаться в высокой концентрации, не создавая при этом чрезмерного осмотического градиента.
Некоторые белки непрерывно секретируются производящими их клетками. При этом они упаковываются в транспортные пузырьки в аппарате Гольджи и затем переносятся непосредственно к плазматической мембране. В этом случае говорят о конститутивном пути секреции. В других клетках определенные белки и/или малые молекулы запасаются в специальных секреторных пузырьках, которые сливаются с плазматической мембраной только после получения клетки соответствующего сигнала извне. Этот процесс носит название регулируемого пути секреции (рис. 6-69). Конститутивный путь осуществляется во всех клетках, а регулируемый путь обнаружен главным образом в клетках, приспособленных для секреции производимых ими веществ в зависимости от определенных потребностей. Обычно это гормоны, нейротрансмиттеры или переваривающие ферменты. В таких специализированных секреторных клетках сигналом к секреции часто служит химический медиатор, например, гормон, связывающийся с рецепторами на клеточной поверхности. В результате происходит активация рецепторов, которая генерирует внутриклеточный сигнал, зачастую включающий кратковременное повышение концентрации свободного Са2+ в цитозоле (см. разд. 12.3.7). С помощью неизвестного механизма этот сигнал (сигналы) инициирует процесс экзоцитоза, побуждая секреторные пузырьки к слиянию с плазматической мембраной и, таким образом, к высвобождению их содержимого во внеклеточное пространство.
В процессе экзоцитоза мембраны пузырьков объединяются с плазматической мембраной (см. рис. 6-68). По крайней мере в случае регулируемого пути белки и липидные компоненты секреторных мембран возвращаются позднее специфическим образом в первоначальное состояние посредством экзоцитоза, для того чтобы войти в состав новых секреторных пузырьков. Общая площадь мембраны секреторных пузырьков, временно включающейся в состав плазматической мембраны, может быть огромна: в ацинарной клетке поджелудочной железы, выделяющей пищеварительные ферменты, в состав апикальной плазматической мембраны (площадь которой составляет лишь 30 мкм2) при стимулировании клетки к секреции включается до 900 мкм2 везикулярной мембраны.
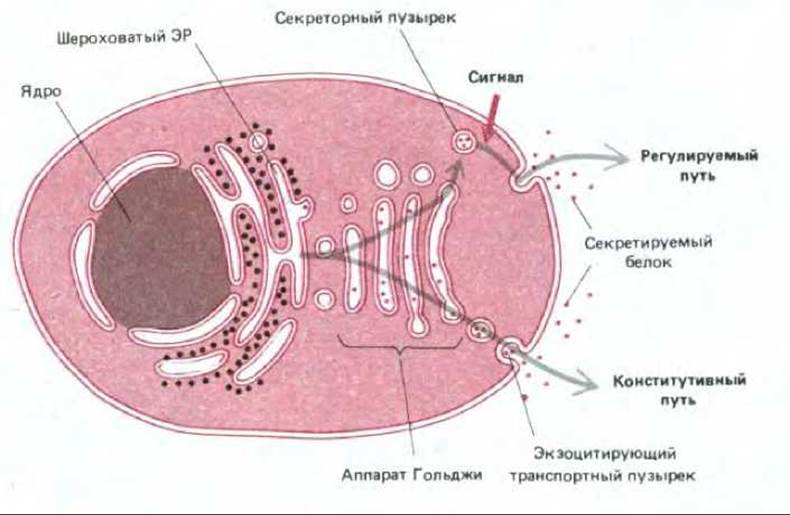
Рис. 6-69. Два пути прохождения секретируемых белков. Некоторые секретируемые белки упаковываются в транспортные пузырьки и непрерывно секретируются (конститутивный путь). Другие содержатся в специальных секреторных везикулах и высвобождаются только в ответ на стимуляцию клетки внеклеточными сигналами (регулируемый путь). Конститутивный путь осуществляется во всех эукариотических клетках, тогда как регулируемый путь - только в клетках специализированных для секреции (секреторных клетках).
6.5.2. Регулируемый экзоцитоз - это локальный ответ плазматической мембраны и находящейся под ней цитоплазмы [39]
Тучные клетки секретируют гистамин (см. табл. 12-1) в ответ на связывание специфических лигандов с рецепторами на их поверхности. Именно гистамин, секретируемый тучными клетками ответствен за многие неприятные симптомы, такие, как зуд или чихание, сопровождающие аллергические реакции. Если тучные клетки проинкубировать в среде, содержащей растворимый стимулятор, то экзоцитоз наблюдается по всей клеточной поверхности (рис. 6-70). Если же стимулирующий лиганд искусственно связан с твердой гранулой, так что он может взаимодействовать только с небольшим участком поверхности тучной клетки, экзоцитоз ограничивается местом контакта с гранулой (рис. 671). Ясно, что тучная клетка не отвечает на стимуляцию как нечто целое: активация рецепторов, внутриклеточные сигналы как результат этой активации и последующий экзоцитоз, очевидно, происходят лишь в том участке клетки, который подвергается стимуляции. Это свидетельствует о важном свойстве плазматической мембраны: отдельные ее участки могут функционировать независимо от остальной мембраны. Как мы видим, это свойство одинаково важно как для экзоцитоза, так и для эндоцитоза.
6.5.3. Существуют два вида эндоцитоза: пиноцитоз и фагоцитоз [40]
В зависимости от размера образующихся пузырьков различают два типа эндоцитоза: пиноцитоз (от греч. ріnо - пью + kitos - клетка), предполагающий поглощение жидкости и растворенных веществ с помощью небольших пузырьков (150 нм в диаметре), и фагоцитоз (от греч. phagos - пожирающий + kitos - клетка), означающий поглощение больших частиц, таких, как микроорганизмы или обломки клеток. В этом случае образуются крупные пузырьки, называемые фагосомами, или вакуолями (с диаметром, как правило, > 250 нм).
Жидкость и растворенные вещества непрерывно поглощаются большинством эукариотических клеток посредством пиноцитоза, тогда как большие частицы захватываются в основном специализированными клетками - фагоцитами. По этой причине для большинства клеток термины «пиноцитоз» и «эндоцитоз» обычно употребляются в одном и том же смысле.
Большинство частиц и молекул, поглощенных клеткой посредством фагоцитоза или пиноцитоза заканчивают свой путь в лизосомах. Большие частицы включаются в фагосомы, которые затем, видимо, сливаются с лизосомами, образуя фаголизосомы. Жидкость и макромолекулы, поглощенные при пиноцитозе, первоначально переносятся в промежуточные мембраносвязанные органеллы, называемые эндосомами, откуда они в конце концов либо переходят в лизосомы, либо специфическим образом возвращаются обратно. Поскольку в лизосомах имеются разнообразные гидролитические ферменты (см. разд. 8.8.1), большая часть материала, содержащегося в фагосомах и эндосомах, слившихся с лизосомами, быстро разрушается, низкомолекулярные продукты распада, такие, как аминокислоты, сахара и нуклеотиды, транспортируются через мембрану лизосомы в цитозоль, где они могут быть использованы клеткой. Большинство же мембранных компонентов эндоцитозных пузырьков возвращаются с помощью экзоцитоза из фагосом и эндосом и повторно утилизируются в плазматической мембране.
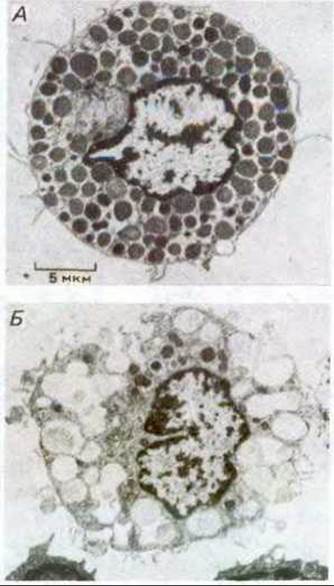
Рис 6-70. Электронные микрофотографии, показывающие экзоцитоз в тучных клетках крысы. А. Клетка не подвергалась стимуляции. Б. Клетка активировалась внеклеточным лигандом с целью вызвать секрецию запасенного в ней гистамина. Пузырьки, содержащие гистамин, выглядят темными, а пузырьки, освободившиеся от него, - светлыми. То, что остается в пузырьках после секреции гистамина, представляет собой сеть из протеогликанов, с которыми в норме связан запасаемый гистамин. Если секреторный пузырек слился с плазматической мембраной, то его собственная мембрана часто служит после этого мишенью для слияния с другими секреторными пузырьками. Таким образом, множество секреторных пузырьков в тучных клетках открывается во внеклеточное пространство через другие открывшиеся пузырьки. В результате клетка (Б) содержит несколько больших полостей, образованных слившимися друг с другом мембранами множества опорожненных пузырьков, составляющих теперь с плазматической мембраной единое целое. Эти полости не всегда оказываются в одной плоскости сечения клетки. (По D. Lawson et al., J. Exp. Med., 142, 391-402, 1975, с разрешения Rockefeller University Press.)

Рис. 6-71. Электронная микрофотография тучной клетки, активированной с целью вызвать секрецию гистамина. Активация проводилась с помощью стимулятора, «пришитого» к твердой грануле. Экзоцитоз идет только в той области клетки, которая контактирует с гранулой. (По D. Lawson et al., J. Cell. Biol., 79, 394-400, 1978, с разрешения Rockefeller University Press.)
6.5.4. Пиноцитозные пузырьки образуют окаймленные ямки в плазматической мембране [41]
Практически все эукариотические клетки непрерывно поглощают кусочки своих мембран в виде небольших эндоцитозных (пиноцитозных) пузырьков, которые впоследствии возвращаются на клеточную поверхность. Этот цикл эндоцитоза начинается в специализированных областях плазматической мембраны, называемых окаймленными ямками. На обычных электронных микрофотографиях эти области выглядят как впячивания плазматической мембраны, окаймленные щетиноподобной структурой на цитоплазматической стороне. В различных клетках такие структуры занимают около 2% общей площади плазматической мембраны. Время жизни окаймленных ямок невелико: формируются они примерно в течение минуты, затем втягиваются в клетку и, сужаясь у основания, отщепляются, образуя окаймленные пузырьки (рис. 6-72). Установлено, что из плазматической мембраны фибробластов, растущих в культуре, в течение каждой минуты отщепляется примерно 2500 окаймленных пузырьков. Время их жизни оказалось даже меньше, чем у окаймленных ямок: они очень быстро теряют свою кайму и после этого могут сливаться с эндосомами. Содержимое этих эндоцитозных пузырьков в конце концов попадает в лизосомы либо возвращается в прежнее состояние.

Рис. 6-72. Электронные микрофотографии, иллюстрирующие вероятную последовательность событий при образовании окаймленного пузырька из окаймленной ямки. Показанные здесь окаймленные ямка и пузырьки участвуют в продвижении липопротеиновых частиц внутрь очень большого куриного ооцита при образовании желтка; они здесь несравненно крупнее, чем в клетках обычного размера. (С любезного разрешения М. М. Perry и А. В. Gilbert, J. Cell. Sci., 39, 257-272, 1979.)
6-30
6.5.5. Окаймленные ямки содержат клатрин [42]
На электронных микрофотографиях образцов, полученных методом быстрого замораживания и глубокого травления, поверхность окаймленных ямок и пузырьков имеет вид сетки из многоугольников (рис. 6-73). Из чего же построена кайма и каковы ее функции? После того как окаймлённые пузырьки, образующиеся из окаймленных ямок, были выделены, обнаружилось, что их мембраны содержат несколько «мажорных» белков. Из них лучше всего охарактеризован клатрин - белковый комплекс, весьма консервативный в эволюции. Он состоит из трех длинных и трех коротких полипептидных цепей, образующих трехвалентный белковый комплекс (трискелион). Трискелионы формируют на цитоплазматической поверхности мембраны корзиноподобные сетчатые структуры из шестиугольников и пятиугольников (рис. 6-74). Остальные белки, более тесно связанные с мембраной окаймленных пузырьков, необходимы для связывания клатриновой оболочки с пузырьком и для улавливания различных рецепторов плазматической мембраны (см. ниже).
Предполагают, что впячивание окаймленной ямки осуществляется за счет сил, возникающих при ассоциации клатрина с другими белками оболочки, находящимися на цитоплазматической поверхности плазматической мембраны. После формирования окаймленного пузырька клатрин вместе с ассоциированными белками отделяется от мембраны пузырька и возвращается в плазматическую мембрану для образования новых окаймленных ямок. Однако остается неясным, каким образом индуцируется образование окаймленной ямки, как окаймленная ямка превращается в окаймленный пузырек и каким образом происходит отделение этой оболочки от пузырька. Интересно, что один из белков, относящихся к семейству hsp 70 (белков теплового шока), действует in vitro как АТРаза, удаляющая клатриновую оболочку с пузырьков (см. разд. 8.8.6). Видимо, должен существовать некий механизм, контролирующий преждевременное удаление клатриновой оболочки с окаймленной ямки до ее превращения в пузырек, поскольку оболочка на ямке существует намного дольше.

Рис. 6-73. Электронная микрофотография многочисленных окаймленных ямок и пузырьков на внутренней поверхности плазматической мембраны фибробластов в культуре. Клетки были быстро заморожены в жидком гелии, подвергнуты скалыванию и затем глубокому травлению, чтобы сделать видимой цитоплазматическую поверхность плазматической мембраны. (По J. Heuser, J.Cell. Biol., 84, 560-583, 1980, с разрешения Rockefeller University Press.)

Рис. 6-74. Структура клатриновой оболочки. А. Электронные микрофотографии клатриновых трискелеонов, оттененных платиной. Каждый трискелеон состоит из трех тяжелых и трех легких полипептидных цепей клатрина. Естественно, эти детали на микрофотографиях не видны. Б. Трехмерная модель клатриновой оболочки. 36 трискелеонов образуют сеть из 12 пятиугольников и 8 шестиугольников. Концы двух трискелеонов отмечены на фотографии. Обратите внимание, что каждая ножка трискелеона проходит вдоль двух соседних граней многоугольника и затем поворачивает внутрь, так что их N-концевые домены (черные кружки) образуют внутренний остов оболочки. То, что гибкие концы трискелеонов перекрываются друг с другом, обеспечивает как механическую прочность, так и подвижность всей структуры. Клатриновые оболочки других размеров и форм сконструированы аналогичным образом из 12 пятиугольников и различного числа шестиугольников. (А - Ungewickell и D. Branton, Nature, 289, 420-422, 1981; Б - G.P.A. Vigers et al., EMBO J., 5, 2079-2085, 1986.)
6.5.6. Существуют по крайней мере два типа окаймленных пузырьков [43]
В большинстве клеток именно окаймленные ямки и пузырьки осуществляют пиноцитозное поглощение внеклеточной жидкости и мембраносвязанных лигандов. Однако известны пути пиноцитоза, использующие и другие типы пузырьков. К сожалению, недостаток знаний о них в настоящее время не позволяет судить о том, насколько они важны. Некоторые эндотелиальные клетки, выстилающие мелкие кровеносные сосуды, видимо, транспортируют вещества из кровяного русла в окружающую внеклеточную жидкость с помощью эндоцитозных пузырьков, не имеющих клатриновой оболочки. Эти пузырьки курсируют по типу челнока от одной поверхности клетки к другой в процессе, называемом трансцитозом. Однако в большинстве других клеток, осуществляющих трансцитоз, этот процесс опосредуется окаймленными ямками и пузырьками (см. разд. 6.5.11).
Не все окаймленные пузырьки в клетке образуются из плазматической мембраны. В гл. 8 будет обсуждаться вопрос о том, что многие из пузырьков непрерывно образуются из эндоплазматического ретикулума и в аппарате Гольджи. Они осуществляют крупномасштабный везикулярный транспорт между этими и другими органеллами. Существуют по крайней мере два типа окаймленных пузырьков: 1) пузырьки с клатриновой оболочкой, участвующие как в эндоцитозе, так и в везикулярном транспорте из транс-сети Гольджи в эндолизосомы (см. ниже) и секреторные пузырьки (см. разд. 8.9); 2) пузырьки с неклатриновыми оболочками, осуществляющие везикулярный транспорт из эндоплазматического ретикулума в аппарат Гольджи, из одной цистерны аппарата Гольджи в другую и из аппарата Гольджи к плазматической мембране. Молекулы, образующие оболочку на этих пузырьках, пока неохарактеризованы. Окаймленные (клатриновые) пузырьки и ямки могут быть устроены гораздо сложнее, чем неклатриновые, поскольку они способны узнавать специфические макромолекулы для транспортировки их внутрь, тогда как неклатриновые пузырьки этого делать не могут.
6-35
6.5.7. Эндоцитоз, опосредуемый рецепторами, служит концентрирующим приспособлением для поглощения специфических внеклеточных макромолекул
В большинстве животных клеток клатрин-окаймленные ямки и пузырьки обеспечивают эффективный способ поглощения из внеклеточной жидкости специфических макромолекул в процессе, называемом опосредуемым рецепторами эндоцитозом. Макромолекулы связываются со своими рецепторами на поверхности клетки, накапливаются в окаймленной ямке и погружаются в клетку в виде макромолекулярных комплексов, заключенных в эндоцитозный пузырек. Поскольку внеклеточная жидкость попадает в окаймленную ямку и включается в окаймленные пузырьки, растворенные в ней вещества также поглощаются, но с намного меньшей скоростью - этот процесс называется жидкофазным эндоцитозом. Опосредуемый рецепторами эндоцитоз обеспечивает механизм селективного концентрирования, который увеличивает эффективность поглощения специфических лигандов более чем в 1000 раз, так что даже минорные компоненты внеклеточной жидкости могут специфически поглощаться в большом количестве (без поглощения большого объема внеклеточной жидкости).
6-33
6-34
6.5.8. Клетки поглощают холестерол вместе с липопротеинами низкой плотности (ЛНП) путем опосредуемого рецепторами эндоцитоза [44]
Важный процесс, идущий во многих животных клетках при помощи опосредуемого рецепторами эндоцитоза - это поглощение холестерола из внеклеточной среды. За счет этого обеспечивается большая часть потребности клеток в холестероле, необходимом для синтеза новых мембран. Если проникновение холестерола в клетки заблокировать, то холестерол накапливается в крови и может способствовать образованию атеросклеротических бляшек на стенках кровеносных сосудов. Основная часть холестерола переносится кровью в виде комплексов с белком. Эти комплексы называются липопротеинами низкой плотности, или ЛНП, и представляют собой большие сферические частицы (22 нм в диаметре), каждая из которых имеет сердцевину, заполненную 1500 молекулами холестерола, связанными сложноэфирными связями с длинными цепями жирных кислот. Сердцевина ЛНП окружена липидным монослоем, содержащим единственную молекулу белка, организующую структуру этой частицы (рис. 6-75).
Когда клетке необходим холестерол для синтеза мембраны, она производит белки-рецепторы ЛНП и встраивает их в плазматическую мембрану. Появившись в мембране, рецептор ЛНП диффундирует в ней до тех пор, пока не встретится с формирующейся окаймленной ямкой и не включится в ее состав (рис. 6-76, А). Поскольку окаймленные ямки постоянно отщепляются, образуя окаймленные пузырьки, все ЛНП-частицы, связавшиеся с ЛНП-рецепторами в окаймленной ямке быстро проникают внутрь клетки. После потери клатриновых оболочек пузырьки высвобождают свое содержимое в эндосомы. В эндосомах ЛНП-частицы и их рецепторы разделяются: рецепторы возвращаются в дальнейшем обратно в мембрану, а ЛНП доставляются к лизосомам (рис, 6-77). В лизосомах эфиры холестерола, находящиеся в ЛНП-частицах, гидролизуются до свободного холестерола, который затем может использоваться клеткой при синтезе новых мембран. Если в клетке скопилось слишком много холестерола, то его синтез, а также синтез белков-рецепторов ЛНП подавляются, в результате чего холестерола и меньше производится, и меньше поглощается извне.
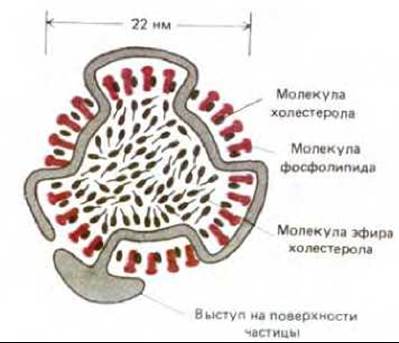
Рис. 6-75. Схематическое изображение липопротеиновой частицы низкой плотности (ЛНП) в поперечном разрезе. Каждая сферическая частица с массой 3 х 106 Да содержит около 1500 молекул эфира холестерола, окруженных липидным монослоем, состоящем из ~800 фосфолипидных и 50 холестерольных (не этерифицированных) молекул. Структуру частицы организует одна молекула белка (500000 Да), ответственная за специфическое связывание ЛНП с рецепторным белком клеточной поверхности.

Рис. 6-76. Белки - рецепторы ЛНП связываются с участками окаймленных ямок в плазматической мембране нормальных клеток (А). Рецепторы ЛНП человека представляют собой трансмембранные гликопротеины, пересекающие бислой 1 раз. Они состоят из 840 остатков, из которых на цитоплазматической стороне находятся лишь 50. Б. Мутантная клетка: белки - рецепторы ЛНП дефектны из-за отсутствия у них участков в цитоплазматическом домене, которые дают им возможность связываться с окаймленными ямками. Такие клетки связывают ЛНП; но не могут поглощать их. У людей примерно один из 500 человек имеет один дефектный ген рецептора ЛНП; для такого человека высок риск смерти в раннем возрасте из-за болезни сердца.
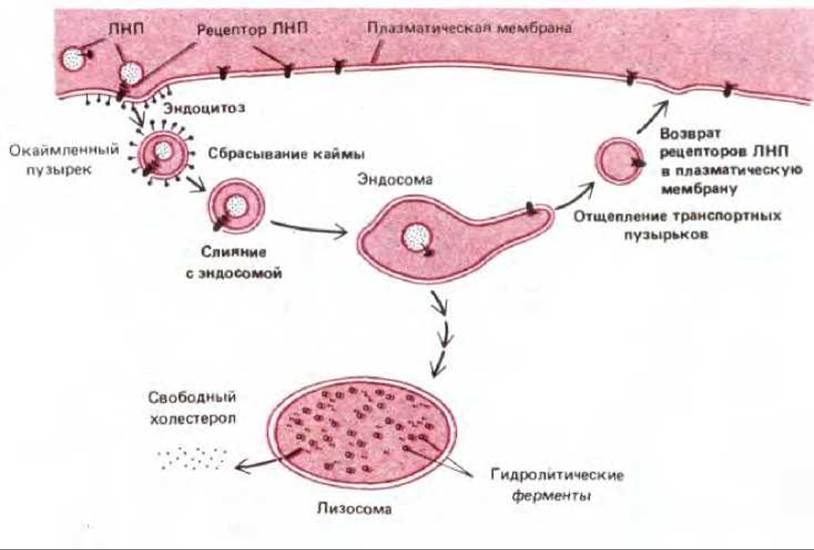
Рис. 6-77. Опосредуемый рецептором эндоцитоз ЛНП. Обратите внимание, что ЛНП диссоциирует от рецептора в кислом окружении в эндосоме. Механизм транспорта не известен. ЛНП попадают в лизосому и деградируют, высвобождая холестерол. ЛНП-рецепторы возвращаются опять в плазматическую мембрану через транспортные пузырьки, которые отщепляются в тубулярной области эндосомы. Для простоты показан только один рецептор ЛНП, проникающий в клетку и возвращаемый в плазматическую мембрану. Независимо от того, связался ли рецептор с ЛНП, он проходит цикл поглощения-возвращения каждые 10 мин, совершая несколько сотен оборотов за время своего существования (около 20 ч).
Этот путь нарушается у некоторых индивидуумов, унаследовавших дефектные гены белков-рецепторов ЛНП: их клетки не способны поглощать ЛНП из крови. Обусловленный этим дефектом высокий уровень холестерола в крови таких индивидуумов создает предрасположение к преждевременному атеросклерозу, так что большинство из них умирает в раннем возрасте от коронарной болезни сердца. Аномалия может также быть связана с утратой рецепторами участка связывания либо с ЛНП, либо с окаймленной ямкой (см. рис. 6-76, Б). В последнем случае имеется достаточное число белков-рецепторов ЛНП, но они не собираются в окаймленных участках плазматической мембраны. ЛНП связываются с поверхностью таких мутантных клеток, однако внутрь не проникают. Это прямо доказывает важность окаймленных ямок в опосредуемом рецепторами эндоцитозе холестерола.
Уже обнаружено более 25 различных рецепторов для разных молекул, участвующих в эндоцитозе. Все они, по-видимому, используют тот же путь через окаймленные ямки. Многие из этих рецепторов встраиваются в окаймленные ямки безотносительно того, связаны ли они со специфическими лигандами или нет. Не все белки плазматической мембраны находятся в окаймленных ямках. Это означает, что ямки работают как молекулярные фильтры, собирающие на своей поверхности определенные белки плазматической мембраны и исключающие присутствие других. Электронно-микроскопические исследования клеток, выращенных в среде с различными лигандами (меченными для того, чтобы различать их при электронной микроскопии), показали, что в одной и той же окаймленной ямке содержится множество видов рецепторов. На участке плазматической мембраны окаймленной ямки может собраться, вероятно, около 1000 рецепторов разных видов. Все комплексы рецепторов с лигандами, утилизируемые в процессе эндоцитоза через окаймленные клатриновые пузырьки, очевидно попадают в дальнейшем в одну и ту же эндосому. Однако последующая судьба этих молекул определяется типом рецептора.
6.5.9. Содержимое эндосом попадает в лизосомы, если не возвращается обратно специфическим образом [45]
На электронных микрофотографиях эндосомный компартмент можно сделать легко различимым объектом, если кратковременно проинкубировать клетки в среде с меченым лигандом. Поглощенный лиганд позволяет выявить эндосомный компартмент в виде сложного набора гетерогенных ограниченных мембраной трубочек и пузырьков. Они располагаются от периферии клетки до ее перинуклеарной области, часто обнаруживаются вблизи аппарата Гольджи, но не в нем самом (рис. 6-78). В экспериментах с меченым лигандом наблюдаются два набора эндосом: периферические эндосомы, появляющиеся непосредственно вблизи плазматической мембраны через 1 минуту, и перинуклеарные (внутренние) эндосомы, появляющиеся через 5-15 мин. Внутреннее содержимое эндосом кислое (рН 5-6) благодаря накачке ионов Н+ из цитозоля внутрь АТР- зависимым Н+-насосом, находящимся в мембране эндосом. Содержимое внутренних эндосом более кислое, чем периферических. Как мы увидим, кислое окружение поглощенных молекул играет исключительную роль в функционировании этих органелл. По-видимому, одна и та же (или несколько сходных) эндосомная Н+-АТРаза закисляет все эндоцитозные и экзоцитозные органеллы, включая фагосомы, лизосомы, отдельные компартменты аппарата Гольджи и многих транспортных или секреторных пузырьков.
Большая часть содержимого перинуклеарных эндосом попадает в лизосомы. Однако многие молекулы избегают этой участи и возвращаются из периферических (и, возможно, перинуклеарных) эндосом в плазматическую мембрану. Это происходит благодаря отщеплению транспортных пузырьков от эндосом. В результате деградации подвергаются лишь те поглощенные молекулы, которые не должны специфическим образом вернуться обратно.
Сейчас известно, что путь от эндосом к лизосомам намного сложнее, чем это казалось раньше. Гидролитические ферменты, предназначенные для лизосом, первоначально поступают из аппарата Гольджи (в транспортных пузырьках) в специальный предлизосомальный компартмент, располагающийся вместе с перинуклеарными эндосомами, но отдельно от них. Хотя эти окруженные мембраной органеллы можно принять за эндосомы, находящиеся на последней стадии созревания, на самом деле процесс гидролитической деградации, который будет завершен в лизосомах, только начинается. Поэтому мы бы назвали эти органеллы эндолизосомами (рис. 6-79).
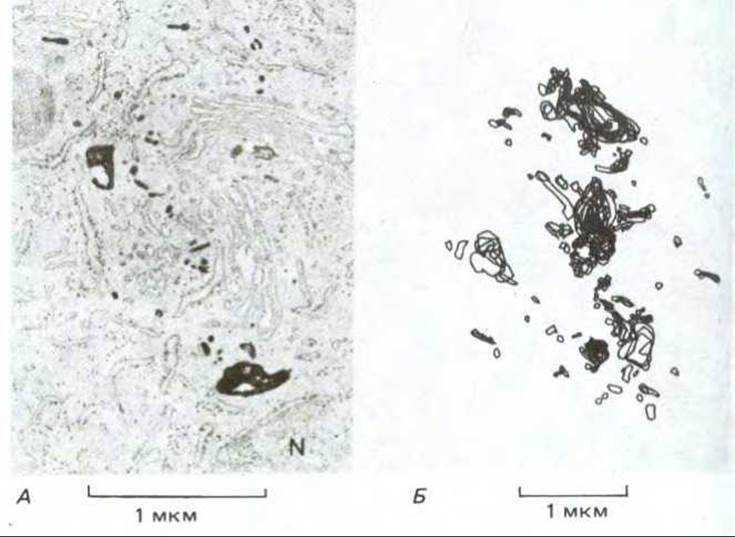
Рис. 6-78. Электронная микрофотография (А) и схематическое изображение (Б) перинуклеарных эндосом из молодых клеток почек хомячка, растущих в культуре. Клетки инкубировали в среде, содержащей пероксидазу, 15 мин при 37 °С, что вполне достаточно для поглощения пероксидазы путем жидкофазного эндоцитоза и переноса в эндосомы (и эндолизосомы, см. текст), но недостаточно для поступления в лизосомы. После фиксации клеток и выдерживания их с субстратом пероксидазы (диаминобензидином) продукты ферментативной реакции фиксировали тетроксидом осмия для увеличения электроноплотности. На (Б) изображена усредненная картина, полученная из 18 тонких срезов. Ядро клетки обозначено буквой N. (А). (Marsh et al., Proc. Natl. Acad. Sci. USA, 83, 2899-2903, 1983.)
Остается неясным, каким образом поглощенные при эндоцитозе молекулы движутся от одного эндосомного компартмента к другому так, что оказываются в конце концов в лизосомах. Одна из гипотез состоит в том, что периферические эндосомы медленно движутся внутрь клетки, превращаясь в перинуклеарные эндосомы, которые в результате слияния с транспортными пузырьками из аппарата Гольджи, непрерывного возвращения части мембраны обратно и увеличения кислотности превращаются в эндолизосомы, а затем в лизосомы. Другая гипотеза предполагает, что каждый эндосомный и лизосомный компартмент может быть перманентной структурой, наподобие стопки цистерн в аппарате Гольджи (см. разд. 8.7.6). Транспорт же между ними осуществляется через транспортные пузырьки, так же как между соседними цистернами аппарата Гольджи. Мы вернемся к вопросу о том, как формируются лизосомы в гл. 8.
6.5.10. Комплексы лиганд-рецептор сортируются внутри эндосом [46]
Эндосомный компартмент работает как главная сортирующая станция в эндоцитозном пути наподобие аппарата Гольджи, выполняющего такую же функцию в биосинтетическом секреторном пути (см. разд. 8.7.6). Кислая среда внутри эндосом играет ключевую роль в процессе сортировки молекул, оказывая влияние на комплексы рецептора с лигандом и, таким образом, определяя их дальнейшую судьбу. При понижении рН находящиеся в эндосоме рецепторы меняют свою кон-формацию и отделяются от своих лигандов. Освободившиеся внутри эндосомы лиганды, как правило, обречены в дальнейшем на разрушение. Другие лиганды, которые остаются связанными со своими рецепторами, в конечном итоге разделяют судьбу своих рецепторов.
Судьба же специфических рецепторов зависит от их функции: 1) они могут быть возвращены в те же самые области плазматической мембраны, откуда они были поглощены (это наиболее общий для рецепторов путь), 2) могут попасть в лизосомы или 3) могут возвратиться в другую область плазматической мембраны в процессе трансцитоза (рис. 6-80).
Рецептор ЛНП, описанный в разд. 6.5.8, проходит первый путь. Он диссоциирует от своего лиганда (ЛНП) в эндосоме и возвращается в плазматическую мембрану для повторного использования, а освободившиеся ЛНП переносятся в лизосомы (см. рис. 6-77). Сходный, но более сложный цикл имеет место при эндоцитозе трансферрина - белка-переносчика железа в крови. Рецептор трансферрина, находящийся на поверхности клетки, переносит трансферрин со связанными ионами железа в периферические эндосомы в процессе эндоцитоза. При низком рН в эндосоме индуцируется отделение железа от трансферрина, но трансферрин (называемый в данном случае апотрансферрином) остается связанным с рецептором и возвращается в плазматическую мембрану в виде комплекса рецептор - апотрансферрин. Попадая во внеклеточную жидкость, имеющую нейтральный рН, апотрансферрин диссоциирует от рецептора и становится способен вновь связывать ионы железа и включаться в новый цикл транспорта. Таким образом, трансферрин курсирует между внеклеточной жидкостью и эндосомным компартментом, не попадая в лизосомы и поставляя в клетку необходимое для ее роста железо.
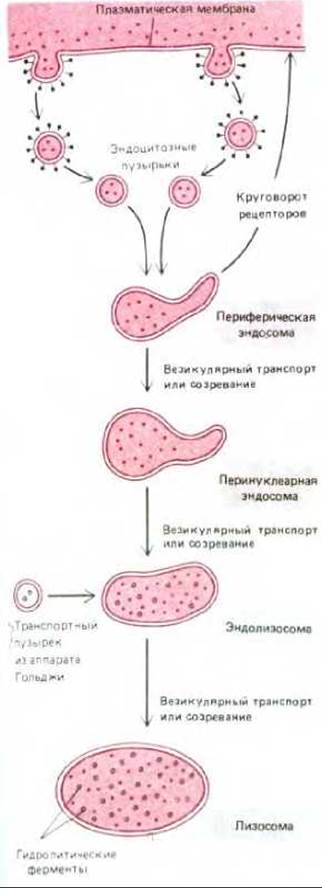
Рис. 6-79. Молекулы, поглощенные в окаймленных ямках, попадают в периферические эндосомы и затем последовательно оказываются в перинуклеарных эндосомах, эндолизосомах и в лизосомах. Однако часть из них может специфически возвращаться обратно из эндосом или эндолизосом. Гидролитические ферменты лизосом первоначально переносятся из аппарата Гольджи в эндосомы. Остается неясным, как поглощенные молекулы, которые не возвращаются обратно, движутся из одного компартмента к другому, оказываясь в конце концов в лизосомах, где они деградируют.
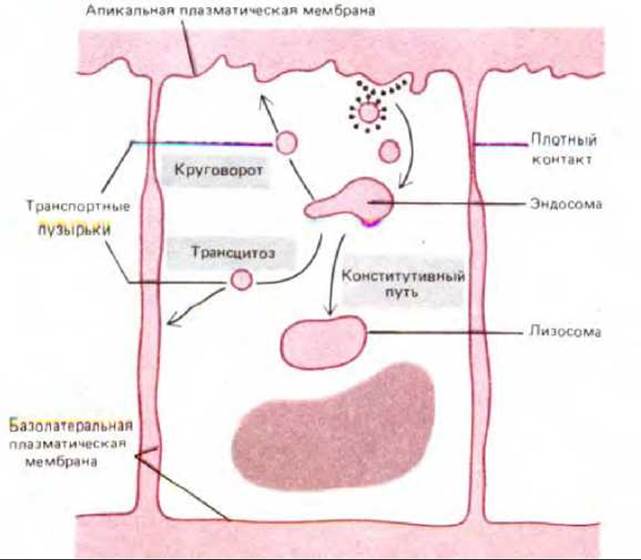
Рис. 6-80. Три пути из эндосомного компартмента в эпителиальных клетках. Большинство молекул, которые не возвращаются обратно из эндосом (или эндолизосом, не показано) в мембрану, идут далее по конститутивному пути из эндосомного компартмента в лизосомы. Возвращенные молекулы попадают либо в ту же область плазматической мембраны, откуда они были поглощены (рециркуляция), либо в другой домен плазматической мембраны (трансцитоз).
В качестве примера рецептора, проходящего второй путь эндоцитоза, можно привести рецептор, связывающий небольшой белок - фактор роста эпидермиса (ФРЭ). Рецепторы ФРЭ несколько необычны, поскольку они накапливаются в окаймленных ямках только после связывания с ФРЭ. По-видимому, необходимы какие-то конформационные изменения рецептора, индуцируемые лигандом, для связывания его в ямках. Более того, ФРЭ диссоциирует из комплекса с рецептором при более низких рН, чем это требуется для диссоциации многих других комплексов лиганд-рецептор. Возможно, по этой причине множество поглощенных рецепторов ФРЭ попадает в лизосомы, где они деградируют вместе с ФРЭ. Таким образом, связывание фактора роста эпидермиса с рецептором приводит к тому, что концентрация рецептора ФРЭ на поверхности клетки уменьшается. В результате этого концентрация сигнального лиганда во внеклеточной жидкости регулирует число комплементарных лиганду рецепторных молекул на поверхности клетки-мишени. Этот механизм регуляции в корне отличается от регуляции ЛНП-рецепторов, число которых зависит от внутриклеточной концентрации холестерола (см. разд. 6.5.8).
6.5.11. Макромолекулы могут переноситься через складки эпителиальных клеток в процессе трансцитоза [47]
Некоторые рецепторы, находящиеся на поверхности поляризованных эпителиальных клеток, переносят специфические макромолекулы из одного внеклеточного пространства в другое в процессе трансцитоза. Эти рецепторы проходят в эндосомном компартменте по третьему пути. Например, новорожденные крысы получают антитела из материнского молока (что помогает им защищаться от инфекции), транспортируя их через эпителий кишечника. Среда в полости кишки слегка кислая, при этом низком рН антитела из молока связываются со специфическими рецепторами, находящимися на апикальной (поглощающей) стороне эпителиальных клеток кишечника, и поглощаются через окаймленные пузырьки. Комплексы рецептор - антитело, попав в эндосому, остаются интактными. Затем транспортные пузырьки сливаются с базолатеральным доменом плазматической мембраны. При этом комплексы оказываются на поверхности мембраны в нейтральном рН внеклеточной жидкости. При таком рН антитела диссоциируют из комплекса с рецепторами и в конце концов попадают в кровяное русло новорожденного. В свою очередь у матери секреция антител в молоко также осуществляется путем трансцитоза, но в обратном направлении - из крови в молоко (см. рис. 18-20).
Разнообразие путей, по которым проходят различные рецепторы из эндосом, подразумевает, что многие из них помимо участков связывания лиганда и окаймленной ямки имеют также сигналы для сортировки. Благодаря этим сигналам рецепторы попадают в подходящие транспортные пузырьки, отщепляющиеся от эндосом и в связи с этим оказываются в нужном месте клеточной мембраны. Природа этих сигналов не выяснена. Поскольку гораздо больше известно о похожем процессе, происходящем в аппарате Гольджи, где транс-сеть сортирует различные белки в различные транспортные пузырьки, мы отложим дальнейшее обсуждение внутриклеточной сортировки молекул и вернемся к этому вопросу в гл. 8.
6-31
6-32
6.5.12. Окаймленные ямки и пузырьки обеспечивают главный путь жидкофазного эндоцитоза во многих клетках [48]
Скорость поглощения собственной плазматической мембраны путем эндоцитоза можно рассчитать, если во внеклеточную жидкость добавить на короткое время какое-либо вещество, за которым можно следить и измерить скорость его поглощения эндоцитозными пузырьками. Для этого используют два типа таких молекул: либо растворенных во внеклеточной жидкости и поглощаемых жидкофазным эндоцитозом (см. рис. 678), либо связывающихся с поверхностными рецепторами и поглощаемых в процессе опосредуемого рецепторами эндоцитоза. Обычно при любом способе измерения скоростей получают одинаковые результаты. Из этого следует, что путь через окаймленные ямки - окаймленные пузырьки является во многих клетках главным не только для опосредуемого рецепторами эндоцитоза, но и для жидкофазного эндоцитоза.
Скорость поглощения плазматической мембраны зависит от типа клеток, но обычно на удивление велика. Макрофаги, например, каждый час поглощают количество жидкости, равное 25% своего объема. Это означает, что каждую минуту они должны поглощать 3% собственной мембраны, или 100% мембраны примерно за полчаса. Скорость эндоцитоза у фибробластов немного ниже, а у некоторых амеб поглощение мембраны происходит намного быстрее. Поскольку на протяжении всего процесса и площадь клетки, и ее объем остаются неизменными, ясно, что эквивалентное количество мембраны должно появляться на поверхности клетки в процессе экзоцитоза.
6-8
6.5.13. Эндоцитозный цикл может иметь отношение к движению клеток и к феномену «кэппинга» [49]
Окаймленные ямки распределены на поверхности клеток более или менее случайным образом, так что поглощение плазматической мембраны (липиды вместе со специфическими белками-рецепторами) имеет место по всей клеточной поверхности. В неполяризованных клетках поглощенные участки мембраны возвращаются также случайным образом на поверхность клетки. Однако в поляризованных клетках, например фибробластах, ползущих по поверхности субстрата, центросома и ассоциированный с ней аппарат Гольджи смещены в направлении передней части клетки, и поглощенные кусочки мембран возвращаются преимущественно в мембрану переднего края клетки. Такая пространственная асимметрия циклического процесса эндоцитоз - экзоцитоза может помогать клетке выдвигать свой передний край вперед во время движения (см. разд. 11.6.6). Более того, поскольку участки эндоцитоза и экзоцитоза в таких клетках не совпадают, будет существовать постоянный ток липидов и рецепторов по плазматической мембране от переднего края клетки в ее заднюю часть (рис. 6-81). Этот мембранный поток может объяснить тот факт, что объекты, типа частичек угля, будучи помещенными на поверхность культуральных фибробластов, перемещаются от передней части клетки к задней при передвижении клетки вперед.

Рис. 6-81. Текучесть плазматической мембраны подвижных клеток как результат асимметрии эндоцитозного цикла в этих клетках. Фибробласт (показан в разрезе) движется слева направо. Эндоцитоз мембраны, содержащей рецепторы, происходит в окаймленных ямках, распределенных по клеточной поверхности случайным образом. Поглощенная мембрана возвращается из эндосомного компартмента (не показан) в виде экзоцитозных пузырьков, сливающихся с мембраной передней (по отношению к движению клетки) оконечности клетки. Таким образом, эндоцитоз по всей поверхности и направленный экзоцитоз вызывают перетекание компонентов мембраны в направлении, обратном движению клетки (показано большими цветными стрелками). (По М. S. Bretscher, Science, 224, 681-686, 1984.)
При связывании мультивалентных лигандов (таких, например, как антитела и лектины) со специфическими белками мембраны образуются кластеры, которые, объединяясь между собой, формируют пятна (пэтчи). Этот процесс называется пэтчингом (от. англ. patching - ставить заплаты). Такие пятна быстро движутся по поверхности клетки (например, лимфоцита), собираясь в так называемый «кэп» или шапочку (рис. 6-82). Процесс образования шапочки, кэппинг, занимает всего лишь несколько минут. Он является АТР-зависимым и завершается (в лимфоцитах) появлением этой необычной структуры в задней части клетки. Интересно, что формировать кэп способны лишь клетки, умеющие ползать по поверхности, хотя для этого процесса никакой необходимости в движении клетки нет. Это наводит на мысль, что механизм кэппинга может иметь сходство с механизмами, используемыми клеткой для движения. Одна из гипотез заключается в том, что мембранный поток, описанный выше и возникающий при циклическом эндоцитозе, переносит большие кластеры связанных молекул в задний конец клетки, тогда как свободные (несшитые между собой) белки достаточно быстро диффундируют, и, следовательно, их распределение остается случайным несмотря на поток. Альтернативная гипотеза состоит в том, что кластеры мембранных белков взаимодействуют (прямо или опосредованно) с движущей системой внутри клеточных актиновых филаментов (находящихся в кортексе, непосредственно под плазматической мембраной), которая перемещает кластеры к заднему концу клетки. До сих пор нет четких результатов, исключающих какую-либо из гипотез.
6.5.14. Специализированные клетки - фагоциты поглощают частицы, связывающиеся со специфическими рецепторами на их поверхности [50]
Фагоцитоз - специальная форма эндоцитоза, при которой поглощаются крупные частицы, например, микроорганизмы или клеточный дебрис. Это происходит через образование больших эндоцитозных пузырьков, называемых фагосомами. У простейших фагоцитоз - это форма питания: крупные частицы захватываются фагосомами и затем попадают в лизосомы. Продукты переваривания проходят через цитозоль и используются в качестве пищи. В многоклеточных организмах большинство клеток не способны эффективно поглощать крупные частицы. Поэтому в кишечнике крупные частицы пищи разрушаются вне клеток перед всасыванием, а вообще в организме фагоцитоз осуществляют «профессиональные» фагоциты. У млекопитающих существуют два класса лейкоцитов, опосредующих фагоцитоз: макрофаги (широко распространенные как в тканях, так и в крови) и нейтрофилы. Эти два типа клеток происходят от общей клетки-предшественника (см. разд. 17.5.8) и защищают нас от инфекции, поглощая вторгшиеся микроорганизмы. Макрофаги играют важную роль также и в утилизации старых или поврежденных клеток и клеточных обломков. В количественном отношении последняя функция особенно важна: в каждом из нас макрофаги ежедневно поглощают посредством фагоцитоза более чем 1011 старых эритроцитов.

Рис. 6-82. Индуцированный антителами пэтчинг и кзппинг поверхностных клеточных белков лимфоцитов. Антитела сшивают между собой молекулы белка, с которыми они связаны, образуя крупные кластеры. Кластеры со временем собираются в одном месте, образуя «шапочку» (кэп) на заднем полюсе клетки. Обратите внимание, что передний полюс определяется положением центросомы, а сшитые между собой белки образуют «шапочку» на противоположном полюсе, даже если клетки находятся в суспензии и не мигрируют.
Эндоцитозные пузырьки, образующиеся из окаймленных ямок, имеют относительно небольшие размеры (~150 нм в диаметре). Фагосомы же имеют диаметр, который определяется размерами поглощаемой частицы. Иногда они почти такого же размера, как и сами фагоцитирующие клетки (рис. 6-83). Фагосомы сливаются с лизосомами и образуют фаголизосомы. Здесь происходит деградация поглощенного материала. Неперевариваемые продукты остаются в фаголизосомах, образуя остаточные тельца. Часть поглощенных компонентов собственной плазматической мембраны, как и при эндоцитозе возвращается обратно в плазматическую мембрану. В некоторых макрофагах пептиды, получившиеся при деградации поглощенных белков, возвращаются на клеточную поверхность связанными с гликопротеинами главного комплекса гистосовместимости (см. разд. 18.6.10). Поверхность этих макрофагов затем тщательно обследуется Т-лимфоцитами иммунной системы. Если пептиды происходят от чужеродного агента - они активируют Т-лимфоциты к иммунному ответу. Таким образом, макрофаги в данном случае выступают как клетки, представляющие антиген (см. разд. 18.6.10).
Для того чтобы фагоцитоз имел место, поглощаемые частицы должны прежде всего связаться с поверхностью фагоцита. Однако не все связавшиеся частицы поглощаются. Существует набор специализированных поверхностных рецепторов, функционально связанных с фагоцитозным аппаратом клетки. В отличие от пиноцитоза, конститутивного процесса, протекающего непрерывно, фагоцитоз - явление индуцируемое, в котором активированные рецепторы передают сигналы внутрь клеток для инициации ответа. Наилучшим образом охарактеризованы в качестве таких индукторов, запускающих фагоцитоз, антитела. Антитела защищают нас от инфекции микроорганизмов, связываясь с их поверхностью и образуя оболочку, в которой Fe-области каждой молекулы антитела экспонированы наружу. Эта оболочка затем узнается специфическими Fc-рецепторами, расположенными на поверхности макрофагов и нейтрофилов. Связывание частиц, имеющих оболочку из антител, с этими рецепторами вызывает образование в плазматической мембране клетки псевдоподий, которые обволакивают частицу и сливаются по краям, образуя фагосомы (рис. 6-84).
О двух других классах рецепторов известно лишь, что они способствуют фагоцитозу. Рецепторы одного из этих классов узнают компоненты комплемента, а другого - олигосахариды на поверхности определенных микроорганизмов. К тому же макрофаги могут узнавать и поглощать старые и разрушенные клетки, но о рецепторах, участвующих в этих процессах, практически ничего неизвестно.
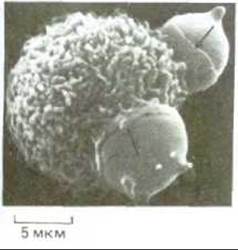
Рис. 6-83. Полученная с помощью сканирующего электронного микроскопа фотография мышиного макрофага, поглощающего посредством фагоцитоза два химически поврежденных эритроцита. Стрелки указывают на края клетки, участвующие в этом тонком процессе (псевдоподии), когда макрофаг как бы натягивается на эритроцит, поглощая его. (С любезного разрешения Jean Paul Revel.)
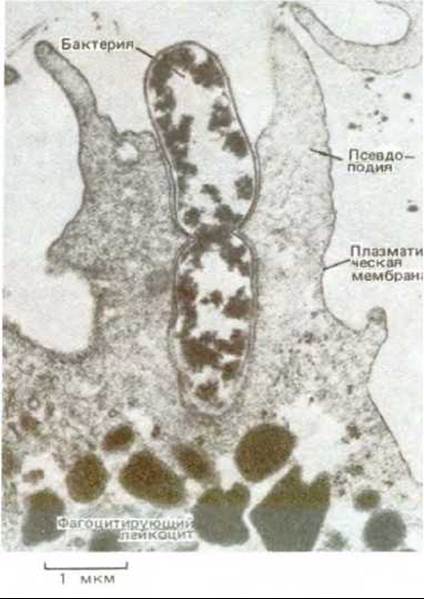
Рис. 6-84. Электронная микрофотография нейтрофила, поглощающего посредством фагоцитоза бактерию, которая находится в процессе деления. (С любезного разрешения Dorothy F. Bainton.)
6.5.15. Фагоцитоз - это локальная ответная реакция, осуществляющаяся путем «застегивания» мембраны по принципу застежки-молнии [51]
Эритроциты можно обработать таким образом, что они будут связываться на поверхности макрофагов, но не подвергнутся фагоцитозу. Если адсорбировавшим их макрофагам предоставить затем возможность осуществить фагоцитоз бактерий, окруженных антителами, то будут поглощаться лишь бактерии, а эритроциты, даже расположенные в непосредственной близости от места активного фагоцитоза, не будут захватываться. Это говорит о том, что фагоцитоз, как и индуцируемый экзоцитоз тучных клеток (см. разд. 6.5.2), представляет собой локальную ответную реакцию участка плазматической мембраны и лежащих под ней цитоплазматических структур.
Если макрофаг связывается с клетками-мишенями, равномерно покрытыми антителами, он поглощает такие клетки. Однако если молекулы антител сосредоточены в результате кэппинга на одном полюсе клетки (см. разд. 6.5.13), то плазматическая мембрана макрофага сближается с поверхностью клетки-мишени только на участке кэпа, и фагоцитоз не происходит (рис. 6-85). Отсюда следует, что первоначального взаимодействия покрытых антителами клеток с Fe-рецепторами, расположенными на поверхности макрофага, недостаточно для того, чтобы вызвать поглощение этих клеток. Связывание клетки-мишени с макрофагом лишь индуцирует постепенно распространяющийся процесс соединения мембран, для осуществления которого требуется непрерывный контакт рецепторов с антителами: только при этом условии поглощаемая клетка оказывается полностью окруженной фагосомой. Это свидетельствует о том, что фагоцитоз происходит путем «застегивания» мембраны с помощью механизма, действующего наподобие застежки-молнии.
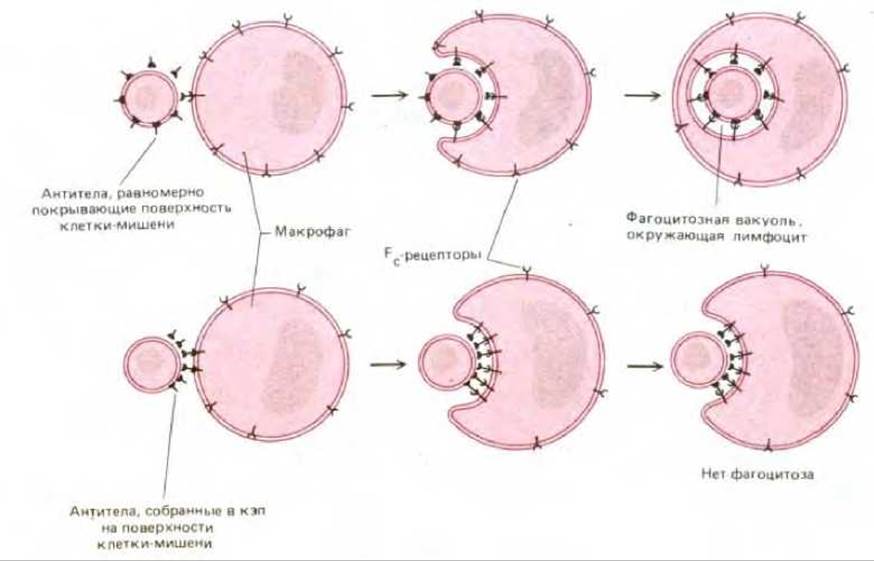
Рис. 6-85. Схема эксперимента, свидетельствующего о том, что фагоцитоз осуществляется путем «застегивания» мембран по принципу застежки-молнии. (По Е. М. Griffin et al., J. Exp. Med., 144, 788-809, 1976.)
Ни механизм инициации поглощения при связывании антител с Fc-рецепторами, ни природа движущих сил, увеличивающих размеры псевдоподий, неизвестны. Однако псевдоподии накапливают актин и актин-связывающие белки, а цитохолазин (препарат, препятствующий полимеризации актина) ингибирует фагоцитоз. Это наводит на мысль об актин-зависимости механизма увеличения размеров псевдоподий. Поскольку на цитоплазматической поверхности фагосом, образующихся в макрофагах, иногда присутствует клатрин, вполне вероятно, что он играет определенную роль не только в пиноцитозе, но и в фагоцитозе. Эти две формы эндоцитоза, однако, четко различаются, поскольку цитохолазин не ингибирует пиноцитоз.
Каким образом псевдоподии, захватившие частицы, сливаются по краям, образуя фагосому? Этот вопрос опять возвращает нас к фундаментальным проблемам, которых мы кратко касались вначале нашего рассмотрения экзоцитоза и эндоцитоза.
6.5.16. Слияние мембран при экзоцитозе и эндоцитозе, вероятно, катализируется специальными белками слияния [52]
Слипание бислоев и объединение бислоев представляют собой последовательные этапы слияния мембран. Это фундаментальные клеточно-мембранные процессы, происходящие не только при экзоцитозе и эндоцитозе, но также и при делении или слиянии клеток (рис. 6-86). Ни в одном из этих случаев механизм слияния мембран пока не понят, однако несколько интересных выводов можно сделать из анализа слияния некоторых вирусов, обладающих мембранной оболочкой, с клетками при инфекции. Клеточные мембраны никогда не сливаются самопроизвольно. Для того чтобы мембраны слились, необходимо, чтобы молекулы воды были вытеснены взаимодействующими липидными бислоями, которые бы сблизились до расстояния 1,5 нм между собой. Процесс этот энергетически очень невыгоден. Поэтому весьма вероятно, что слияние всех мембран в клетках катализируется специальными белками слияния. Пока такие клеточные белки непосредственно не идентифицированы, однако известно, что у вирусов белки слияния играют ключевую роль в проникновении мембраносодержащих вирусов (т. е. имеющих мембранную оболочку на основе липидного бислоя) внутрь инфицируемой ими клетки (см. разд. 8.9.5). Такие вирусы, как вирус гриппа, например, проникают в клетку путем опосредуемого рецепторами экзоцитоза и попадают в эндосомы. При низком рН в эндосоме активируется белок слияния (фузоген), находящийся в оболочке вируса. Он катализирует слияние вирусной мембраны с мембраной эндосомы. При этом вирусная нуклеиновая кислота высвобождается в цитозоль (рис. 6-87).
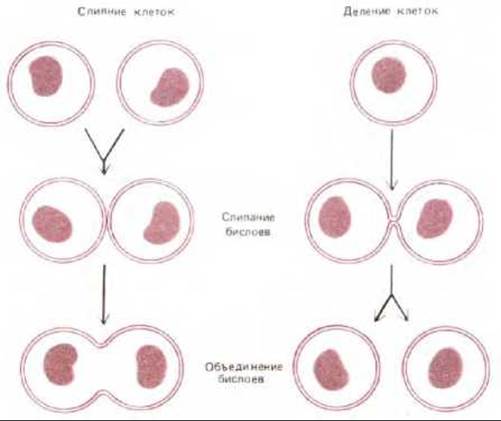
Рис. 6-86. Слияние мембран (включает два этапа: слипание бислоев и их объединение), происходящее при делении и слиянии клеток. В природе слияние клеток наблюдается в процессе оплодотворения (слияние сперматозоида с яйцеклеткой), а также при образовании многоядерных клеток скелетных мышц (слияние миобластов).
Гены, кодирующие несколько вирусных белков слияния, были клонированы и затем использованы для трансфекции эукариотических клеток в культуре. Трансфицированные клетки экспрессировали вирусные белки на поверхности мембраны. При кратковременной инкубации при низких рН эти клетки сливались между собой, образуя гигантскую многоядерную клетку. Для наиболее изученного белка слияния из вируса гриппа была определена трехмерная структура методом рентгеноструктурного анализа (см. разд. 8.6.12). Было показано, что при низком рН в белке слияния индуцируются крупные конформационные изменения, приводящие к экспонированию предварительно спрятанной гидрофобной области на поверхность белка. При этом становятся возможными его взаимодействия с липидным бислоем мембраны-мишени. По-видимому, кластер таких гидрофобных областей, расположенных в близком соседстве друг с другом в молекуле белка слияния, приводит два липидных бислоя в тесное соприкосновение и дестабилизирует их так, что бислои сливаются (рис. 6-87).
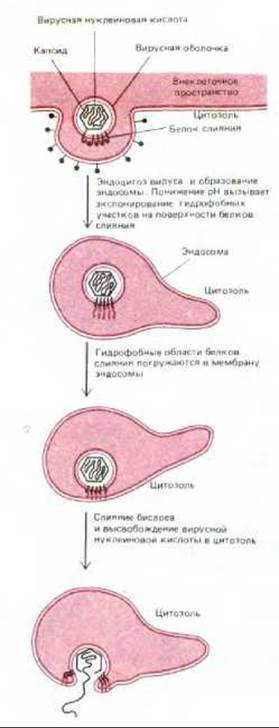
Рис. 6-87. Схема, показывающая, как белки слияния, имеющиеся на поверхности многих вирусов с мембранной оболочкой, катализируют слияние вирусной и эндосомной мембран. Вирусы проникают в клетку путем опосредуемого рецепторами эндоцитоза и попадают в эндосомы; низкий рН внутри эндосом активирует белок, катализирующий слияние мембран. Это позволяет вирусному капсиду высвободиться в цитозоль, где нуклеиновая кислота вируса может реплицироваться.
Заключение
Большинство клеток секретируют и поглощают макромолекулы в процессе соответственно экзоцитоза и эндоцитоза. При экзоцитозе содержимое транспортных или секреторных пузырьков высвобождается во внеклеточное пространство, когда они сливаются с плазматической мембраной. При эндоцитозе процесс идет в обратной последовательности: локальные участки плазматической мембраны впячиваются и замыкаются, образуя эндоцитозный пузырек. Большинство частиц, поглощенных при эндоцитозе, попадает затем в лизосомы, где они подвергаются деградации. Как экзоцитоз, так и эндоцитоз бывают конститутивными и индуцируемыми в ответ на внеклеточные сигналы.
Большинство клеток непрерывно осуществляет эндоцитоз фрагментов своей плазматической мембраны и затем возвращает их обратно на клеточную поверхность в цикле эндоцитоза-экзоцитоза, опосредуемого в основном клатрин-окаймленными ямками и пузырьками. Многие поверхностные рецепторы, связывающие специфические внеклеточные макромолекулы, локализуются в клатриновых окаймленных ямках и как следствие поглощаются в составе окаймленных пузырьков. Этот процесс называется опосредуемым рецепторами эндоцитозом. Окаймленные эндоцитозные пузырьки быстро теряют свою клатриновую оболочку и сливаются с эндосомами, где происходит сортировка рецепторов и лигандов. Большинство лигандов отделяется от рецепторов внутри эндосомы и, в конечном итоге, попадает в лизосомы. А большая часть рецепторов возвращается через транспортные пузырьки обратно на клеточную поверхность для повторного использования. Известны комплексы рецептор - лиганд, которые проходят по другому пути из эндосомного компартмента. Иногда и рецептор, и лиганд попадают в лизосому и деградируют. В некоторых случаях рецептор и лиганд переносятся сквозь клетку, и лиганд высвобождается на другой поверхности клетки путем экзоцитоза. Этот процесс называется трансцитозом.
Литература
Общая
Bretscher M. S. The molecules of the cell membrane. .Sci. Am., 253(4), 100-109, 1985.
Datta D. B. A Comprehensive Introduction to Membrane Biochemistry. Madison. Floral., 1987.
Finean J. B. R., Coleman R., Michell R. H. Membranes and Their Cellular Functions, 3rd rd. Oxford, Blackwell, 1984.
Singer S. J., Nicolson G. I. The fluid mosaic model of the structure of cell membranes. Science, 175, 720-731, 1972.
Veagle P. The Membranes of Cells. Orlando, Academic, 1987.
Цитируемая
1. Branton D. Fracture faces of frozen membranes. Proc. Natl. Acad. Sci. USA, 55, 1048-1056, 1966.
Ceve G., Marsh D. Phospholipid Bilayers: Physical Principles and Models. New York., Wiley, 1987.
Gorter E., Grendel F. On bimolecular layers of lipoids on the chromocytes of the blood. J. Exp. Med., 41, 439-443, 1925.
2. Hawthorne J. N., Ansell G. B. Phospholipids. New Comprehensive Biochemistry, Vol. 4. Amsterdam, Elsevier, 1982.
Storch J., Kleinfeld A. M. The lipid structure of biological membranes. Trends Biochem. Sci., 10., 418-421, 1982.
3. Bangham A. D. Models of cell membranes. In: Cell Membranes: Biochemistry, Cell Biology and Pathology (G. Weissmann, R. Claiborne eds.), pp. 24-34. New York. Hospital Practice, 1975.
Edidin M. Rotational and lateral diffusion of membrane proteins and lipids: phenomena and function. Curr. Top. Memb. Transp., 29, 91-127, 1987.
Kornberg R. D., McConnell H. M. Lateral diffusion of phospholipids in a vesicle membrane. Proc. Natl. Acad. Sci. USA, 68, 2564-2568, 1971.
4. Chapman D. Lipid dynamics in cell membranes. In: Cell Membranes: Biochemistry, Cell Biology and Pathology (G. Weissmann, R. Claiborne eds.), pp. 13-22. New York, Hospical Practice, 1975.
Chapman D., Benga G. Biomembrane fluidity - studies of model and natural membranes. In: Biological Membranes (D. Chapman ed.), Vol. 5, pp. 1-56. London, Academic, 1984.
Kates M., Manson L. A. eds. Membrane Fluidity. Biomembranes, Vol 12. New York, Plenum, 1984.
Kimelberg H. K. The influence of membrane fluidity on the activity of membrane-bound enzymes. In: Dynamic Aspects of Cell Surface Organization. Cell Surface Reviews (G. Poste, G. L. Nicolson eds.), Vol. 3, pp. 205-293. Amsterdam. Elsevier,
5. Carruthers A., MelchiorD. I. How bilayer lipids affect membrane protein activity. Trends Biochem. Sci., 11, 331-335, 1986. de Kruiff B. et al. Lipid polymorphism and membrane function. In: The Enzymes of Biological Membranes, Vol. 1, Membrane Structure and Dynamics, 2nd ed. (A.N. Martonosi ed.), pp. 131-204. New York, Plenum, 1985.
Kleinfeld A. Current views of membrane structure. Curr. Top. Memb. Transp., 29, 1-27, 1987.
6. Bretscher M. Membrane structure: some general principles. Science, 181, 622-629, 1973.
Rothman J., Lenard J. Membrane asymmetry. Science, 195, 743-753, 1977.
7. Hakomori S. Glycosphingolipids. Sci. Am., 254(5), 44-53, 1986.
Weigandt H. The gangliosides. Adv. Neurochem., 4, 149-223, 1982.
8. Eisenberg D. Three-dimensional structure of membrane and surface proteins. Anna Rev. Biochem., 53, 595-623, 1984.
Engelman D. M., Steitz T. A., Goldman A. Identifuing nonpolar transbilayer helices in amino acid sequences of membrane proteins. Annu. Rev. Biophys. Biophys. Chem., 15, 321-353, 1986.
Henderson R. The structure of bacteriorhodopsin and its relevance to other membrane proteins. In: Membrane Transduction Mechanisms (R. A. Cone, J.E. Dowling eds.), pp. 3-15. New York, Raven, 1979.
Sefton B. M., Buss J. E. The covalent modification of eukaryotic proteins with lipid. J. Cell Biol, 104, 1449-1453, 1987.
Unwin N., Henderson R. The structure of proteins in biological membranes. Sci. Am., 250(2), 78-94, 1984.
9. Helenius A., Simons K. Solubilization of membranes by detergents. Biocim. Biophys. Acta, 415, 29-79, 1975.
Montal M. Functional reconstruction of membrane proteins in planar lipid bilayer membranes. In: Techniques of the Analysis of Membrane Proteins (C. J. Regan, R.J. Cherry eds.), pp. 97-128. London. Chapman and Hall, 1986.
Racker E. Reconstruction of Transporters, Receptors and Pathological States. Orlando, Academic, 1985.
10. Bretscher M. Membrane structure: some general principles. Science, 181, 622-629, 1973.
Steck T. L. The organization of proteins in the human red blood cell membrane. J. Cell Biol., 62, 1-19, 1974.
11. Bennet V. The membrane skeleton of human erythrocytes and its implications for more complex cells. Annu. Rev. Biochem., 54, 273-304, 1985.
Branton D., Cohen C.M., Tyler J. Interaction of cytoskeletal proteins on the human erythrocyte membrane. Cell, 24, 24-32, 1981.
Byers T. J., Branton D. Visualization of the protein associations in the erythrocyte membrane skeleton. Proc. Natl. Acad. Sci. USA, 82, 61536157, 1985.
Marchesi V. T. Stabilizing infrastructure of cell membranes. Annu. Rev. Cell Biol., 1, 531-561, 1985.
Shen B. W., Josephs R., Steck T. L. Ultrastructure of the intact skeleton of the human erythrocyte membrane. J. Cell Biol., 102, 997-1006, 1986.
12. Marchesi V. Т., Furthmayr H., Tomita M. The red cell membrane. Annu. Rev. Biochem., 45, 667-698, 1976.
13. Jay D., Cantley L. Structural aspects of the red cell anion exchange protein. Annu. Rev. Biochem., 55, 511-538, 1986.
Kopito R. R., Lodish H. F. Primary structure and transmembrane orientation of the murine anion exchange protein. Nature, 316, 234-238, 1985.
14. Henderson R., Unwin P. N. T. Three-dimensional model of purple membrane obtained by electron microscopy. Nature, 257, 28-32, 1975.
Stoeckenius W., Bogomolni R. A. Bacteriorhodopsin and related pigments of Halobacteria. Annu. Rev. Biochem., 51, 587-616, 1982.
15. Deisenhofer J., Epp. O., Miki K., Huber R., Michel H. The structure of the protein subunits in the photosynthetic reaction centre of Rhodopseudomonas viridis at 3 A resolution. Nature, 318, 618-624, 1985.
16. de Petris S., Rqff M.C. Normal distribution patching and capping of lymphocyte surface immunoglobulin studied by electron microscopy. Nature New Biol., 241, 257-259, 1973.
Edidin M. Rotational and lateral diffusion of membrane proteins and lipids: phenomena and function. Curr. Top. Memb. Transp., 29, 91-127, 1987.
Frye L. D., Edidin M. The rapid intermixing of cell surface antigens after formation of mouse-human heterokaryons. J. Cell Sci., 7, 319-335, 1970.
MvCloskey M., Poo M.-M. Protein diffusion in cell membranes: some biological implications. Int. Rev. Cytpl., 87, 19-81, 1984.
Poo M., Cone R.A. Lateral diffusion of rhodopsin in the photoreceptor membrane. Nature, 247, 438-441, 1974.
Wier M., Edidin M. Constraint of the translational diffusion of a membrane glycoprotein by its' external domains. Science, 242, 412-414, 1988.
17. Gumbiner В., Louvard D. Localized barriers in the plasma membrane: a common way to form domains. Trends Biochem. Sci., 10, 435-438, 1985.
Myles D. G., Primakoff P. Sperm surface domains. In: Hybridoma Technology in the Biosciences and Medicine. (T. A. Springer ed.), pp. 239250. New York, Plenum, 1985.
Simons K., Fuller S. D. Cell Surface Polarity in Epithelia. Annu. Rev. Cell Biol., 1, 243-288, 1985.
18. Hirano H., Parkhouse В., Nicolson G.L., Lennox E.S., Singer SJ. Distribution of saccharide residues on membrane fragments from a myeloma cell homogenate: its implications for membrane biogenesis. Proc. Natl. Acad Sci. USA, 69, 2945-2949,1972.
Kornfeld R., Kornfeld S. Structure of glycoproteins and their oligosaccharide units. In: The Biochemistry of Glycoproteins and Proteoglycans (W.J. Lennarz ed.), pp. 1-84. New York, Plenum, 1980.
Lis H., Sharon N. Lectins as molecules and tools. Annu. Rev. Biochem., 55, 35-67, 1986.
Olden K., Bernard B. A., Humphries M. J., Yeo T.-K., Yeo K.T., White S.L., Newton S. A., Bauer H. C., Parent J. B. Function of glycoprotein glycans. Trends Biochem. Sci., 10, 78-82, 1985.
19. Hille B. Ionic Channels of Excitable Membranes, Sunderland, MA, Sinauer, 1984.
Martonosi A. N. ed. The Enzymes of Biological Membranes, Vol. 3, Membrane Transport, 2nd ed. New York, Plenum, 1985.
West I. S. The Biochemistry of Membrane Transport. London, Chapman and Hall, 1983.
Stein W.D. Transport and Diffusion Across Cell Membranes Orlando, Academic, 1986.
20. Andersen 0. S. Permeability properties of unmodified lipid bilayer membranes. In: Membrane Transport in Biology. Vol. 1 (G. Giebisch, D. C.
Tosteson, H. H. Ussing eds.), pp. 369-446. New York, Springer-Verlag, 1978.
Finkelstein A. Water movement through membrane channels. Curr. Top. Memb. Trans., 21, 295-308, 1984.
Walter A., Gutknecht J. Permeability of small nonelectrolytes through lipid bilayer membranes. J. Membr. Biol., 90, 207-217, 1986.
21. Hobbs A.S., Alberts R. W. The structure of proteins involved in active membrane transport. Annu. Biophys. Bioeng., 9, 259-291, 1980.
Kyte J. Molecular considerations relevant to the mechanism of active transport. Nature, 292, 201-204, 1981.
Stein W. D. ed. Ion pumps: Structure, function and regulation. New York, Alan Liss, 1988.
Tanford C. Mechanism of the energy coupling in active transport. Annu. Rev. Biochem., 52, 379-409, 1983.
Wilson D.B. Cellular transport mechanisms. Annu. Rev. Biochem., 47, 933-965, 1978.
22. Cantley L. C. Structure and mechanisms of the (Na, K) ATPase. Curr. Topics Bioenerget., 11, 201-237, 1981.
Glynn I. M., Ellory C. eds. The Sodium Pump. Cambridge, U. K. The Company of Biologists, 1985.
Shull G. E., Schwartz A., Lingrel J. B. Amino acid sequence of the catalytic subunit of the (Na+-K+) ATPase deduced from a complementary DNA. Nature, 316, 691-695, 1985.
23. Swecdner K. J., Goldin S. M. Active transport of sodium and potassium ions: mechanism, function and regulation. N. Engl. J. Med., 302, 777783, 1980.
Glynn I.M. The Na+-K+ transporting adenosine triphosphatase. In: The Enzymes of Biological Membranes, 2nd ed. (A. Martonosi ed.), Vol. 3, pp. 34-114. New York, Plenum, 1985.
24. Hassebach W., Oetliker H. Energetics and electrogenicity of the sarcoplasmic retiulum calcium pump. Annu. Rev. Physiol., 45, 325-339,
1983.
MacLennan D. H., Brandl C. J., Korezak В., Green N. M. Amino acid sequence of a Ca2+, Mg2+-dependent ATPase from rabbit muscle sarcoplasmic reticulum, deduced from its complementary DNA sequence. Nature, 316, 696-700, 1985.
Schatzman H.J. The red cell calcium pump. Annu. Rev. Physiol., 45, 303-312, 1983.
25. Hinkle P.C., McCarty R.E. How cell make ATP. Sci. Am., 238(3), 104-123, 1978.
Nicholls D. G. An Introduction to the Chemiosmotic Theory, 2nd ed. New York, Academic, 1987.
26. Scott D. M. Sodium cotransport systems: cellular, molecular and regulatory aspects. Bioessays, 7, 71-78, 1987.
Wright J. K., Seckler R., Overath P. Molecular aspects of sugar: ion transport. Annu. Rev. Biochem., 55, 225-248, 1986.
27. Grinstein S., Rotnstein A. Mechanisms of regulation of the Na+/H+ exchanger. J. Membrane Biol., 90, 1-12, 1986.
Olsnes S., Tonnessen T. I., Sandvig K. pH-regulation anion antiport in nucleated mammalian cells. J. Cell Biol., 102, 967-971, 1986. Pouyssegur J., Franchi A., Kohno M., LAllemain G., Paris S. Na+-H+ exchange and growth control in fibroblasts: a genetic approach. Curr. Top. Memb. Transp., 26, 201-220, 1986.
Rozengunt E., Mendoza S. Early stimulation of Na+-H+ antiport, Na+-K+ pump activity and Ca2+ fluxes in fibroblast mitogenesis. Curr. Top. Membr. Transp., 27, 163-191, 1986.
28. Aimers W., Stirling C. Distribution of transport proteins over animal cell membranes. J. Membrane Biol. 77, 169-186, 1984.
Semenza G. Anchoring and biosynthesis of stalked brush border membrane proteins: Glycosidases and peptidases of Enterocytes and renal tubuli. Annu. Rev. Cell Biol., 2, 255-313, 1986.
29. Postma P. W., Longeler J. W. Phosphoenolpyruvate: carbohydrate phosphotransferase system of bacteria. Microbiol. Rev., 49, 232-269, 1985.
30. Ames G. F. L. Bacterial periplasmic transport systems: structure, mechanism and evolution. Annu. Rev. Biochem., 55, 397-425, 1986.
31. Hille B. Ionic Channels of Excitable Membranes, Sunderland, MA, Sinauer, 1984.
32. Baker P. F., Hodgkin A. L., Shaw T. L. The effects of changes in internal ionic concentration on the electrical properties of perfused giant axons. J. Physiol., 164, 355-374, 1962.
Hodgkin A. L., Keynes R. D. Active transport of cations in giant axons from Sepia and Loligo. J. Physiol., 128, 26-60, 1955.
Kuffler S.W., Nicholls J. G., Martin A. R. From Neuron to Brain, pp. 111-125, Sunderland MA, Sinauer, 1984.
33. Hodgkin A. L., Huxley A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. J. Physiol., 117, 500-544, 1952. Kuffler S.W., Nicholls J. G., Martin A. R. From Neuron to Brain, pp. 125-152. Sunderland MA, Sinauer, 1984.
34. Catterall W.A. Molecular properties of voltage-sensitive sodium channels. Annu. Rev. Biochem., 55, 953-985, 1986.
Noda M. et al. Primary structure of Electrophorus electricus sodium channel deduced from cDNA sequence. Nature, 312, 121-127, 1984. Sigworth F. J., Neher E. Single Na+ channel currents observed in cultured rat muscle cells. Nature, 287, 447-449, 1980.
Stevens C.F. Biophysical studies of ion channels. Science, 225, 1346-1350, 1984.
Tanabe T. et al. Primary structure of the receptor for calcium channel blockers from skeletal muscle. Nature, 328, 313-318, 1987.
35. Grenningloh G. et al. The strychnine-binding subunit of the glycine receptor shows homology with nicotinic acetylcholine receptors. Nature, 328, 215-220, 1987.
Guy H. R., Hucho F. The ion channel of the nicotinic acetylcholine receptor Trends Neurosci., 10, 318-321, 1987.
Hille B. Ionic Channels of Excitable Membranes, pp. 117-138 and 335-360. Sunderland MA, Sinauer, 1984.
Noda M. et al. Structural homology of Torpedo californica acetylcholine receptor subunits. Nature, 302, 528-532, 1983.
Schoefield P. R. et al. Sequence and functional expression of the GABAa receptor shows a ligand-gated receptor super family. Nature, 328, 221-227, 1987.
36. Stevens C. F. The neuron. Sci. Am., 241(3), 54-65, 1979.
37. Gomperts B. D. The Plasma Membrane: Models for Its Structure and Function, pp. 109-212. New York, Academic Press, 1976.
PressmanB. C. Biological applications of ionophores. Annu. Rev. Biocem., 45, 501-530, 1976.
38. Burgess T. L., Kelly R. B. Constitutive and regulated secretion of proteins. Annu. Rev. Cell Biol., 3, 243-294, 1987.
39. Lawson D., Fewtrell C., Raff M. Localized mast cell degranulation induced by cpncanavalin A-sepharose beads: implications for the Ca2+ hypothesis of simulus-secretion coupling. J. Cell Biol., 79, 394-400, 1978.
40. Steinman R. M., Mellman I. S., Mutter W. A., Cohn Z. Endocytosis and recycling of plasma membrane. J. Cell Biol., 96, 1-27, 1983.
41. Goldstein J.L., Anderson R.G.W., Brown M.S. Coated pits, coated vesicles, and receptor-mediated endocytosis. Nature, 279, 679-685, 1979.
Roth Т. F., Porter К. R. Volk protein uptake in the oocyte of the mosquito, Aedes aegypti. L. J. Cell Biol., 30, 313-332, 1964.
42. Pearse B. M. F., Bretscher M. S. Membrane recycling by coated vesicles. Annu. Rev. Biochem., 50, 85-101, 1981.
Pearse B.M.F., Growther R.A. Structure and assembly of coated vesicles. Ann. Rev. Biophys. Biophys. Chem., 16, 49-68, 1987.
Schmid S. L., Rothman J. E. Enzymatic dissociation of clathrin in a two-stage process. J. Biol., 260, 10044-10049, 1985.
43. Orci L., Click B. S., Rothman J. E. A new type of coated vesicular carrier that appears not to contain clathrin: its possible role in protein transport within the Golgi stack. Cell, 46, 171-184, 1986.
Simionescu N., Simionescu M., Palade G.E. Premeability of muscle capillaries to small heme-peptides: evidence for the existence of patent transendothelial channels. J. Cell Biol., 64, 586-607, 1975.
44. Brown M. S., Goldstein J. L. How LDL receptors influence cholesterol and atherosclerosis. Sci., Am., 251(5), 58-66, 1984.
Brown M. S., Goldstein J. L. A receptor-mediated pathway for cholesterol homeostasis. Science, 232, 34-48, 1986.
45. Brown W.J., Goodhouse J., Farquhar M,G. Mannose-6-phosphate receptors for lysosomal enzymes cycle between the Golgi complex and endosomes. J. Cell Biol., 103, 1235-1247, 1986.
Griffiths G., Hoflack В., Simons K., Mellman I., Kornfleld S. The mannose-6-phosphate receptor and the biogenesis of lysosomes. Cell, 52, 329-341, 1988.
Helenius A., Mellman I., Wall D., Hubbard A. Endosomes. Trends Biochem. Sci., 8, 245-250, 1983.
Mellman L, Howe C., Helenius A. The control of membrane traffic on the endocytis pathway. Curr. Top. Memb. Transp., 29, 255-288, 1987.
46. Carpenter G. Receptors for epidermal growth factor and other polypeptide mitogens. Annu. Rev. Biochem., 56, 881-914, 1987.
Dautry-Varsat A., Ciechanover A., Lodish H.F. pH and the recycling of transferrin during receptor-mediated endocytosis. Proc. Natl. Acad. Sci. USA, 80, 2258-2262, 1983.
Goldstein J.L., Brown M.S., Anderson R.G. W., Russell D. W., Schneider WJ. Receptor-mediated endocytosis. Annu. Rev. Cell Biol., 1, 1-39, 1985.
Mellman L, Fuchs R., Helenius A. Acidification of the endocytic and exocytic pathways. Annu. Rev. Biochem., 55, 663-700, 1986.
47. Mostov K.E., Simister N.E. Transcytosis. Cell, 43, 389-390, 1985.
Rodewald R., Abrahamsom D. R. Receptor-mediated transport of IgG across the intestinal epithelium of the neonatal rat. In: Membrane Recycling (Ciba Foundation Symposium 92), pp. 209-232. London, Pitman, 1982.
48. Helenius A., Marsh M. Endocytosis of enveloped animal viruses. In: Membrane Recycling (Cida, Foundation Symposium 92), pp. 59-76. London, Pitman, 1982.
Thilo I. Quantification of endocytosis-derived membrane traffic. Biochim. Biophys. Acta, 822, 243-266, 1985.
49. Abercrombie M., Haysman J. E. M., Pegrum S. M. The locomotion of fibroblasts in culture. III. Movements of particles on the dorsal surface of the leading lamella. Exp. Cell Res., 62, 389-398, 1970.
Bretscher M. S. Endocytosis: relation to capping and cell locomotion. Science, 224, 681-686, 1984.
Taylor R.B., Duffus W.P.H., Raff M. C., de Petris S. Redistribution and pinocytosis of limphocyte surface immunoglobulin molecules induced by anti-immunoglobulin intobody. Nature New Biol., 233, 225-229, 1971.
50. Wright S. D., Silverstein S. C. Overview: the function of receptors in phagocytosis. In: Handbook of Experimental Immunology, 4th ed. (D. M. Weir, L. Herzenberg eds.), pp. 41-1-41-14. Oxford UK, Blackwell, 1983.
51. Aggeler J., Werb Z. Initial events during phagocytosis by macrophages viewed from outside and inside the cell: Membrane-particle interaction and clathrin. J. Cell Biol., 94, 613-623, 1982.
Griffin F. M., Jr., Griffin J. A., Silverstein S. C. Studies on the mechanism of phagocytosis. II. The interaction of macrophages with antiimmunoglobulin IgG-coated bone marrow-derived lymphocytes. J. Exp. Med., 144, 788-809, 1976.
Griffin F. M., Jr., Silverstein S. C. Segmental response of the macrophage plasma membrane to a phagocytic stimulus. J. Exp. Med., 139, 323336, 1974.
52. Blumenthal R. Membrane Fusion. Curr. Top. Memb. Transp., 29, 203-254, 1987.
Gething M. J., Doms R., York D., White J. Studies on the mechanism of membrane fusion: site-specific mutagenesis of the hemagglutinin of influenza virus. J. Cell Biol., 102, 11-23, 1986.
White J., Kielian M., Helenius A. Membrane fusion proteins of enveloped animal viruses. Quart. Rev. Biophys., 16, 151-195, 1983.
Wiley D. C., Skehel J. J. The structure and function of the hemagglutinin membrane glycoprotein of influenza virus. Annu. Rev. Biochem., 56, 365-394, 1987.