Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Внутриклеточная сортировка макромолекул и сохранение клеточных компартментов
Цитозоль
Цитозоль - это часть цитоплазмы, занимающая пространство между мембранными органеллами. Обычно на него приходится около половины общего объема клетки (см. табл. 8-1). В состав цитозоля входит множество ферментов промежуточного обмена, кроме того, он заполнен рибосомами, синтезирующими белки. Около половины всех белков, образующихся на рибосомах, остаются в цитозоле в качестве его постоянных компонентов. В данном разделе мы обсудим судьбу этих белков, а также некоторые механизмы, позволяющие контролировать их время жизни и направлять белки в определенные места цитозоля.
8.2.1. Организация цитозоля поддерживается белковыми филамептами [8]
Цитозоль содержит множество белковых филаментов, собранных в фибриллярный цитоскелет (гл. 11). Именно цитоскелет определяет форму клетки, обеспечивает движение цитоплазмы и образует общую сеть, которая организует ферментативные реакции. Более того, поскольку белки составляют около 20% массы цитозоля, правильнее будет представлять его себе как высокоорганизованный гель, а не как раствор ферментов. Исследования скорости диффузии, однако, показывают, что малые молекулы и некоторые небольшие белки диффундируют в цитозоле почти с той же скоростью, что и в дистиллированной воде. Таким образом, с точки зрения промежуточного обмена (где и субстраты, и продукты являются малыми молекулами) мы можем рассматривать цитозоль как простой раствор.
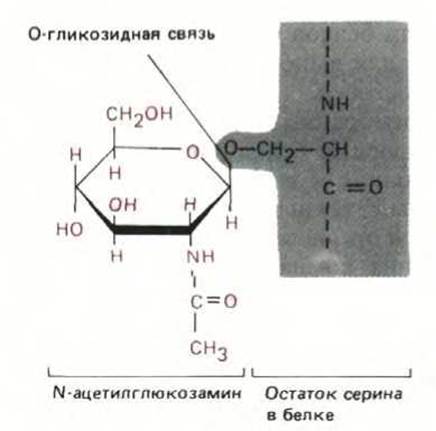
Рис. 8-14. Единственной известной формой гликозилирования, протекающего в цитозоле клеток млекопитающих, является присоединение N-ацетилглюкозамина к остаткам серина или треонина в белке. Таким способом модифицируются белки-регуляторы многих генов и некоторые белки ядерных пор; назначение этой модификации неизвестно. В ЭР и аппарате Гольджи происходит гораздо более сложное гликозилирование (см. рис. 8-52).
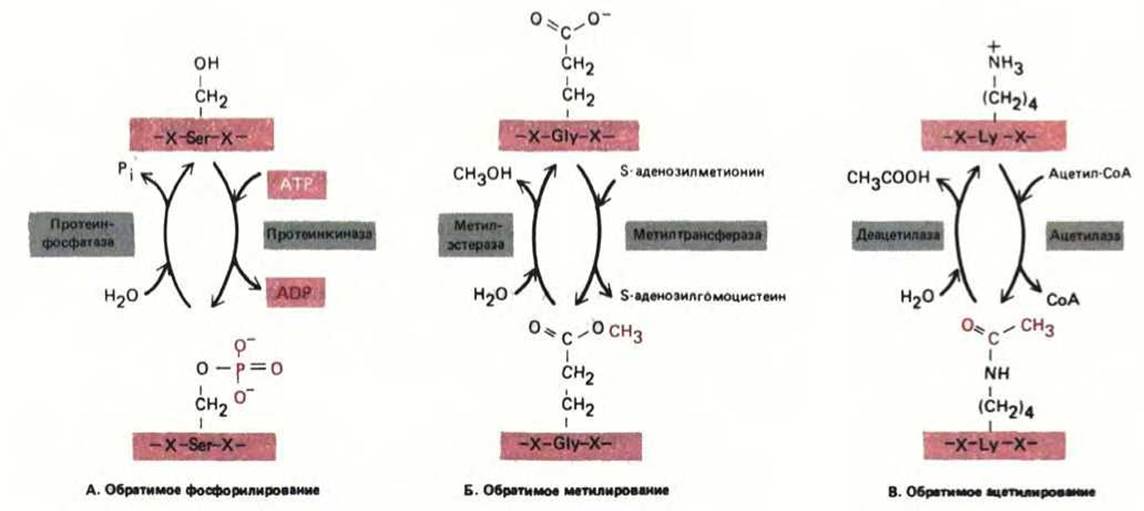
Рис. 8-15. Три типа обратимых ковалентных модификаций, которым подвергаются белки и которые влияют на их активность. Каждая изображенная модификация изменяет заряд боковой цепи аминокислоты. Наиболее распространенная модификация - это фосфорилирование ОН-групп боковых цепей серина, треонина и тирозина в белке. По существующим оценкам, в животных клетках этим способом модифицировано около 10% белков цитозоля.
С другой стороны, известно, что большие частицы, такие, как транспортные пузырьки и органеллы, движутся очень медленно, отчасти потому, что часто сталкиваются с компонентами цитоскелета. Чтобы они передвигались с приемлемой скоростью, специальные белковые «моторы» гидролизуют АТР и используют освобождающуюся при этом энергию для переноса крупных частиц вдоль микротрубочек или актиновых филаментов. Специфические филаменты выполняют в данном случае роль «рельсов», направляющих транспортные пузырьки к соответствующей мембране-мишени. Большинство исследователей клетки, однако, считают функцию цитоскелета менее специализированной и полагают, что специфичность везикулярного транспорта обеспечивается в основном системами рецепторов, расположенных на обращенной к цитозолю поверхности самих пузырьков (см. разд. 8.8.6).
8.2.2. Многие белки претерпевают в цитозоле ковалентные модификации [9]
Описано более 100 различных посттрансляционных модификаций белков. Роль большинства этих модификаций не выяснена; некоторые из них случайны и, по-видимому, не имеют функционального значения, но есть и такие, которые важны для жизни клетки, так как они тщательно контролируются специфическими ферментами. Далее мы увидим, что некоторые модификации происходят в ЭР и аппарате Гольджи. В этих органеллах, например, ферменты гликозилирования добавляют к белкам сложные цепи остатков Сахаров, образуя гликопротеины (см. разд. 8.6.12). Единственный известный случай гликозилирования в цитозоле клеток млекопитающих - это добавление к белкам N-ацетилглюкозамина (рис. 8-14). Однако множество других ковалентных модификаций протекает в первую очередь именно в цитозоле. Некоторые из них стабильны, и необходимы для активности белка, например, ковалентное присоединение коферментов (биотина, липоевой кислоты или пиридоксальфосфата). Определенные ковалентные модификации, происходящие в цитозоле, обратимы и служат для регуляции активности многих белков (рис. 8-15).
Среди известных в настоящее время модификаций описана одна, чрезвычайно важная для доставки белков к месту назначения. Присоединение жирной кислоты к белку направляет его к определенным мембранам, обращенным в цитозоль.
8.2.3. Некоторые белки цитозоля прикреплены к цитоплазматической стороне мембраны через цепь жирной кислоты [10]
Клетки обладают специальным механизмом для транспорта растворимых белков из цитозоля к мембранам. Такие белки ковалентно связываются с цепью жирной кислоты, которая затем встраивается в липидный бислой с цитоплазматической стороны, заякоривая в нем белок. Связывание белка с мембраной через жирную кислоту может иметь важные функциональные последствия. Например, онкоген src вируса саркомы Рауса кодирует тирозин-специфическую протеинкиназу, которая обычно связывается с мембраной при помощи ковалентно присоединенной цепи миристиновой кислоты (ненасыщенная жирная кислота с 14 углеродными атомами). В такой конфигурации эта протеинкиназа превращает нормальную клетку в раковую. Если же присоединению жирной кислоты предшествует замена в молекуле белка N-концевого глицина на аланин, то src-белок сохраняет свою активность как протеинкиназа, но остается в цитозоле и не трансформирует клетку. Очевидно, для эффективного связывания с субстратом эта киназа должна быть прикреплена к мембране. В сходных экспериментах было показано, что продукт другого онкогена, белок ras (см. разд. 12.3.1), для того, чтобы трансформировать клетку, должен прикрепиться к мембране через ковалентно присоединенную цепь пальмитиновой кислоты (ненасыщенная жирная кислота с 16 углеродными атомами).
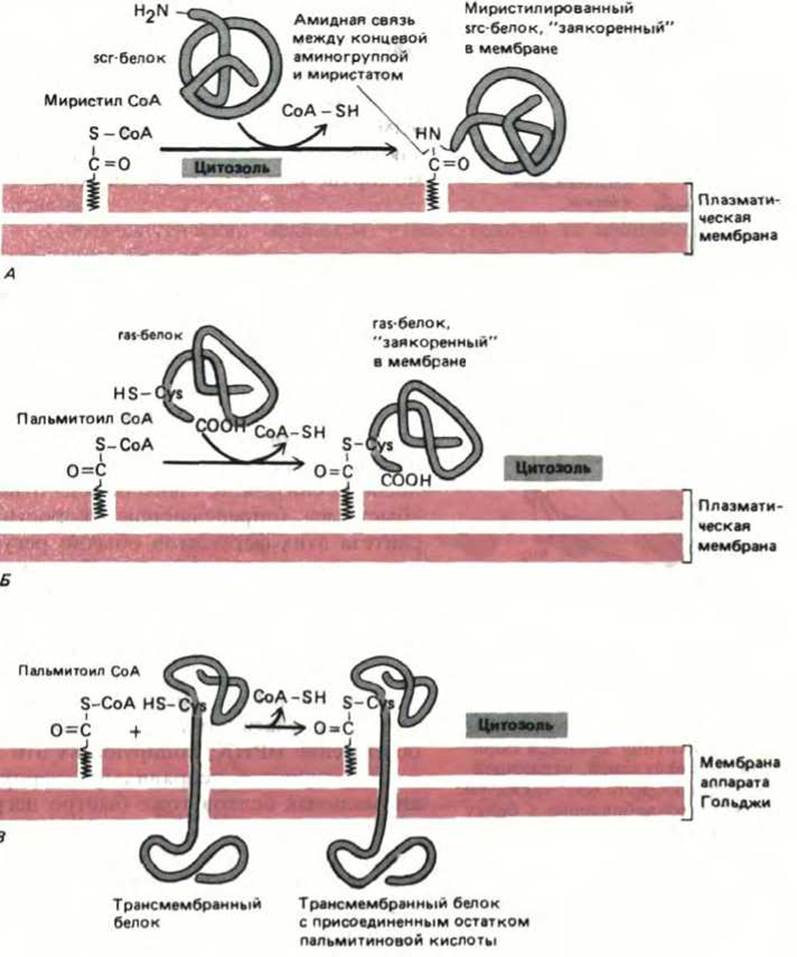
Рис. 8-16. Ковалентное присоединение к белку жирной кислоты может направлять водорастворимый белок в мембрану. А. Образование амидной связи между N-концевым глицином и миристиновой кислотой вызывает заякоривание белка src (после его синтеза в цитозоле) с цитоплазматической стороны мембраны. Б. Тиоэфирная связь между пальмитиновой кислотой и цистеином вблизи карбоксильного конца заякоривает белок ras в плазматической мембране после его синтеза в цитозоле. В. Пальмитиновая кислота и другие жирные кислоты часто присоединяются тиоэфирной связью к некоторым остаткам цистеина, расположенным в цитоплазматическом домене трансмембранного белка. Это происходит при транспорте белка из ЭР в аппарат Гольджи. Ацетилированному цистеину обычно предшествуют три гидрофобные аминокислоты (X) в последовательности NH2-...-X-X-X-Cys-...-COOH. В примере (В), в отличие от (А) и (Б), белок остается связанным с мембраной даже без присоединения жирной кислоты.
Чем определяется, присоединится или нет к данному белку цепь жирной кислоты и какая это кислота: миристиновая или пальмитиновая? Ферменты, катализирующие данные модификации, распознают различные сигнальные пептиды в белке: цепь миристиновой кислоты (рис. 8-16, А) добавляется к N-концевому остатку глицина, расположенному внутри определенной аминокислотной последовательности (см. табл. 8-3), а цепь пальмитиновой кислоты присоединяется к боковой цепи цистеина, расположенного за четыре остатка от карбоксильного конца в составе другого сигнального пептида (рис. 8-16, Б). Кроме того, в цитозоле протекает реакция, катализируемая другим ферментом, в ходе которой цепи пальмитиновой кислоты добавляются к обращенным в цитозоль концам многих трансмембранных белков, по мере того как они проходят из ЭР в аппарат Гольджи на пути к плазматической мембране или куда-либо еще (рис. 8-16, В).
8-8
8.2.4. Некоторые белки цитозоля являются короткоживущими [11]
Кроме сигналов, определяющих место их локализации, клеточные белки имеют сигналы, определяющие время их жизни. Белки подвергаются непрерывному обмену: часть их молекул случайным образом деградирует и замещается новыми копиями. Большинство постоянных белков цитозоля существуют относительно долго - несколько дней. Другие, однако, деградируют гораздо быстрее - иногда через несколько минут после их синтеза. К таким белкам относятся ферменты, катализирующие «быстрые» (определяющие скорость) стадии метаболизма; скорости синтеза этих ферментов обычно регулируются в соответствии с внешними условиями, чтобы метаболизм был эффективен. Другие короткоживущие белки - это продукты таких клеточных онкогенов, как fos или myc, которые, как полагают, играют важную роль в регуляции роста и деления клетки (см. разд. 13.4.6). Поскольку белки указанных типов непрерывно и быстро разрушаются, их концентрации могут быстро меняться при изменении скорости их синтеза (см. разд. 12.4.7). В большинстве случаев для такой регуляции требуется еще и необычно быстрое обновление мРНК, кодирующих эти белки (см. разд. 10.4.12).
Большинство неправильно свернутых, денатурированных и других аномальных белков тоже быстро деградирует в цитозоле. Обычно они распадаются за несколько минут, тогда как нормальные копии этих же белков сохраняются. Аномальные белки возникают в результате ошибок при синтезе, когда в цепь встраивается неправильная аминокислота, или в результате химических повреждений, таких, как окисление боковых цепей некоторых аминокислот. Разнообразные мутантные формы обычных белков также распознаются в качестве аномальных. Сейчас становится все более очевидным, что и аномальные белки, и белки, генетик запрограммированные на быструю замену, в конечном счете разрушаются в цитозоле при помощи одного и того же протеолитического механизма.
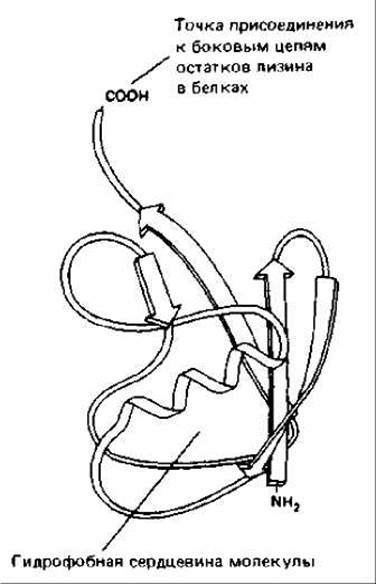
Рис. 8-17. Трехмерная структура убикитина (убиквитина), термостабильного белка, состоящего из 76 аминокислотных остатков. Присоединение к белку единичной молекулы убикитина является обратимой модификацией, играющей регуляторную роль (см. также рис. 8-15). Однако добавление к белку разветвленной убикитиновой цепи вызывает его немедленную и полную деградацию (см. рис. 8-18). (По S. Vijay-Kumar, С. Е. Bugg, К. D. Wilkinson, W. J. Cook, Proc. Natl. Acad. Sci. USA 82: 3582-3585, 1985.)
8-6
8.2.5. У эукариот избирательная замена белков происходит при помощи убикитин-зависимого протеолиза [12]
Те белки цитозоля, которые должны быстро разрушаться, несут сигналы, включающие ответственный за их деградацию протеолитический механизм. Один из таких сигналов чрезвычайно прост и представляет собой всего лишь первую аминокислоту в полипептидной цепи. Аминокислоты Met, Ser, Thr, Ala Val, Cys, Gly и Pro, когда они находятся на N-конце, являются стабилизирующими, а остальные 12 аминокислот вызывают протеолитическую атаку. Эти дестабилизирующие аминокислоты практически никогда не встречаются на N-конце стабильных белков цитозоля. Однако они часто присутствуют на N-конце белков, переносимых в другие компартменты, например, в ЭР. Поскольку цитозольный протеолитический механизм отсутствует в полости ЭР или аппарата Гольджи, такие белки в «своих» компартментах обычно являются долгоживущими. Дестабилизирующая N-концевая аминокислота таких нецитозольных белков может служить в клетке для удаления тех копий, которые направляются ошибочно: молекулы, которые нельзя быстро перенести из цитозоля, сразу разрушаются. Подобный же код, состоящий из одного аминокислотного остатка, видимо, существует у бактерий, где также вызывает быструю деградацию специфических белков.
Протеолитический механизм, ответственный за избирательную деградацию белков, сложен и, будучи запущенным, гарантирует полное разрушение белка. У эукариот имеется убикитин-зависимый протеолиз. При таком протеолизе с белком, подлежащим разрушению, связывается множество копий небольшого белка убикитина (рис. 8-17). Связывание убикитина с белком-мишенью катализируется многоферментным комплексом, который, как полагают, присоединяется к N-концу белка, несущему дестабилизирующую N-концевую аминокислоту. Этот ферментный комплекс присоединяет молекулу убикитина к ближайшему остатку лизина в полипептиде, а затем добавляет к первой другие молекулы убикитина, формируя разветвленную убикитиновую цепь (рис. 8-18). Вслед за этим большая АТР-зависимая протеаза быстро разрушает такие белки. По-видимому, субстратом для этой протеазы служат только белки, содержащие полиубикитиновые разветвленные цепи, а белки, содержащие одну молекулу убикитина, связанную с лизином (например, гистоны), сохраняются.
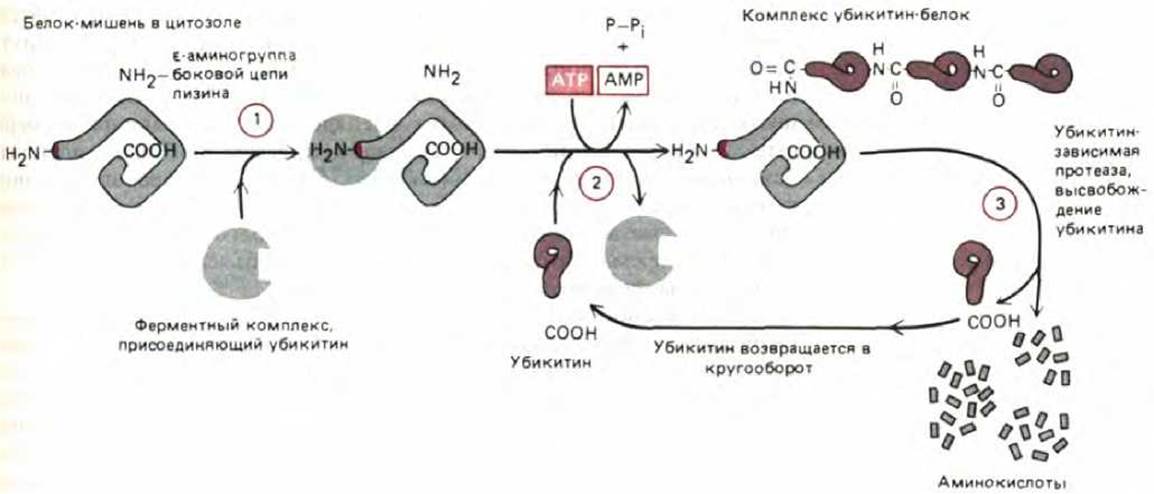
Рис. 8-18. Убикитин-зависимое разрушение белков. Белок-мишень (содержащий «дестабилизирующую» N-концевую аминокислоту, которая служит сигналом для его деградации), узнается ферментным комплексом, присоединяющим убикитин (стадия I). Затем в последовательной серии реакций (стадия 2), молекулы убикитина соединяются друг с другом, образуя разветвленную мультиубикитиновую цепь, присоединенную к є- аминогруппе в боковой цепи ближайшего остатка лизина в белке. Эта реакция требует подвижности белка-мишени и ускоряется, если белок свернут неправильно. Вслед за этим (стадия 3) большая протеаза, расщепляющая только белки, маркированные разветвленной цепью убикитина, разрезает белок-мишень на множество мелких фрагментов.
8-7
8.2.6. Стабильность белка может определяться ферментами, повреждающими его N-конец [13]
Поскольку у цитозольных белков N-концевая аминокислота определяет, будет ли данный белок разрушаться АТР-зависимой протеазой, важно знать, каким образом этот ключевой аминокислотный остаток присоединяется к белку. Вероятно, у белков, генетически запрограммированных на короткое время жизни, дестабилизирующая аминокислота присоединяется к N-концу сразу после окончания синтеза белка. Как обсуждалось в гл. 5 (см. разд. 5.1.10), все белки исходно синтезируются с метионином на N-конце (или формилметионином у бактерий). Этот метионин, являющийся стабилизирующим остатком, часто удаляется при помощи специфической аминопептидазы вскоре после включения его в белок. Кроме того, аминоацил-тРНК-трансферазы могут добавлять один дестабилизирующий аминокислотный остаток на N-конце белка. Условия протекания этих реакций изучены еще слабо.
Мишенями для присоединения убикитина и последующей деградации служат в первую очередь денатурированные, неправильно свернутые белки, а также белки, содержащие окисленные или другие аномальные аминокислоты, причем даже в тех случаях, когда на N-конце у них присутствует стабилизирующая аминокислота. Разрушение неправильно свернутых или денатурированных белков может начинаться с распознавания групп гидрофобных аминокислот, которые в нормальной молекуле белка расположены внутри глобулы, а в аномальной могут находиться снаружи (см. разд. 3.3.1). За этим, вероятно, следуют реакции расщепления или модификации белка, в результате которых образуется новый, дестабилизирующий N-концевой остаток. И наконец, благодаря действию убикитин-зависимого прогеолитического механизма, аномальный белок может быть разрушен. При построении любой гипотетической схемы распознавания денатурированных или неправильно свернутых белков главный вопрос состоит в том, как клетка отличает целые аномальные молекулы от множества растущих на рибосомах полипептидных цепей, которые могут выглядеть как «неправильно» свернутые. Показано, например, что если к клеткам добавить ингибитор белкового синтеза пуромицин (см. разд. 5.1.15), то незавершенные полипептиды быстро распадаются в ходе убикитин-зависимого протеолиза. Возможно, метаболическая стабильность и долго-, и короткоживущих белков во время их синтеза на рибосомах объясняется тем, что они временно защищены аппаратом трансляции.
Установлено, что N-концевой остаток часто бывает устойчив к гидролизу в процессе повторяющихся реакций, используемых в аминов кислотных секвенаторах (см. разд. 4.4.7). Секвенируемые белки обычно ацетилируют по N-концу, который, видимо, становится после этого «заблокированным». Возможно, некоторые белки, модифицированные таким образом, особенно устойчивы к внутриклеточному протеолизу и поэтому являются необычно долгоживущими; к ним относятся многие белки цитоскелета и гистоны, участвующие в укладке ДНК в клеточном ядре. Однако механизм отбора белков, которые должны быть ацетилированы, неизвестен.
8.2.7. Белки теплового шока позволяют предотвратить накопление в клетке белковых агрегатов [14]
Нормальные клетки млекопитающих растут в культуре при 37°С. Если их на короткое время подвергнуть «тепловому шоку», повышая температуру (обычно до 43°С), они начинают синтезировать в большом количестве набор специфических белков. Большинство этих белков теплового шока образуются и в ответ на другие повреждающие воздействия. Возможно, именно они помогают клетке пережить стрессовые ситуации. Сходные белки синтезируются у Drosophila, дрожжей и даже у бактерий. Изучение последовательностей ДНК показывает, что существует три основных семейства белков теплового шока: с мол. массой 25, 70 и 90 кДа. В нормальных клетках было обнаружено множество очень похожих между собой белков из каждого семейства.
Предполагают, что белки теплового шока помогают переводить в раствор и вновь сворачивать денатурированные или неправильно свернутые белки. Есть у них и другие функции (см. разд. 8.4.4. и 8.6.7). Например, белки из семейства 90 кДа, как было показано, связываются с неактивными формами белков - рецепторов стероидных гормонов и с тирозин-специфическими протеинкиназами, вероятно, таким образом участвуя в регуляции функций этих рецепторов. Лучше всего изучены белки семейства 70 кДа (hsp 70). Эти белки связываются с некоторыми другими белками, а также аномальными белковыми комплексами и агрегатами, от которых потом освобождаются, присоединяя АТР. Было доказано, что они помогают переводить в раствор и заново сворачивать агрегированные или неправильно свернутые белки путем нескольких циклов присоединения и гидролиза АТР. Аномальные белки имеются в любой клетке, но при некоторых воздействиях, например при тепловом шоке, их количество в клетке резко возрастает, и соответственно возникает необходимость в большем количестве белков теплового шока. Оно обеспечивается активацией транскрипции определенных генов. В клетках дрожжей S. cerevisiae, например, имеется восемь hsp 70-генов; некоторые из них транскрибируются при любых условиях, а остальные - только под действием высоких температур или других экстремальных факторов.
Заключение
Цитозоль, составляющий обычно около половины объема эукариотической клетки, представляет собой все внутриклеточное пространство за вычетом органелл. В цитозоле протекает большинство реакций промежуточного обмена и синтеза белка. Если вновь синтезированные белки не имеют сигналов для транспорта в органеллы, они остаются в цитозоле. Некоторые из этих белков разрушаются вскоре после синтеза. Единственная «дестабилизирующая» аминокислота на их N-конце способствует присоединению множества молекул убикитина к специфическим остаткам лизина в белке-мишени. Затем убикитин- и АТР-зависимая протеаза разрушает такой белок. Дефектные копии большинства цитозольных белков разрушаются при помощи того же убикитин-зависимого механизма. Многие белки претерпевают в цитозоле ковалентные модификации. Некоторые из этих модификаций постоянны, другие же, например фосфорилирование, обратимы и играют валеную роль в регуляции активности этих белков. К определенным белкам ковалентна присоединяются жирные кислоты. После этого белок, бывший без такой модификации растворимым, приобретает способность связываться с цитоплазматической поверхностью клеточной мембраны.
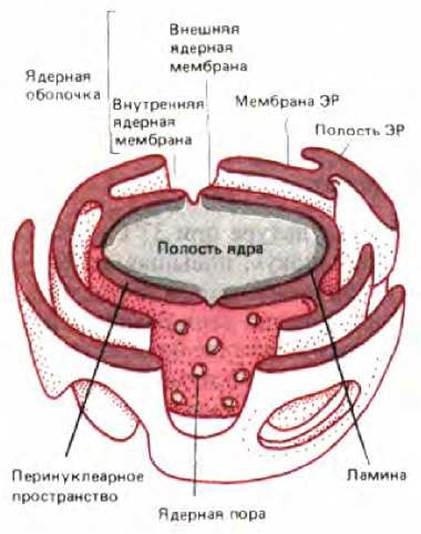
Рис. 8-19. Трехмерная модель двуслойной оболочки, окружающей ядро. Ядерная оболочка пронизана ядерными порами и переходит в эндоплазматический ретикулум.