Молекулярная биология клетки - Том 2 - Албертс Б., Брей Д., Льюис Дж., Рэфф М., Робертс К., Уотсон Дж. 1993
Рост и деление клеток
Фазы клеточного цикла и их причинные взаимосвязи
Под микроскопом деление эукариотической клетки выглядит как поразительный спектакль. При митозе содержимое ядра конденсируется, образуя видимые хромосомы, которые в результате серии удивительно согласованных движений разделяются на два дочерних набора; затем при цитокинезе сама клетка делится на две дочерние, каждая из которых получает один из двух наборов хромосом. Благодаря легкости, с которой их можно наблюдать, митоз и цитокинез были в центре внимания ранних исследователей. Однако эти два события вместе составляют лишь короткую фазу всего клеточного цикла, известную как фаза М (от слова «митоз»). Гораздо более длительный период между двумя последовательными М-фазами известен как интерфаза. Под микроскопом интерфаза обманчиво выглядит как антракт без всякого действия, когда клетка просто медленно увеличивается в размерах. Более изощренные методы позволяют узнать, что на самом деле интерфаза - это период, во время которого в строго заданной последовательности происходят сложные приготовления к митозу. В этом разделе мы обсудим, как можно изучать последовательность событий в интерфазе и каковы причинные взаимосвязи между фазами клеточного цикла.
13-3
13-4
13.1.1. Репликация ядерной ДНК происходит в определенный период, составляющий часть интерфазы [1]
В большинстве клеток синтез ядерной ДНК занимает лишь некоторую часть интерфазы - период, называемый S-фазой клеточного цикла. Обычно между концом М-фазы и началом синтеза ДНК имеется интервал, известный как фаза G1 (от англ. gap-промежуток); другой интервал, называемый фазой G2, отделяет конец синтеза ДНК от начала следующей М-фазы. Таким образом, интерфаза состоит из последовательности фаз G1, S и G2 и обычно занимает не меньше 90% всего времени клеточного цикла. Например, в быстро делящихся клетках высших эукариот М-фаза обычно повторяется раз в каждые 16-24 ч, а сама длится только от 1 до 2 ч. Типичный клеточный цикл с его четырьмя последовательными фазами показан на рис. 13-1; некоторые подробности приведены в подписи к этому рисунку.
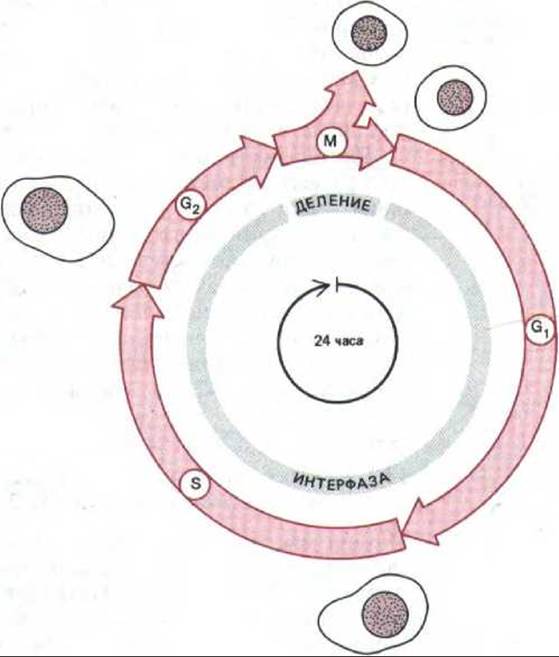
Рис. 13-1. Четыре последовательные фазы клеточного цикла типичной эукариотической клетки. После фазы М, которая состоит в делении ядра (митоз) и цитоплазмы (цитокинез), дочерние клетки вступают в интерфазу нового цикла. Интерфаза начинается с фазы G1, в которой возобновляются интенсивные биосинтетические процессы, резко замедленные во время митоза. Фаза S-это период синтеза ДНК; она заканчивается, когда содержание ДНК в ядре удвоится и хромосомы полностью реплицируются (теперь каждая хромосома состоит из двух идентичных «сестринских хроматид»). Затем клетка вступает в фазу С2, которая продолжается до начала митоза, т.е. фазы М. В фазе М удвоившиеся хромосомы конденсируются и становятся хорошо видимыми в световой микроскоп. Ядерная оболочка разрушается (исключение составляют одноклеточные эукариоты, например дрожжи, - у них она остается интактной); сестринские хроматиды расходятся и формируют два новых ядра, а цитоплазма делится с образованием двух дочерних клеток, имеющих по одному ядру. Процесс цитокинеза завершает фазу М, и начинается интерфаза следующего клеточного цикла. На рисунке представлен типичный 24-часовой цикл, однако длительность клеточного цикла у высших эукариот сильно варьирует: она может быть короче 8 часов, а у взрослых животных - больше года, причем различия в основном зависят от продолжительности фазы G1.
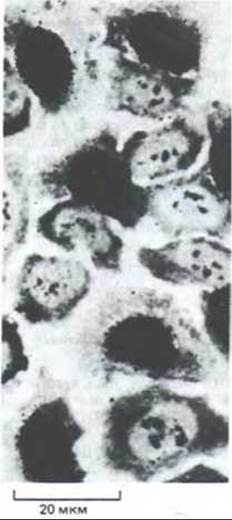
Рис. 13-2. Радиоавтограф, полученный после кратковременной инкубации клеток с 3Н-тимидином. Эта методика описана в разд. 4.5.2. Наличие зерен серебра в фотоэмульсии над ядрами (черные участки) свидетельствует о том, что клетки включали 3Н-тимидин в ДНК и, следовательно, в период экспозиции какое-то время находились в фазе S. (С любезного разрешения James Cleaver.)
Время синтеза ДНК в клеточном цикле было впервые выявлено в начале 1950-х гг. с помощью метода радиоавтограф ии. В стандартном методе применяют 3Н-тимидин - радиоактивный предшественник соединения, которое клетка использует исключительно для синтеза ДНК, 3Н-тимидин можно либо инъецировать животному для изучения циклов клеточного деления в тканях, либо добавлять в культуральную среду in vitro (рис. 13-2). В первом случае через определенное время после введения 3Н-тимидина у животного берут ткань и приготовляют из нее радиоавтографы. Те клетки, которые в прошедший период синтезировали ДНК (и, следовательно, находились в S-фазе), могут быть выявлены по зернам серебра над их ядрами. Подсчитывая долю клеток, находившихся в М-фазе, при различной длительности включения 3Н-тимидина, можно показать, что в клеточном цикле имеются четыре фазы, описанные выше, и измерить продолжительность каждой из них.
Предположим, что делают одну инъекцию и через короткое время, скажем через полчаса, ткань фиксируют для радиоавтографии. В типичной клеточной популяции, где все клетки делятся быстро, но не синхронно, около 30% клеток получат радиоактивную метку. Это будут те клетки, которые синтезировали ДНК в короткий период экспозиции в присутствии 3Н-тимидина, и их доля в клеточной популяции отражает долю клеточного цикла, занятую S-фазой (рис. 13-3). Только около 5% клеток в момент фиксации окажутся в стадии митоза (малая величина этого митотического индекса означает, что митоз занимает лишь небольшую часть клеточного цикла), но ни в одной из них не будет радиоактивной метки. Это указывает на то, что фазы М и S-обособленные части клеточного цикла. Однако, с другой стороны, если препараты фиксировать через несколько часов после введения 3Н-тимидина, то некоторые клетки, находящиеся в митозе, получат радиоактивную метку; вероятно, эти клетки еще синтезировали ДНК в момент инъекции. Минимальный интервал между инъекцией и временем появления меченых митотических клеток будет равен длительности фазы G2. Такого рода исследования позволяют определить длительность всех четырех фаз цикла. Пример использования этого метода приведен на рис. 13-4.
Длительность клеточных циклов в разных тканях, у разных видов и на разных стадиях очень широко варьирует - она может быть меньше одного часа (например, в раннем эмбрионе лягушки) и больше года (например, в печени взрослого человека). Хотя различаться по длительности в известной степени могут все фазы клеточного цикла, это в особенности касается фазы G1, длительность которой может варьировать в пределах практически от нуля (в раннем зародыше лягушки) до столь больших величин, что клетки кажутся вообще прекратившими деление (в зрелой печени человека). Часто говорят, что клетки в такой покоящейся фазе G1 находятся в состоянии G0 (см. разд. 13.3.8).
13-5
13.1.2. Клеточный цикл легче всего изучать на культурах in vitro [1, 2]
Механизмы, лежащие в основе клеточного цикла, трудно изучать в сложных и недоступных тканях интактного животного. Легче работать с клеточными культурами. Например, с помощью цейтраферной съемки (разд. 4.1.5) можно наблюдать, как отдельная клетка претерпевает митоз, растет, затем опять входит в стадию митоза; это делает возможным прямое измерение длительности М-фазы и всего клеточного цикла. Клетки, осуществляющие синтез ДНК в культуре, можно выявлять таким же образом, как в интактном организме, - методом радиоавтографии с использованием 3Н-тимидина. Можно также прослеживать ход клеточного цикла путем прямого измерения содержания ДНК в клетке; эту задачу сильно облегчает применение флуоресцентного анализатора клеток (рис. 13-5).

Рис. 13-3. Длина каждой фазы клеточного цикла примерно равна доле клеток, находящихся в этой фазе в каждый данный момент, умноженной на общую продолжительность цикла (если популяция клеток растет равномерно и все клетки делятся с одной и той же скоростью). Однако для точного расчета длительности каждой фазы нужен «фактор коррекции», который изменяется в пределах от 0,7 для клеток ранней фазы G1 до 1,4 для митотических клеток. Этот коэффициент необходим потому, что в равномерно растущей популяции всегда больше молодых (недавно поделившихся) клеток, чем старых.
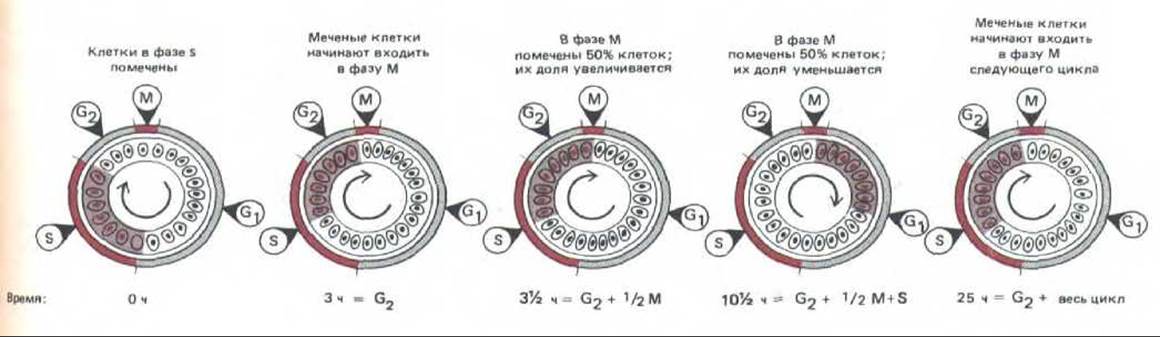
Рис. 13-4. Метод, используемый обычно для измерения продолжительности фаз клеточного цикла. Несинхронно пролиферирующую клеточную популяцию короткое время выдерживают в среде с 3Н-тимидином, а затем отмывают; при этом клетки продолжают проходить свой цикл. Через разное время после экспозиции берут пробы клеток и получают радиоавтографы. Для интерпретации результатов полезно изобразить клетки так, как будто они распределены на равномерно вращающемся круге, причем положение каждой клетки соответствует стадии цикла, на которой она находится. Вначале клетки в фазе S получают радиоактивную метку (окрашенный участок), а клетки в фазах G2, М и G1 ее не получают. Через промежуток времени, равный длительности G2, меченые клетки начинают вступать в фазу М; когда пройдет время, равное G2+ М, получают метку все клетки, находящиеся в фазе М, и т.д. Отмечая время вступления меченых клеток в фазу М и последующие фазы вплоть до возвращения в М, в принципе можно определить среднюю длительность фаз G2, М и S и общую продолжительность цикла, а отсюда (путем вычитания) и длительность G1. В приведенном примере эти величины равны 3, 7, 22 и 11 ч соответственно.

Рис. 13-5. Типичные данные, полученные при анализе содержания ДНК в отдельных клетках растущей популяции с помощью флуоресцентного клеточного анализатора - электронного прибора, основанного на том же принципе, что и сортировка флуоресцентно-окрашенных клеток (см. разд. 4.3.1). Клетки окрашивают красителем, приобретающим способность флуоресцировать при связывании с ДНК. Поэтому уровень флуоресценции прямо пропорционален содержанию ДНК в каждой клетке. Клетки подразделяются на три категории: с нереплицированной ДНК (1 условная единица), т.е. находящиеся в фазе G1, с полностью реплицированной ДНК (2 условные единицы), т. е. находящиеся в фазе G2 или М, и с промежуточным содержанием ДНК, находящиеся в фазе S. Распределение клеток в представленном примере показывает, что число клеток в фазе Gi больше, чем в G2 и М, взятых вместе. Это означает, что в данной популяции фаза G1 длиннее, чем G2+ M.
Дальнейшее упрощение анализа клеточного цикла состоит в использовании большой популяции культивируемых клеток, одновременно проходящих одни и те же фазы клеточного цикла. Такие синхронные клеточные популяции можно получать разными способами. Самый ранний метод состоял в выдерживании клеток в растворе вещества, нарушающего определенную стадию клеточного цикла; длительное пребывание культуры в таком растворе приводит к тому, что все клетки останавливаются на этой стадии, а после снятия блокады возобновляют цикл и проходят его синхронно. Однако в ходе клеточного цикла параллельно осуществляется много различных процессов, и вряд ли все они будут блокироваться одновременно. Поэтому было бы лучше по возможности применять такие методы получения синхронных популяций, которые не нарушают нормальное прохождение клеточного цикла. Для большинства клеток млекопитающих самый простой и лучший метод состоит в том, что используют изменения цитоскелета в М-фазе, приводящие к «округлению» клеток. Округлившиеся в М-фазе клетки так слабо прикрепляются к дну культуральной чашки, что их можно отделить легким встряхиванием (рис. 13-6). Митотические клетки, отобранные таким способом, составляют синхронную популяцию, в которой почти сразу же наступает фаза G1 клеточного цикла. Применяют и другой метод: поскольку клетки по мере прохождения цикла увеличиваются в размерах, можно использовать центрифугирование, чтобы выделить субпопуляции клеток, находящихся на разных стадиях цикла.

Рис. 13-6. Обычный метод получения синхронной популяции животных клеток в культуре. Митотические клетки отбирают, стряхивая их с поверхности чашки, в которой они растут. После перенесения в новую чашку эти клетки проходят дальнейшие циклы синхронно. Из-за случайных различий в скорости деления индивидуальных клеток синхронность после нескольких циклов деления теряется.

Рис. 13-7. График увеличения массы клеток за время клеточного цикла. Большая часть клеточных компонентов синтезируется более или менее равномерно на протяжении всей интерфазы, причем скорость их образования обычно возрастает по мере того, как размеры клетки и ее биосинтетическая активность увеличиваются (с коротким перерывом в фазе М). Чтобы в пролиферирующей популяции средняя величина клетки оставалась постоянной, количество каждого компонента за время цикла должно в точности удваиваться.
13.1.3. Критические события клеточного цикла наступают внезапно на фоне непрерывного роста клеток [3]
На синхронной популяции делящихся клеток можно более детально изучать химические изменения, происходящие в ходе клеточного цикла. При благоприятных для роста условиях общее содержание белка в типичной клетке на протяжении всего цикла увеличивается более или менее непрерывно (рис. 13-7). Синтез РНК тоже происходит с постоянной скоростью, за исключением М-фазы, когда конденсация хромосом, видимо, препятствует транскрипции, так что синтез РНК почти не идет, а образование белка снижается. Анализ синтеза индивидуальных белков (рис. 13-8) показывает, что подавляющее большинство их синтезируется в течение всего цикла. Таким образом, в процессе роста клетки большая часть ее компонентов образуется постепенно и непрерывно - их синтез ненадолго прекращается лишь во время разделения клетки на две.
На фоне этого непрерывного роста происходит ряд резких изменений, связанных с критическими моментами клеточного цикла. Некоторые из них, такие как начало синтеза ДНК, легко выявляются, тогда как другие обнаружить труднее. Оказалось, например, что для большинства клеток существует критическая точка в фазе G1, когда в их клеточном цикле наступает пауза, если условия среды неблагоприятны для роста. При прохождении этой точки, называемой точкой рестрикции, в клетке происходят внутренние изменения, после которых она должна уже пройти все последующие этапы клеточного цикла в соответствии с жестким временным «расписанием».
Как и следовало ожидать при наличии в цикле ряда критических точек, можно выделить определенные белки (хотя их очень немного), синтез которых резко ускоряется на специфических стадиях цикла (см. рис. 13-8). Например, гистоны, необходимые для построения нового хроматина, синтезируются с высокой скоростью только в S-фазе; это, видимо, относится и к некоторым белкам аппарата репликации ДНК.
Но чем определяется время наступления такого рода критических событий и как они координируются между собой и с непрерывным процессом клеточного роста? Чтобы ответить на эти вопросы, мы вначале посмотрим, что служит пусковым сигналом для синтеза ДНК, т. е. для перехода к S-фазе клеточного цикла.
13.1.4. Синтез ДНК запускается изменением в цитоплазме-появлением активатора S-фазы [4]
Путем добавления надлежащего агента к культуральной среде (разд. 4.3.5) можно вызвать слияние клеток двух синхронизированных клеточных популяций, находящихся в разных фазах клеточного цикла. Результаты такого опыта чрезвычайно информативны. Когда клетка в S-фазе сливается с клеткой, находящейся на более ранней стадии G1, ядро клетки в фазе G1 немедленно приступает к синтезу ДНК (рис. 13-9, А). Очевидно, что это ядро уже готово к репликации ДНК, но в нормальных клетках G1 еще отсутствует какой-то сигнал (или ряд сигналов), необходимый для активации механизма синтеза ДНК. По-видимому, в цитоплазме клеток, находящихся в S-фазе, такой сигнальный фактор содержится в большом количестве. Появление такого активатора S-фазы, очевидно, и отмечает границу между фазами G1 и S в нормальной клетке.
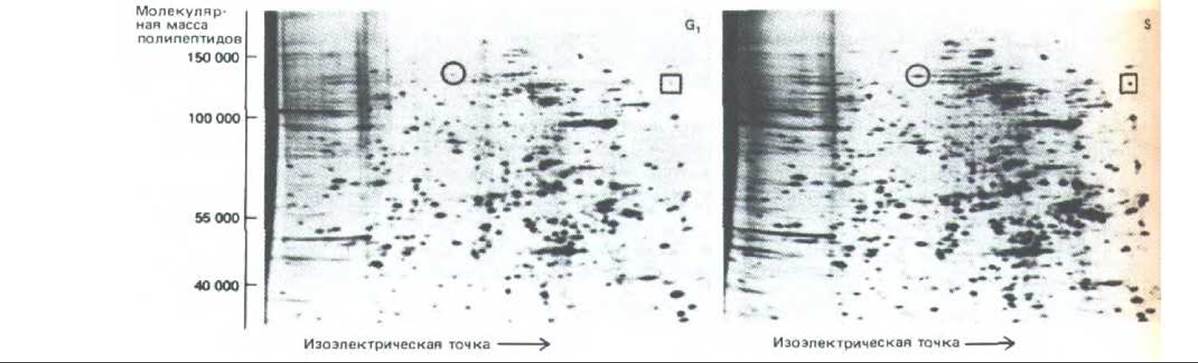
Рис. 13-8. Анализ белков, синтезируемых в фазах G1 и S, с помощью двумерного электрофореза в полиакриламидном геле. Синхронизированные клетки мышиной лимфомы в течение короткого времени в ранней фазе G1 или в поздней S-фазе метили смесью радиоактивных аминокислот. На представленных радиоавтографах можно выявить около 1000 вновь синтезированных белков, но только два из них (отмечены кружком и квадратом) образуются в этих двух фазах с существенно разными скоростями. Поскольку гистоны имеют сильный положительный заряд, они мигрируют за пределы геля и здесь не видны. (P. Coffino, V. Е. Groppi, Adv. Cyclic Nucleotide Res. 14: 399-410, 1981.)
Исчезает ли активатор S-фазы после завершения синтеза ДНК и перехода клетки в фазу G2? Ответ можно опять-таки получить в опытах со слиянием клеток. Когда клетка в фазе G2 сливается с клеткой в фазе G1 (рис. 13-9, Б), ядро клетки G1 не начинает преждевременно синтезировать ДНК; но если такая же клетка G2 сливается с клеткой в S-фазе, то в ядре этой последней репликация ДНК продолжается (рис. 13-9, А). Очевидно, что активатор S-фазы (или какой-то его важный компонент) вскоре после окончания этой фазы исчезает и цитоплазма клеток в фазе G2 уже не содержит ни диффундирующего активатора, ни диффундирующего ингибитора синтеза ДНК.
13.1.5. В каждом цикле весь геном реплицируется только один раз [4, 5]
Как уже говорилось в гл. 9 (разд. 9.3.6), разные части генома реплицируются в разные моменты S-фазы и после этого не могут реплицироваться повторно, так как этому препятствует какое-то химическое изменение, происходящее в каждом участке каждой хромосомы после его репликации. Благодаря такой блокаде повторной репликации при слиянии клетки в фазе G2 с клеткой в S-фазе (рис. 13-9, А) ядро клетки в G2 оказывается нечувствительным к активатору S-фазы и не приступает вновь к синтезу ДНК. Блокада снимается, когда клетки проходят через митоз к началу новой фазы G1.
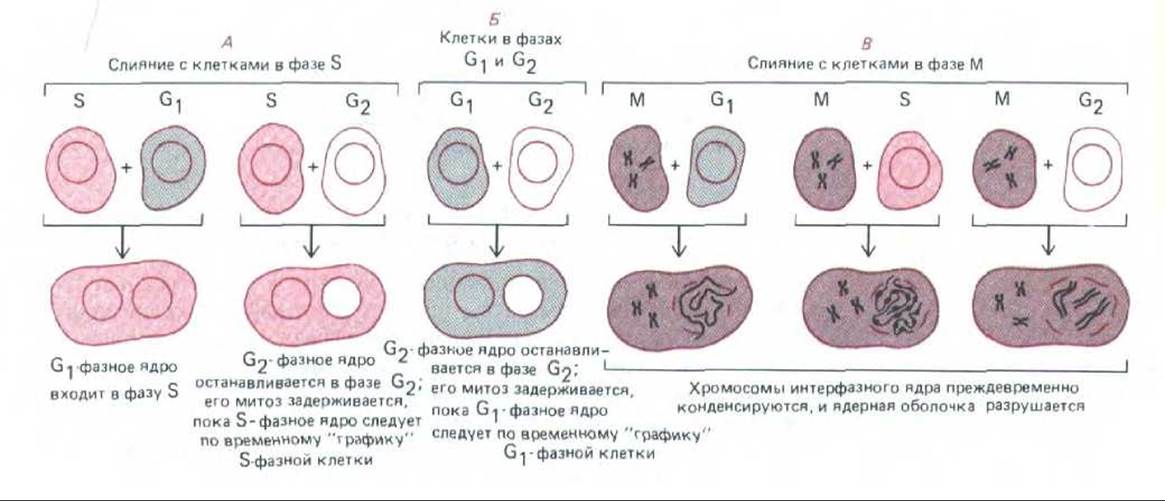
Рис. 13-9. Сводная схема различных результатов слияния двух клеток млекопитающих, находящихся на разных фазах клеточного цикла.
Однако нужен еще какой-то механизм, который бы гарантировал, что активатор S-фазы будет присутствовать до тех пор, пока не завершится репликация всей ДНК. Как мы видели, опыты со слиянием клеток показывают, что цитоплазматический сигнал, активирующий механизм репликации ДНК в начале S-фазы (активатор S-фазы), исчезает к ее концу. Однако если клетку искусственно блокировать в S-фазе ингибиторами синтеза ДНК, механизм репликации ДНК остается дееспособным и после нормального срока окончания S-фазы, так что в случае удаления ингибитора репликация ДНК возобновляется и доводится до конца. По-видимому, хромосома, не завершившая репликацию, каким-то образом сохраняет механизм репликации в активном состоянии.
Возможно, что за этот эффект ответственны сами репликационные вилки. Как мы видели в гл. 9 (разд. 9.3.1), эти вилки существуют парами: две вилки одной пары движутся в противоположных направлениях от общей начальной точки, и каждая из них прекращает свое существование только тогда, когда она доходит до конца хромосомы или сталкивается с вилкой, движущейся ей навстречу. Таким образом, если хромосома начала репликацию, то будет существовать по крайней мере одна репликационная вилка до тех пор, пока вся хромосома не удвоится полностью. Возможно, что каким-то непонятным образом такая вилка обеспечивает дополнительную выработку активатора S-фазы, эффективно катализирующего образование новых вилок в других участках ДНК. В самом деле, инициация первой пары репликационных вилок могла бы служить пусковым механизмом для начала S-фазы, действующим по принципу «всё или ничего». Такое одиночное событие инициации зависело бы от редкого случайного столкновения между стартовой последовательностью ДНК и молекулой инициатора, присутствующего в низкой концентрации. Действительно, разброс моментов перехода G1→S во времени носит случайный характер, что согласуется с этим предположением (разд. 13.3.3).
13-6
13.1.6. Какой-то цитоплазматический сигнал задерживает подготовку к митозу, пока не завершена репликация ДНК [4, 6]
Ядро, завершившее S-фазу и вступающее в G2, в нормальных условиях конденсирует свои хромосомы и через определенное время после этого вступает в митоз. Однако если синтез ДНК искусственно блокировать, то митоз задержится до тех пор, пока блокада не будет снята и не завершится синтез ДНК. Точно так же после слияния клетки в фазе S с клеткой в фазе G2 ядро последней задерживается на этой стадии, пока другое ядро не «догонит» его, и в конце концов оба ядра вместе вступают в митоз. Проще всего предположить, что задержку митоза вызывает какой-то цитоплазматический сигнал, генерируемый при неполной репликации ДНК. Этот сигнал мог бы быть или не быть идентичным активатору S-фазы; в любом случае некоторое указание на возможный механизм его появления содержится в том факте, что в случае повреждения клетки в фазе G2 (например, рентгеновским облучением) митоз задерживается до его репарации. Как при репарации, так и при репликации ДНК в клетке должна быть одноцепочечная ДНК;
между тем известно, что избыток такой ДНК у бактерий запускает выработку цитоплазматического сигнала, задерживающего клеточное деление (реакция SOS-см. разд. 5.2.9). Возможно, что и в эукариотической клетке одноцепочечная ДНК тоже порождает сигнал задержки М-фазы. Это еще не приближает нас к пониманию природы такого сигнала, если не считать одного очень интересного наблюдения: если в культивируемых клетках млекопитающих искусственно блокировать синтез ДНК (ингибиторами или путем повреждения ДНК), то после добавления в среду кофеина они могут преждевременно приступить к митозу, когда их ДНК еще не реплицировались полностью. На что именно воздействует при этом кофеин, пока не известно.
13-7
13.1.7. Митоз запускается «М-стимулирующим фактором» (MPF) [4,7]
Исчезновение сигналов, задерживающих М-фазу, само по себе еще не достаточно для запуска митоза - для этого нужен еще один цитоплазматический фактор. Нормальную фазу G2 можно рассматривать как период подготовки к выработке этого решающего фактора, включающего механизм митоза после исчезновения факторов задержки. Данные об этом тоже получены в экспериментах со слиянием клеток.
Когда клетка в М-фазе сливается с клеткой в любой из стадий интерфазы (С1, S или G2), интерфазное ядро быстро вступает в М-фазу, осуществляя конденсацию хромосом и готовясь к делению, даже если это грозит (как в случае ядер в фазе G1 или S) нарушить весь дальнейший ход деления (рис. 13-9, й и 13-10). По-видимому, цитоплазма в М-фазе содержит сильный М-стимулирующий фактор (M-phase-promoting factor, MPF), на который ядро реагирует в любой фазе клеточного цикла. Вероятно, только что упоминавшиеся факторы, задерживающие митоз, тормозят выработку MPF, но не могут блокировать его действия, если он уже образовался.
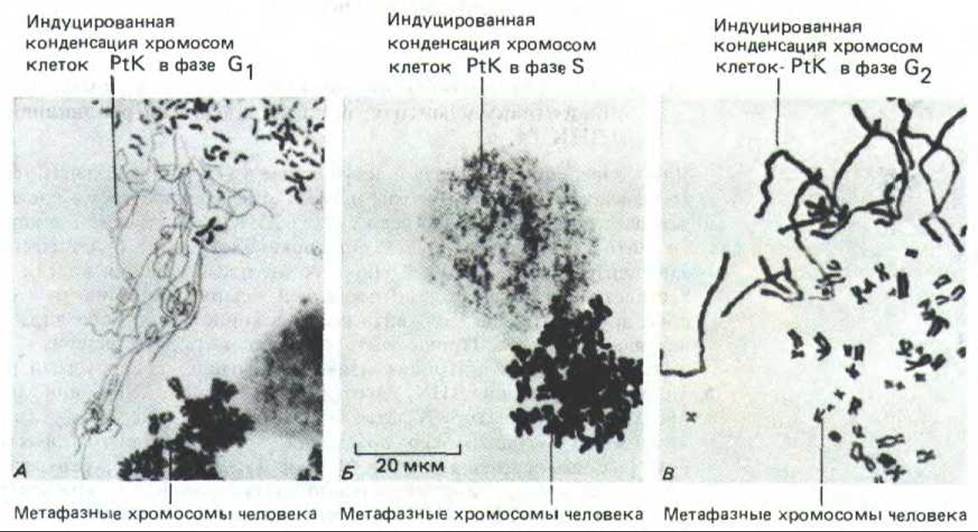
Рис. 13-10. Преждевременная конденсация интерфазных хромосом после слияния интерфазных клеток сумчатого PtK с митотическими клетками человека. А. Клетка PtK была в фазе С1, поэтому ее преждевременно конденсированные хромосомы представлены одиночными хроматидами. Б. Клетка PtK была в фазе S, и теперь ее хроматин приобретает «распыленный» вид. В. Клетка PtK находилась в фазе G2, и теперь хроматиды, хотя и очень длинные по сравнению с нормальными метафазными хромосомами человека, удвоены. (К. Sperling, P. Rao, Humangenetik 23: 235-258, 1974.)
13.1.8. События хромосомного цикла - связанные между собой звенья одной цепи [8]
Описанные выше эксперименты могут служить основой для функциональной классификации некоторых молекул, видимо, управляющих событиями хромосомного цикла. Были описаны три контролирующих фактора, способных к диффузии; для краткости удобно будет считать, что каждый из них представляет собой одну молекулу, хотя на самом деле они могут быть более сложными. Это 1) активатор S-фазы, который в норме присутствует в цитоплазме клеток только в S-фазе и включает синтез ДНК; 2) М-стимулирующий фактор (MPF), который содержится в цитоплазме только в М-фазе и вызывает конденсацию хромосом; 3) ДНК-зависимый М-задерживающий фактор (M-phase-delaying factor, возможно, идентичный активатору S-фазы), который присутствует в цитоплазме в S-фазе и ингибирует процессы, ведущие к выработке MPF.
Моменты быстрого появления и исчезновения этих диффундирующих факторов в цитоплазме разграничивают ряд событий клеточного цикла, и промежутки времени между ними определяют протяженность всего цикла.
Причинные зависимости между тремя факторами (а возможно, и другими, еще не известными) гарантируют, что события хромосомного цикла всегда будут проходить в определенной последовательности, предотвращая такие гибельные неувязки, как конденсацию хромосом посреди фазы синтеза ДНК. Каждый последующий шаг зависит от предыдущего. Поэтому клетка не может вступить в митоз, пока не появится М-стимулирующий фактор; а он не может появиться, пока не исчезнет М-задерживающий фактор; М-задерживающий фактор и активатор S-фазы не смогут исчезнуть до окончания синтеза ДНК; синтез ДНК не прекратится до репликации всей ДНК; следующая репликация ДНК не может начаться до снятия блокады повторной репликации при переходе в G1. Позже мы встретим еще один пример: клетка не может перейти из митоза в G1, пока хромосомы не распределятся с помощью митотического веретена (разд. 13.5.7). Все эти наблюдения, а также те, которые будут рассматриваться позже (разд. 18.2.1, 19.8.2), указывают на то, что большинство событий и процессов хромосомного цикла взаимосвязаны, образуя зависимую последовательность.
13.1.9. Во время ранних делений дробления, когда клетки не растут, клеточный цикл бывает укорочен [9]
Для изучения молекул, управляющих хромосомным циклом, особенно полезными оказались эксперименты с яйцами и ранними зародышами шпорцевой лягушки Xenopus. Яйцо Xenopus, как и у многих других видов, представляет собой необычайно крупную сферическую клетку. Ее диаметр составляет чуть больше миллиметра, и она содержит запас практически всех веществ (за исключением ДНК), необходимых для построения раннего эмбриона. Все эти вещества запасаются в течение долгого периода роста незрелого яйца, называемого ооцитом. Эту длительную стадию лучше всего определить как фазу G2 первого цикла мейотического деления (хотя обычно ее называют профазой первого деления мейоза, она во многих отношениях напоминает обычную фазу G2-см. разд. 15.2.7). Во время овуляции воздействие гормонов приводит к созреванию яйца, так что к моменту откладки оно успевает уже пройти последующие стадии мейоза и останавливается в М-фазе второго мейотического деления (разд. 15.3.3). Затем оплодотворение запускает чрезвычайно быструю последовательность клеточных делений: одна гигантская клетка дробится, образуя зародыш, состоящий из тысяч мелких клеток (рис. 13-11). При этом роста практически не происходит - из макромолекул синтезируется только ДНК, необходимая для образования нужного числа ядер, и немного белка. После первого деления, длящегося около 90 мин, последующие 11 делений проходят более или менее синхронно с 30-минутными интервалами, и в результате примерно за 7 ч образуется 4096 (212) клеток. Предварительное накопление веществ в яйце делает возможными столь быстрые клеточные циклы благодаря тому, что исключается время, необходимое для роста клеток во время каждого цикла. Циклы репликации ДНК и деления укорачиваются за счет того, что фазы S и М ускоряются, a G1 и G2 становятся такими короткими, что практически неразличимы.
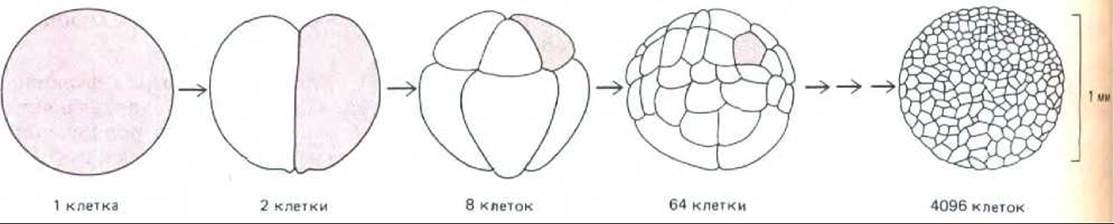
Рис. 13-11. Примерно за 7 ч в яйце Xenopus проходит 12 очень быстрых синхронных циклов деления, состоящих из чередующихся фаз S и М без заметных фаз G1 и G2. Эти деления дробят яйцо на 4096 (212) более мелких клеток. На каждой стадии цветом выделена одна клетка.
13.1.10. М-стимулирующий фактор (MPF) вызывает митоз у самых разнообразных клеток [10]
Поскольку ооциты и яйца шпорцевой лягушки очень крупны, в их цитоплазму легко инъецировать различные вещества. Кроме того, ооцит, яйцо и ранний зародыш служат обильными источниками цитоплазмы строго определенных стадий клеточного цикла. Это особенно важно при изучении М-стимулирующего фактора (MPF, или МСФ), о котором говорилось выше. Этот фактор был впервые открыт в зрелых неоплодотворенных яйцах Xenopus, которые находятся в М-фазе. Если цитоплазму из такого яйца инъецировать в ооцит, она выводит его из стадии G2 и заставляет перейти в М-фазу. Тем самым начинается созревание ооцита (первоначально сокращение MPF означало mutaration promoting factor-«фактор, способствующий созреванию»; см. разд. 15.3.6). Активный MPF появляется также в дробящемся яйце (зародыше) во время каждой М-фазы (рис. 13-12). Таким образом, яйцо и ооцит Хепорш могут служить как источником материала при попытках получить очищенный MPF, так и объектом для определения его активности (рис. 13-13).

Рис. 13-12. Уровни активности М-стимулирующего фактора (MPF, или МСФ) в ооците, яйце и раннем зародыше Xenopus. Ооцит останавливается в фазе G2 мейоза при низком уровне MPF; зрелое отложенное яйцо останавливается в фазе М мейоза при высоком уровне MPF; после оплодотворения ранний эмбрион проходит чередующиеся фазы S и М при соответственно меняющихся уровнях активности MPF.
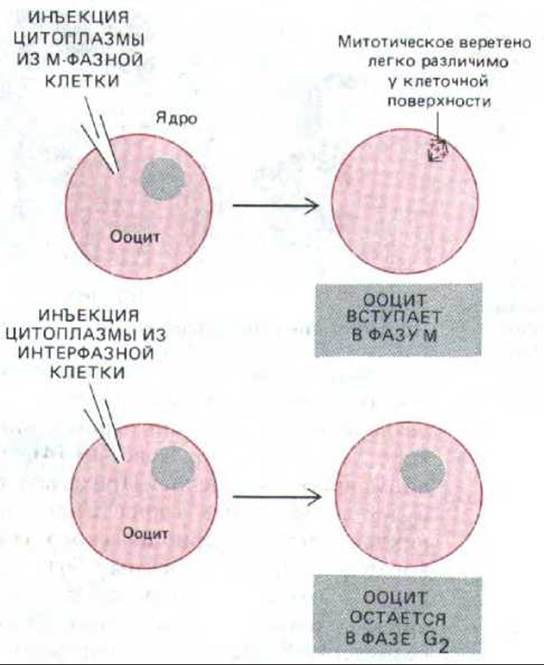
Рис. 13-13. Пробы на MPF путем инъекции в оопит Xenopus. Присутствие MPF выявляется благодаря его способности переводить ооцит в фазу М. Крупное ядро («зародышевый пузырек») ооцита разрушается во время образования митотического веретена.
MPF имеет универсальное значение для эукариотических клеток и в эволюции высококонсервативен: экстракты, приготовленные из митотических клеток весьма разнообразных организмов, таких как млекопитающие, морские ежи, моллюски и дрожжи, при введении в ооциты Xenopus переводят их в М-фазу. Из зрелых яиц Xenopus был получен очищенный препарат с активностью MPF. Он ведет себя как крупный белок, состоящий из субъединиц двух типов; одна из таких субъединиц - протеинкиназа, и она, по-видимому, способна фосфорилировать другую. Поэтому MPF, вероятно, может активировать сам себя: если небольшое количество препарата с активностью MPF инъецировать в ооцит Xenopus, клетка отвечает образованием намного большего количества MPF из своих собственных неактивных резервов (разд. 15.3.6). Эти и другие данные позволяют предполагать, что появление и исчезновение активности MPF на протяжении нормального клеточного цикла зависит от модификации белка - от его фосфорилирования и дефосфорилирования, а не от синтеза и распада. Однако для нормального «запуска» активности MPF требуется синтез другого белка, называемого циклином (см. ниже); поэтому клетки всех типов неспособны перейти от интерфазы к М-фазе, когда белковый синтез у них блокирован.
По-видимому, многие из молекулярных изменений, происходящих в митозе, осуществляются путем фосфорилирования; MPF-киназа прямо фосфорилирует некоторые субстраты, в частности такие, как гистон H1, что, возможно, способствует конденсации хромосом (разд. 9.2.2); может быть, весь комплекс событий, связанных с митозом, MPF запускает с помощью каскада реакций фосфорилирования.
13.1.11. MPF генерируется цитоплазматическим осциллятором [8, 10, 11]
Резкое увеличение количества MPF, происходящее каждые 30 мин в зародыше Хепорш во время дробления, вызывается цитоплазматическим осциллятором, который действует даже в отсутствие ядра. Перетянув активированное яйцо тонким волосом до первого деления, можно разделить его на две примерно равные части, одна из которых содержит ядро, а другая - нет (рис. 13-14). Часть с ядром будет продолжать нормальное дробление. Примечательно то, что и в безъядерной части будет происходить серия осцилляции, выражающихся в повторных циклах легкого периодического сокращения и увеличения жесткости кортикальной цитоплазмы. Эти периодические «спазмы» происходят почти в точности синхронно с делениями дробления другой половины яйца, содержащей ядра. Беря пробы цитоплазмы из осциллирующей безъядерной клетки и испытывая их активность путем инъекции в ооциты, можно показать, что видимые осцилляции сопровождаются (и возможно, вызываются) колебаниями концентрации активного MPF.
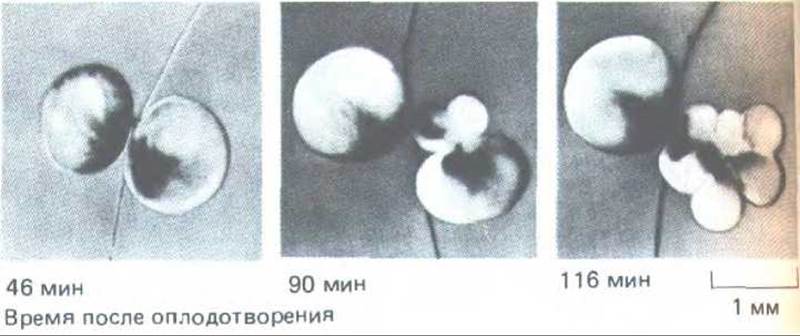
Рис. 13-14. Метод выявления колебательного процесса в цитоплазме, связанного с циклом клеточного деления в дробящемся яйце Xenopus. Только что оплодотворенное яйцо перетягивают на две части петлей из тонкого человеческого волоса; одна половина содержит ядро и продолжает делиться, а другая, лишенная ядра, не делится. Результаты фотосъемки показывают, что безъядерная половина периодически изменяет свои размеры за счет изменений жесткости клеточного кортекса. Эти колебания происходят строго синхронно с делениями в другой половине. (К. Нага, P. Tydeman, M. Kirschner, Ргос. Natl. Acad. Sci USA 77: 462-466, 1980.)
Эти и другие эксперименты позволяют предположить, что деления дробления в раннем эмбрионе Xenopus включают два параллельных циклических процесса - цикл репликации хромосом и цитоплазматический цикл MPF, которые в норме координированы между собой, так как каждый новый хромосомный цикл может начаться только тогда, когда блокада репликации ДНК будет снята очередным импульсом МРF в М-фазе. Такое взаимодействие между двумя циклами предотвращает возможность того, что хромосомный цикл «забежит вперед»; и оно будет поддерживать согласованное протекание обоих циклов до тех пор, пока нет опасности, что слишком медленный хромосомный цикл не обеспечит полную репликацию ДНК до подъема уровня MPF. В яице Xenopus с его необычайно быстрыми S-фазами и регулярными циклами деления такая опасность, по-видимому, мала и простое взаимодействие между циклами кажется достаточным. Однако в клетках млекопитающих, о которых говорилось ранее (и, возможно, в большинстве эукариотических клеток, исключая дробящиеся яйца), есть еще дополнительный механизм: как мы видели, нереплицированная ДНК порождает сигнал задержки М-фазы, который не позволяет цитоплазматическому циклу MPF совершаться быстрее хромосомного цикла. Эксперименты с блокадой репликации ДНК ингибиторами показывают, что в клеточных циклах раннего зародыша Xenopus этот дополнительный контроль не работает. Кроме того, судя по редукции фазы G1, акгиватор S-фазы, по-видимому, присутствует здесь все время. Таким образом, в раннем зародыше Xenopus клеточный цикл упрощен и сжат во времени.
Только что описанные явления означают, что цитоплазматический осциллятор, возможно, имеется во всех клетках, но они ничего не говорят о его механизме. Разгадка могла бы быть связана с другим белком - циклином, который был обнаружен в дробящихся яйцах Xenopus, морских ежей и двустворчатых моллюсков. Циклин, подобно MPF, принадлежит к небольшой трупе белков, активность которых существенно зависит от фазы клеточного цикла. Хотя циклин синтезируется с большой постоянной скоростью на протяжении всего цикла, он внезапно распадается в середине М-фазы. Поэтому в каждом цикле его концентрация постепенно возрастает от нуля, а затем резко падает опять до нуля. Гены циклина были клонированы, что позволило приготовить чистую мРНК для этого белка. Когда такую РНК вводят в ооцит Xenopus, это оказывает такое же действие, как и инъекция MPF, переводящее ооцит из G2 в фазу М. Такого рода данные привели к предположению, что подъем MPF в М-фазе вызывается повышением концентрации циклина до некоторого порогового уровня, а разрушение циклина связано с каким-то событием в М-фазе; последующее исчезновение MPF может быть следствием разрушения циклина (рис. 13-15). В таком случае интервал между двумя митозами определялся бы главным образом временем, необходимым для того, чтобы концентрация циклина поднялась от нуля до пороговой величины; при этом клеточный цикл должен был бы останавливаться в интерфазе под действием ингибиторов белкового синтеза, что фактически и наблюдается.
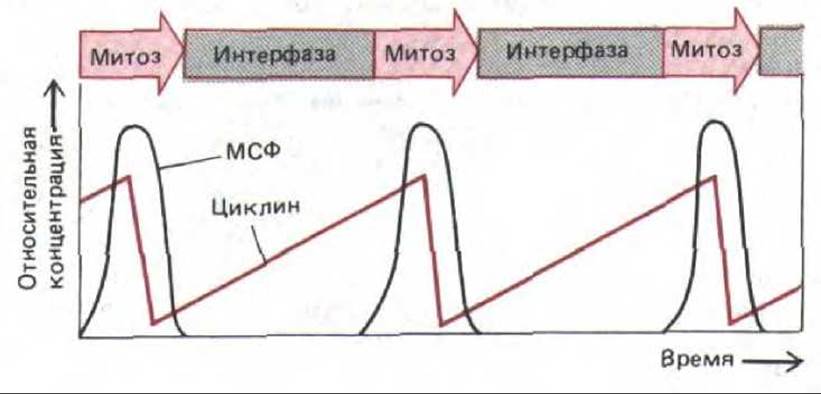
Рис. 13-15. Согласованные подъемы и спады уровней MPF и циклина, связанные с клеточными циклами. Измерения концентрации циклина проводились в основном на яйцах морских беспозвоночных, где циклин составляет 5% белков, синтезируемых во время короткой инкубации с радиоактивными аминокислотами.
Заключение
Репродуктивный цикл типичной эукариотической клетки можно подразделить на четыре фазы, обозначаемые Gi (от конца митоза до начала синтеза ДНК), S (синтез ДНК), G2 (от конца синтеза ДНК до начала митоза) и (митоз). Каждая S- и М-фаза инициируется растворимым цитоплазматическим фактором [активатором S-фазы и М-стимулирующим фактором (MPF) соответственно]. Активатор S-фазы образуется на протяжении всей S-фазы и может также действовать как фактор, задерживающий подготовку к М-фазе до тех пор, пока не завершится репликация ДНК. М-стимулирующий фактор может быть обнаружен в М-фазных клетках многих организмов - от дрожжей до млекопитающих, и его активность, возможно, регулируется фосфорилированием. В яйцах, быстро подвергающихся дроблению, таких как у Xenopus, клеточный цикл укорочен и упрощен. В этом случае цикл, по-видимому, регулируется взаимосвязанными колебаниями активности MPF и концентрации циклина.