Основы молекулярной биологии. Часть 1: Молекулярная биология клетки - А.Н. Огурцов 2011
Основы клеточной теории
Цитоскелет
Цитоплазма эукариотических клеток пронизана трехмерной сеткой из белковых нитей (филаментов), называемой цитоскелетом. В зависимости от диаметра филаменты разделяются на три группы:
- микрофиламенты или актиновые нити (диаметром 6-8 нм),
- промежуточные волокна (диаметром около 10 нм),
- микротрубочки (диаметром около 25 нм).
Все эти волокна представляют собой полимеры, состоящие из субъединиц особых глобулярных белков.
Микрофиламенты (актиновые нити) состоят из актина - белка, наиболее распространенного в эукариотических клетках. Актин может существовать в виде мономера (G-актин, глобулярный актин) или полимера (F-актин, фибриллярный актин) (рисунок 22).
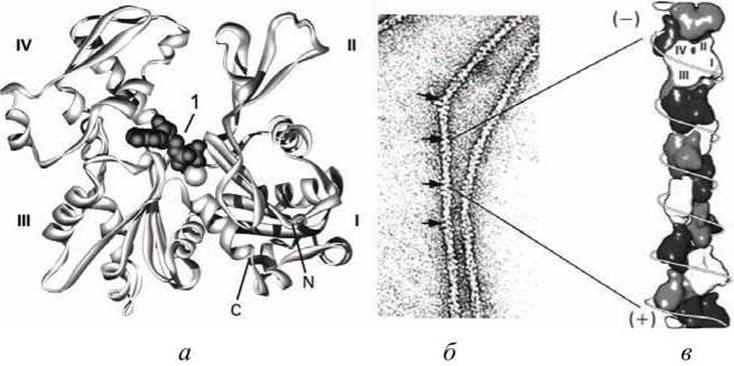
Рисунок 22 - Структура глобулярного и фибриллярного актина: а - модель мономера G-актина; 1 - складка, в которой связывается АТФ, С- и N- концы находятся в субдомене I; б - спираль F-актина в электронном микроскопе; в - модель полимера актина
G-актин - асимметричный глобулярный белок (42 кДа), состоящий из двух доменов (каждый из которых состоит из двух субдоменов). По мере повышения ионной силы G-актин обратимо агрегирует, образуя линейный скрученный в спираль полимер, F-актин. Молекула G-актина несет прочно связанную молекулу АТФ, которая при переходе в F-актин, медленно гидролизуется до АДФ, т. е. F-актин проявляет свойства АТФазы.
Количество мономеров и полимеров различным образом зависит от концентрации актина в клетке (рисунок 23). С увеличением концентрации актина в клетке, начиная с некоторого критического значения Сс≈ 0,1 μМ, начинается полимеризация F-актина.
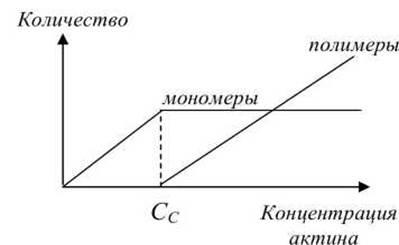
Рисунок 23 - Зависимость количества мономеров и полимеров от концентрации актина
При полимеризации G-актина в F-актин ориентация всех мономеров одинакова, поэтому F-актин обладает полярностью. Волокна F-актина имеют два разноименно заряженных конца: (+) и (-), которые полимеризуются с различной скоростью, поскольку имеют различную критическую концентрацию: С+с ≈ 0,1 μМ, С-с≈ 0,6 μМ. Поэтому, при полимеризации
(+)-конец растет со скоростью в 5-10 раз большей, чем (-)-конец (рисунок 24).
Специальные копирующие белки могут избирательно связываться с тем или другим концом актиновых филаментов или микротрубочек и играют ключевую роль в создании определенной пространственной структуры цитоскелета - обеспечивают прикрепление филаментов и микротрубочек к другим клеточным структурам в нужной ориентации, а также независимую регуляцию наращивания или распада с того или другого конца.
Так, например, процесс полимеризации может быть ингибирован токсинами грибов. Например, фаллоидин (яд бледной поганки) связывается с (-)-концом и ингибирует деполимеризацию, в то время как цитохалазин (токсин из плесневых грибов, обладающий свойством цитостатика) присоединяется к (+)-концу, блокируя полимеризацию.
Динамическая структура актиновых филаментов (и микротрубочек) в сочетании с их векторной структурой, при которой два конца структуры неэквивалентны, обусловило появление необычного их свойства, которое называется течение филаментов (trademilling, эффект бегущей дорожки).
При критической концентрации С-с > Сс > Сс+ (+)-конец будет удлиняться, а (-)-конец укорачиваться, и мономеры G-актина фактически перемещаются вдоль F-актина (рисунок 24(b)).

Рисунок 24 - Полимеризация актина: а - рост (+)-конца; б - рост (-)-конца; в - течение филамента; 1 - копирующий белок
Эффект течения филаментов состоит в том, что субъединицы постоянно диссоциируют с запаздывающего конца (lagging end) филамента и присоединяются (реассемблируют) на растущем конце (leading edge) филамента. В результате, филамент, оставаясь приблизительно неизменной длины, "движется" относительно окружения. Эффект течения филаментов используется клеткой как часть аппарата, обеспечивающего клеточную подвижность.
В цитоплазме клеток имеются более 50 различных типов белков — актин-ассоциированных белков, - которые специфически взаимодействуют с G-актином и F-актином. Эти белки выполняют различные функции:
- регулируют объем G-актинового пула (профилин),
- оказывают влияние на скорость полимеризации G-актина (виллин),
- стабилизируют концы нитей F-актина (фрагин, ß-актинин),
- сшивают филаменты друг с другом или с другими компонентами (как, например, виллин, а-актинин, спектрин, MARCKS),
- разрушают двойную спираль F-актина (гельзолин).
Активность этих белков регулируется ионами Са2+ и протеин-киназами.
Промежуточные волокна. Структурными элементами промежуточных волокон являются белки, принадлежащие к пяти родственным семействам и проявляющие высокую степень клеточной специфичности. Типичными представителями этих белков являются цитокератины, десмин, виментин, кислый фибриллярный глиапротеин [КФГП (GFAP)] и нейрофиламент.
Все эти белки имеют в центральной части базовую стержневую димерную структуру, которая носит название суперспирализованной а-спирали (coiled coil) (рисунок 25(a)). Такие димеры ассоциируют антипараллельно, образуя тетрамер. Агрегация тетрамеров по принципу "голова к голове" дает протофиламент. Жгут протофиламентов образует промежуточное волокно.
В отличие от микрофиламентов и микротрубочек свободные мономеры промежуточных волокон едва ли встречаются в цитоплазме. Их полимеризация ведет к образованию устойчивых неполярных полимерных молекул.
Микротрубочки построены из глобулярного белка тубулина, представляющего собой димер а- и ß-субъединиц (53 и 55 кДа) (рисунок 26(a)). а, ß-Гетеродимеры образуют линейные цепочки, называемые протофиламентами.
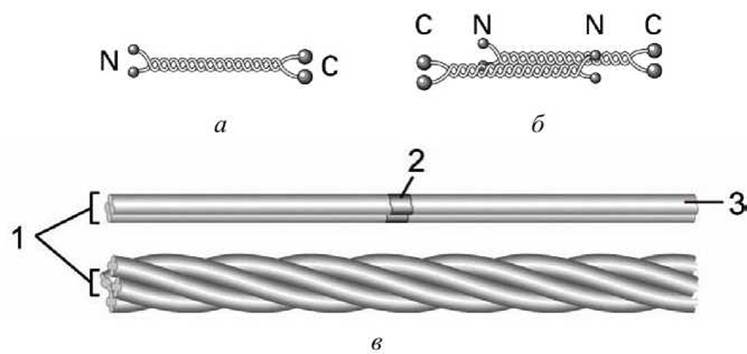
Рисунок 25 - Промежуточные волокна: а - скрученная спираль; б - тетрамер; в - промежуточное волокно: 1 - протофибрнлы, 2 - тетрамер, 3 - протофиламент
Тринадцать протофиламентов образуют циклический комплекс (рисунок 26(5)). Затем кольца полимеризуются в длинную трубку. Как и микрофиламенты, микротрубочки представляют собой динамические полярные структуры с (+)- и (-)-концами.
(-)-Конец стабилизирован за счет связывания с центросомой (центр организации микротрубочек или клеточный центр), в то время как для (+)-конца характерна динамическая нестабильность. Он может либо медленно расти, либо быстро укорачиваться.
Тубулиновые мономеры связывают гуанозинтрифосфат (ГТФ), который медленно гидролизуется в гуанозиндифосфат (ГДФ). С микротрубочками ассоциируют два вида белков: структурные белки, МАР (microtubuls-associated proteins) и белки-транслокаторы.
Микротрубочки демонстрируют интересный эффект, который называют динамической нестабильностью. Микротрубочка удлиняется по мере присоединения субъединиц к растущему концу, и, внезапно, этот растущий конец начинает "растрепываться", и микротрубочка распадается на субъединицы. Благодаря такому свойству микротрубочки постоянно растут, но для стабилизации их структуры необходимы специфические стабилизирующие белки.
Микротрубочки ресничек и жгутиков имеют дублетную структуру (рисунок 26(6)), а базального тела и центриолей - триплетную (рисунок 26(7)).

Рисунок 26 - Строение микротрубочек: а - гетеродимер тубулина; б - цилиндрический полимер; в - "упаковка" протофиламентов; 1 - ГТФ (GTP); 2 - молекула таксола (taxol), 3 - ГДФ (GDP); 4 - протофиламент; 5-7 - одинарные, двойные и тройные микротрубочки
Центриоли, расположенные в центросоме, являются своеобразными "полюсами" клетки, к которым мигрируют хромосомы в процессе деления клетки, и которые обнаружены только в клетках животных.
Цитоскелет выполняет три главные функции.
1. Служит клетке механическим каркасом, который придает клетке типическую форму и обеспечивает связь между мембраной и органеллами. Каркас представляет собой динамичную структуру, которая постоянно обновляется по мере изменения внешних условий и состояния клетки.
2. Действует как "мотор" для клеточного движения. Двигательные (сократительные) белки содержатся не только в мышечных клетках, но и в других тканях. Компоненты цитоскелета определяют направление и координируют движение, деление, изменение формы клеток в процессе роста, перемещение органелл, движение цитоплазмы.
3. Служит в качестве "рельсов" для транспорта органелл и других крупных комплексов внутри клетки.
В качестве примера функционирования компонентов цитоскелета на рисунке 27 показан срез микроворсинок клетки кишечного эпителия.
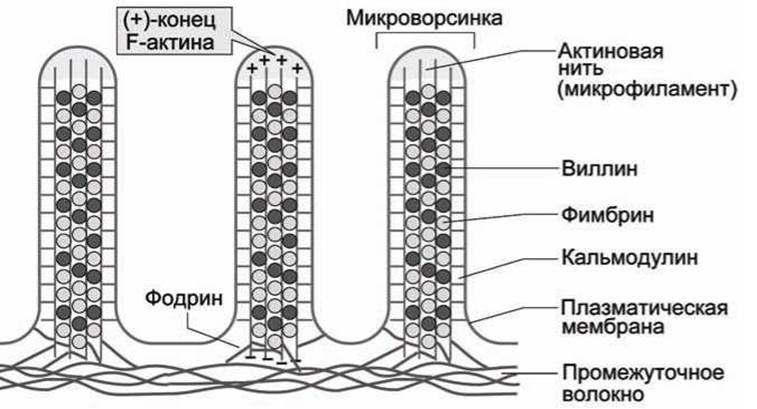
Рисунок 27 - Схема микроворсинок клетки кишечного эпителия
Микрофиламенты, построенные из F-актина, пронизывают микроворсинки, образуя узлы. Эти микроволокна удерживаются вместе с помощью актин-связывающих белков, наиболее важными из которых являются фимбрин и виллин.
Кальмодулин и миозиноподобная АТФаза соединяют крайние микроволокна с плазматической мембраной, ещё один актин-связывающий белок, фодрин, соединяет волокна актина у основания, а также прикрепляет их к цитоплазматической мембране и к сетке, построенной из промежуточных волокон.
В рассмотренном случае микрофиламенты актина выполняют главным образом статическую функцию.
Однако чаще всего актин принимает участие в динамических процессах, таких, как мышечное сокращение, движение клетки, фагоцитоз, образование микровыпячиваний плазматической мембраны и ламеллиподий (клеточных расширений), а также акросом в процессе слияния сперматозоида с яйцеклеткой.
Функции микротрубочек показаны на рисунке 28.
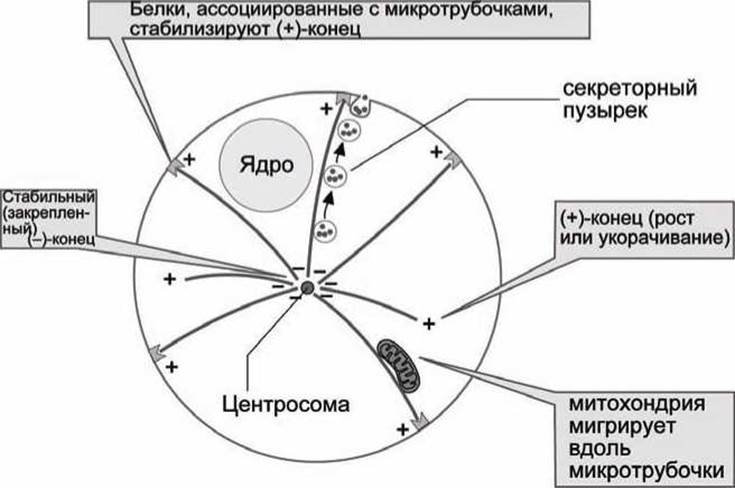
Рисунок 28 - Функции микротрубочек в клетке
Микротрубочки отходят радиально во всех направлениях от структуры вблизи ядра - центросомы. (+)-Конец микротрубочек постоянно находится в состоянии роста и разборки, а (-)-конец блокирован ассоциированными белками в центриоли. (+)-Конец может также быть стабилизирован ассоциированными белками, когда, например, микротрубочки достигают цитоплазматической мембраны.
Микротрубочки принимают участие в поддержании формы клетки. Они же служат направляющими "рельсами" для транспорта органелл. Вместе с ассоциированными белками (динеин, кинезин) микротрубочки способны осуществлять механическую работу, например, транспорт митохондрий, движение ресничек (волосоподобных выростов клеток в эпителии легких, кишечника и яйцеводов) и биение жгутика сперматозоида. Кроме того, микротрубочки выполняют важные функции во-время деления клеток.
Вопросы для самоконтроля
1. Сформулируйте определение клетки.
2. Что называется метаболизмом клетки?
3. Сформулируйте определение фермента.
4. Сформулируйте определение гена.
5. Какие вопросы рассматривает клеточная молекулярная биология?
6. Сформулируйте постулаты клеточной теории.
7. Что такое тотипотентность клетки?
8. Охарактеризуйте строение прокариотической клетки, сравните её с эукариотической.
9. Чем клетки эукариот отличаются от клеток прокариот?
10. В чем сходство и отличие нуклеоида и ядра клетки?
11. Дайте определение нитронов. Есть ли интроны у эукариот?
12. Что называется цитозолем клетки? В чем отличие цитозоля и цитоплазмы?
13. Какие причины ограничений на размер клеток прокариот?
14. Что такое компартментация клетки? Её функции?
15. В каких случаях размер клеток значительно превышает диффузионные ограничения?
16. Что такое пиноцитоз и в чем его отличие от фагоцитоза?
17. Что такое фагоцитоз и в чем его отличие от пиноцитоза?
18. В чем сходство и различие эндоцитоза и экзоцитоза?
19. Что называется клеточной дифференцировкой и в чем состоит её значение?
20. Перечислите и охарактеризуйте основные составные части клетки.
21. Перечислите и охарактеризуйте основные органоиды цитоплазмы.
22. Охарактеризуйте мембранную систему митохондрий.
23. Что такое кристы митохондрий?
24. Что такое митохондриальный матрикс?
25. Какие органеллы клетки имеют собственные ДНК и рибосомы?
26. Что такое хлоропласта и чем они отличаются от хромопластов?
27. Что такое хромопласты и чем они отличаются от лейкопластов?
28. Что такое лейкопласты и чем они отличаются от хлоропластов?
29. Охарактеризуйте мембранную систему хлоропластов.
30. Что называется стромой пластидов?
31. В чем сходство и чем отличаются ламеллы стромы и тилакоиды?
32. Что такое граны и в чем их отличие от тилакоидов?
33. Что называется цитоскелетом клетки?
34. Что такое микрофиламенты и в чем их отличие от микротрубочек?
35. Что такое микротрубочки и в чем их отличие от актиновых нитей?
36. В чем отличие F-актина от G-актина?
37. Какой из концов актиновой нити при полимеризации растет с большей скоростью, "(+)" или "(—)"?
38. Какова роль кэпирующих белков в процессе полимеризации актина?
39. Полимером какого белка являются микротрубочки?
40. Как называется полимер, мономером которого является G-актин?
41. Перечислите главные функции цитоскелета.