Основы молекулярной биологии. Часть 1: Молекулярная биология клетки - А.Н. Огурцов 2011
Фотосинтетическая фиксация углерода
Регуляция фиксации углерода
В темноте ферменты, катализирующие реакции в цикле Кальвина, резко инактивируются, оставляя АТФ, которая синтезируется в темноте для других реакций, таких, как синтез липидов и аминокислот.
Одним из механизмов, обеспечивающих такую регуляцию, является pH-зависимость некоторых ферментов цикла Кальвина. На свету процесс транслокации протонов из стромы в тилакоиды в ходе переноса электронов усиливается, и pH стромы возрастает от ≈ 7 в темноте до ≈ 8 на свету. Это стимулирует активность некоторых ферментов цикла Кальвина, увеличивая уровень фиксации СО2 на свету.
Другим регулирующим фактором для некоторых ферментов цикла Кальвина является белок стромы тиоредоксин (Тх). В темноте в тиоредоксине между цистеинами на поверхности белка образуются дисульфидные связи, а на свету те электроны, которые переносятся с фотосистемы ФС1 посредством ферредоксина на тиоредоксин, восстанавливают атомы серы цистеинов (рисунок 189).
В свою очередь, восстановленный тиоредоксин так же точно активирует некоторые ферменты цикла Кальвина, разрушая дисульфидные связи на них, передавая им электроны и протоны - восстанавливая ферменты, - а сам при этом, окисляясь, вновь формирует дисульфидные мостики на своей поверхности. В темноте тиоредоксин так и остается окисленным и не может активизировать ферменты цикла Кальвина.
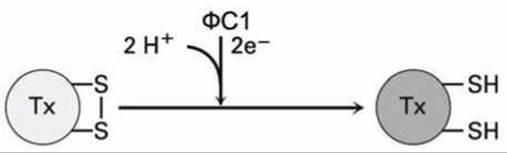
Рисунок 189 - Схема реакции восстановления на свету белка стромы тиоредоксина (Тх)
И, наконец, фермент рубиско активизируется в присутствии высокой концентрации СО2 и ионов Mg2+. Активизация происходит путем присоединения СО2 к лизину-191 и формирования карбаматной группы, а затем присоединения иона Mg2+. Однако при физиологических условиях для такой активации необходим ферментрубиско-активаза, который присоединяет СО2 к лизину за счет энергии гидролиза АТФ.