ПІДРУЧНИК ІМУНОЛОГІЯ - Меркьюрі Поділля 2013
ІМУНОЛОГІЧНІ МЕТОДИ ДОСЛІДЖЕНЬ
Лазерна проточна цитофлюориметрія
Принцип методу проточної цитометрії заснований на реєстрації світлорозсіювання і флюоресценції від кожної окремо взятої клітини в клітинній суспензії. На основі аналізу світорозсіювання (без застосування антитіл) в досліджуваному зразку можна визначити вміст лімфоцитів, моноцитів і гранулоцитів. Проточна цитометрія проводиться з використанням моноклональних антитіл, пов'язаних з флюоресцентними фарбниками, якими зафарбовують клітини крові. Моноклональні антитіла мають ідентичну специфічність до мембранних антигенів, тому вони згруповані і позначені відповідним номером кластера диференціювання (CD). Таким чином, використовуючи метод імунофлюоресценції (прямої або непрямої), можна визначити чисельність різних субпопуляцій лімфоцитів.
Серед найчастіше вживаних флуорохромів знаходяться наступні: флуоресцеїн ізотіоционат (FITC), фікоеритрин (PE, RD1), перидінінх лорофіл протеїн (Per - CP), алофікоціанін (APC), а також тандемні барвники (фікоеритріни Cy5 і Cy7).
Суспензія клітин під тиском подається в проточний осередок, де за рахунок різниці тисків між зразком і оточуючою рідиною клітини, знаходячись в ламінарному потоці рідини, вишиковуються в ланцюжок один за одним (гідродинамічне фокусування струменя в струмені). Клітини крові поодинці перетинають сфокусований лазерний світловий промінь. Світло певної довжини порушує молекули флуоресціюючих фарбників, пов'язаних з різними клітинними компонентами, при цьому може відбуватися одночасне збудження декількох різних фарбників, що дозволяє оцінити відразу декілька клітинних параметрів.
У момент перетину клітиною лазерного променя детектори фіксують:
✵ пряме (малокутове) світлорозсіювання (forward scatter) (рис. 3). Детектор прямого світлорозсіювання розташовується по ходу лазерного променя за проточним осередком і реєструє випромінювання лазера, яке розсіюється під кутами 2-19°. Інтенсивність розсіяного під малим кутом світла пропорційна розміру клітини. Більші клітини розсіюють світло сильніше за дрібних;

Рис. 3. Лазерна проточна цитометрія. Пряме (малокутове) світлорозсіяння (forward scatter) (пояснення у тексті)
✵ бічне світлорозсіювання (side scatter) (рис. 4). Промінь лазера, проходячи крізь клітину, багаторазово заломлюється і розсіюється на всі боки під кутом 10° і більше. Реєстрація цього випромінювання дозволяє оцінити внутрішню будову клітини (співвідношення ядро/цитоплазма, наявність гранул, інших внутрішньоклітинних включень). Комбінація бічного і прямого світлорозсіювання дозволяє судити про морфологію клітини в цілому, виділяти різні популяції клітин (лімфоцити, моноцити, гранулоцити) для подальшого аналізу;
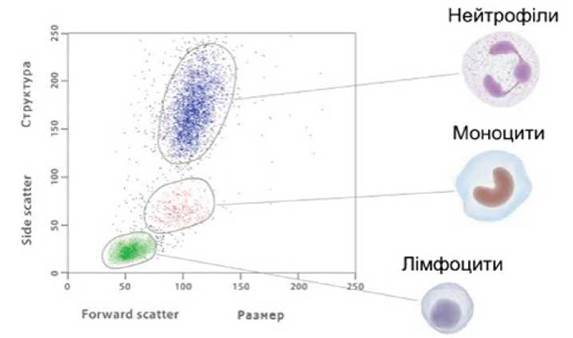
Рис. 4. Лазерна проточна цитометрія. Бічне світлорозсіювання (side scatter) (пояснення у тексті)
✵ інтенсивність флуоресценції, яка дозволяє визначати субпопуляційний склад клітинної суспензії та ін.
Система для реєстрації світіння флюоресцентних міток складається з комплексу світлофільтрів і фотопомножувачів, кожен з яких реєструє випромінювання в діапазоні довжин хвиль, що відповідають флуорохрому. Вибір типу і кількості флюоресцентних барвників визначається поставленою задачею для цього дослідження. Основними типами таких барвників є моноклональні антитіла, кон’юговані з флюоресцентною міткою (FITC, PE, APC, PerCP та ін.) для визначення мембранних і цитоплазматичних антигенів клітини, барвники, що дозволяють оцінити життєздатність клітин (7AAD, PI) флуорофори, що зв'язуються з нуклеїновими кислотами (DAPI, Hoechst), pH -чутливі флуорофори (Fluo - 3), іон-залежні флуорофори (Indo-1). Наприклад, антигени CD 3 виявляються за допомогою моноклональних антитіл ОКТ 3, ОКТ 1, Leu 4, де ОК - Onto Klon); антигени CD 4 - ОКТ 4 та Leu 2а; антигени CD 8 - ОКТ 8 та Leu 3 a; антигени CD 2 - ОКТ 11. Моноклональні антитіла ОКТ 6 виявляють антигени CD 1, ОКТ 9 та ОКТ 10 - на претимічних клітинах, на незрілих та активованих Т-лімфоцитах, моноклональні антитіла ОКВ 1 та Leu 12 - на зрілих В-лімфоцитах, ОКВ 2 - на молодих формах В-лімфоцитів, ОКМ 1 та Leu 7 - на моноцитах, гранулоцитах, натуральних кілерах.
Отриманий сигнал передається в комп'ютер, обробляється, і отримані дані відображуються у вигляді різних графіків і гістограм.
У проточному цитометрі, обладнаному системою для сортування клітин, проточний осередок закріплений на п'єзокристалі. При подачі на нього напруги кристал разом з осередком здійснює коливання із заданою частотою, внаслідок чого струмінь рідини з клітинами розбивається на окремі краплі. Проходячи крізь заряджаюче кільце, крапля може придбавати позитивний або негативний заряд залежно від того, яка клітина міститься усередині краплі. Пролітаючи повз пластини, що відхиляють, крапля з клітиною притягується до них, виходить з основного потоку і потрапляє в пробірку. Метод сортування клітин на проточному цитометрі дозволяє отримати популяції клітин з високою чистотою (до 99.9% позитивних клітин) у відсортованій фракції.
Метод розеткоутворення. Визначення Т-лімфоцитів методом спонтанного розеткоутворення з еритроцитами барана (Е-РУК). Тимусзалежні Т-лімфоцити мають рецептори для еритроцитів барана (Е-рецептори ідентичні CD2, що виявляється моноклональними антитілами), які виступають специфічним маркером для їх розпізнавання (Е-РУК: Erythrocyte - розеткоутворюючі клітини).
Хід виконання дослідження. В пластикові пробірки (від 2 до 5) вносять 0,1 мл суспензії лімфоцитів і додають рівний об'єм 0,5% суспензії еритроцитів барана. Співвідношення еритроцити:лімфоцити не повинне перевищувати 50:1. Інкубують суміш в термостаті 37°С впродовж 10 хв. Потім проби центрифугують 5 хв. при 1000 об/хв. і залишають на ніч в холодильнику при температурі 4 °С. Підрахунок клітин проводять в камері Горяєва. Суспензію клітин фіксують глютаровим альдегідом або ацетальдегідом з наступним приготуванням мазків і прорахунком розеток в забарвлених препаратах, що дозволяє накопичувати скло і аналізувати результати реакцій в будь-який інший день.
Для прорахунку клітин в камері Горяєва осад клітин у витягнутих з холодильника пробірках обережно ресуспендують пастерівською піпеткою (кілька разів повільно набирають і випускають клітинну суспензію) і додають 0,02 мл 0,01 % розчину у фосфатному буфері акридінового помаранчевого. Цей барвник дає яскраво-зелену люмінесценцію при збудженні ультрафіолетом. Через 2-3 хв. заповнюють камеру Горяєва і визначають відсоток Е-РУК шляхом підрахунку 300 лімфоцитів в люмінесцентному мікроскопі.
В день узяття крові на Т-лімфоцити необхідно проводити загальний аналіз крові, який дає можливість вираховувати абсолютні значення Т-клітин.
Нормальні величини Т-клітин у здорових донорів: 54,3+0,98 %; 979,8+16,8 кл/мкл.
Визначення активних Т-лімфоцитів, що утворюють розетки з еритроцитами барана (ЕА-РУК). Усі підготовчі операції виконують так, як це описано для Е-РУК, за винятком сироватки, яку при визначенні ЕА-РУК не додають в інкубаційне середовище, і тривалої холодової інкубації. Після термостатування 10 хв. при 37 °С і наступного центрифугування при 1000 об/хв. впродовж 5 хв. проводять підрахунок Т-активних лімфоцитів способом, описаним вище.
Вміст Т-активних лімфоцитів у здорових донорів складає: 34,6+1,92 %, 840+123 кл/мл
Визначення теофілинчутливих Т-клітин. У присутності теофіліну Т-лімфоцити з супресорною функцією втрачають здатність до Е-розет- коутворення. Такі клітини дістали назву теофілінчутливих (ТЧ), аналог CD8 Т-супресорів. Так звані теофілінрезистентні (ТР) клітини в значному відсотку випадків містять субпопуляцію CD4 Т-хелперів. Показник ТР/ТЧ в нормі складає 2,5-3,5.
Хід виконання дослідження. Реактиви і устаткування, використовували були аналогічні для описаного вище методу визначення Т-активних лімфоцитів. Перед постановкою методу готують 0,3 М розчин теофіліну на дистильованій воді, підігрітій до 60 °С. Охолоджений до кімнатної температури розчин теофіліну додають в інкубаційне середовище (без додавання сироватки), термостатують, центрифугують при 1000 об/хв. впродовж 5 хв. і прораховують клітини так само, як і Т-активні. Виявляють 2 субпопуляції: теофілінчутливі Т-клітини, тобто лімфоцити, що втратили здатність до розеткоутворення під впливом обробки теофіліном, і теофілінрезистентні Т-клітини.
У здорових донорів співвідношення теофілін-чутливих і стійких Т- клітин складає 1:3.
Виявлення Т-лімфоцитів, що утворюють розетки з алогенними і аутологічними еритроцитами. Т-клітини, що утворюють розетки з аутоеритроцитами, як вважають, несуть кілерну функцію і грають основну роль в механізмах аутоагресії.
Хід виконання дослідження. Суспензію лімфоцитів виділяють вже описаним вище методом. Еритроцити людини: необхідно використовувати еритроцити 0(1) груп крові резуснегативні. Приготування еритроцитів аналогічно описаному методу для еритроцитів барана. До суспензії лімфоцитів в тих же співвідношеннях додають одночасно еритроцити барана і еритроцити людини. Підраховують лімфоцити, що зв'язали еритроцити і барана, і людини. Реакцію з аутологічними еритроцитами проводять так само, як з алогенними.
Визначення В-клітин методом розеткоутворення з еритроцитами барана в системі ЕАС.
Тимуснезалежні В-лімфоцити мають на своїй мембрані специфічні детермінанти, що дозволяють диференціювати їх від тимус-залежних, тобто Т-лімфоцитів. Такими детермінантами є поверхневий (мембранний) IgМ, рецептори для Fc -фрагмента IgG, третього компонента комплементу (С3) і вірусу Епштейна-Бара. Число лімфоцитів, що несуть IgA, G, Е або D, незначне (IgА - 1-5 %, IgD і IgЕ - 2-4 %). Застосовується метод виявлення В-клітин по їх здатності утворювати розетки з баранячими еритроцитами, навантаженими антитілами в середовищі комплементу. Такі еритроцити маркірують рецептори для Fc і С3 В-лімфоцитів.
Прилади і реактиви ті ж, що і для методу визначення Т-лімфоцитів. Аналогічно готують і суспензію лімфоцитів.
Хід виконання дослідження. Антисироватку, що містить антитіла до еритроцитів, готують шляхом імунізації кролика еритроцитами барана або бика. Кролику в крайову вену вуха вводять 3-5 мл 50% суспензії еритроцитів. На 4-6-й день у нього беруть кров і отримують сироватку, яка в цей період на висоті імунної відповіді переважно містить IgМ. Найкращий ефект отримують при роботі з гама-глобуліновою фракцією сироватки, яку отримують висолюванням в насиченому розчині аміаку або ріванолу. Антисироватку інактивують і визначають її гемолітичний і аглютинаційний титр. Можна використовувати готову кролячу гемолітичну сироватку.
Комплемент. Джерелом комплементу служать свіжі сироватки мишей. Безпородних мишей декапітують, кров зливають в пробірку, отримують сироватку, яку потім сорбують пулом людських еритроцитів і визначають активність комплементу в гемолітичній системі.
Сенсибілізація еритроцитів. Змішують рівні об'єми 1% суспензії баранячих еритроцитів (чи еритроцитів бика) і антисироватки до виду еритроцитів, що використовують в реакції (чи кролячої гемолітичної сироватки) в субаглютинуючому розведенні. Суміш інкубують 40 хв. при 37 °С, обережно струшуючи кожні 10 хв. Після термостатування еритроцити тричі відмивають фосфатним буфером до 10 хв. при 1500 об/хв. Супернатант відкидають, а до осаду додають первинний об'єм фосфатного буфера і рівний об'єм абсорбованої мишачої сироватки, що містить комплемент в розведенні 1:10. Суміш поміщають в термостат при 37 °С на 30 хв. Знову еритроцити тричі відмивають. При відмиванні їх центрифугують обережно при 1000 об/хв. 5 хв., щоб не викликати аглютинації еритроцитів. Готують 0,5% суспензію еритроцитів і переглядають під мікроскопом. За наявності аглютинації еритроцитів суспензія непридатна. Готові еритроцити, навантажені антитілами і комплементом (ЕАС), можна зберігати в холодильнику (4 °С) 4-5 днів.
Визначення ЕАС лімфоцитів. До 0,1 мл суспензії лімфоцитів додають 0,1 мл сенсибілізованих еритроцитів. Оптимальне співвідношення еритроцитів до лімфоцитів рівне 20:1. Суміш інкубують 45 хв. при 37 °С, після чого пробірки поміщають в лід. Підрахунок В-клітин проводять описаним вище способом.
Абсолютна кількість В-лімфоцитів в нормі складає 0,28 - 0,31х106 /л).
Клінічне значення. Підвищення абсолютної кількості В-лімфоцитів спостерігається при: гострих бактеріальних, грибкових, паразитарних захворюваннях, СНІД (початковий період), хронічних захворювання печінки (цироз, вірусний гепатит), автоімунних захворюваннях (ревматоїдний артрит, СЧВ, ревматизм, колагенози), саркоїдозі, муковісцидозі, хворобі Крона, хворобі Вальденстрема, моноклональній гамапатії, інфекційному мононуклеозі, хронічному лімфолейкозі, в гострому періоді повторної інфекції.
Зниження абсолютної кількості В-лімфоцитів спостерігається при: фізіологічній гіпогамаглобулінемії у дітей (у віці 3-5 міс), вродженій гіпогамаглобулінемії або агамаглобулінемії, новоутвореннях імунної системи, лікуванні цитостатиками і імунодепресантами, станах після видалення селезінки, недостатності гуморальної ланки імунітету.