ПІДРУЧНИК ІМУНОЛОГІЯ - Меркьюрі Поділля 2013
ІМУНОЛОГІЧНІ МЕТОДИ ДОСЛІДЖЕНЬ
Функціональні тести
Реакція бласттрансформаціїлімфоцитів (РБТЛ). Принцип методу. Під впливом неспецифічних і специфічних стимулів лімфоцити перетворюються на бласти - великі пиронінофільні клітини, здатні до проліферації і подальшого диференціювання, що приводить до збільшення в лімфоїдній тканині кількості реагуючих клітин. Це явище називають бласттрансформацією, яка постійно спостерігається в лімфоїдних тканинах в результаті антигенної стимуляції.
Відомі речовини, що чинять на лімфоцити мітогенну дію (табл. 12). Частіше для оцінки функціонального стану Т-лімфоцитів в клінічній лабораторній практиці використовують фітогемаглютинін (ФГА) - рослинний лектин, що отримується з насіння квасолі.
Таблиця 12. Деякі неспецифічні мітогени лімфоцитів
Мітоген |
Походження |
Мішень |
ФГА |
Phaseolus vulgaris |
Т-лімфоцити |
Кон А |
Canavalia ensiformis |
Т-лімфоцити |
Мітоген лаконоса MA(PWM) |
Phytolacca americana |
В-лімфоцити в присутні Т-клітин |
Ліпополісахарид грампозитивних бактерії (ЛПС) |
E. coli, S. typhi, N. men-ingi-tidis и др. |
В-лімфоцити |
Фітогемагглютинін (ФГА) викликає трансформацію T-лімфоцитів, а ліпополісахарид (ЛПС) Е. coli - B-лімфоцитів в бласти в культурі клітин.
Хід виконання дослідження. У стерильну пробірку наливають 0,5 мл розчину гепарину, що містить 50 Од/мл. Кров беруть з вени у кількості 2 мл.
Фітогемагіпотенін (ФГА) та ліпополісахарид (ЛПС) Е. coli використовують в концентрації 0,1 мг/мл.
У 6 стерильних флаконів наливають по 2 мл середовища 199 та додають розчини пеніциліну і стрептоміцину з розрахунку 100 Од/мл кожного антибіотика. Флакони струшують і поміщають в холодильник. Готують 2 флакони для спонтанної РБТЛ (контроль). В 2 флакони додають по 0,05 мл розчину ФГА в концентрації 0,01 мг/мл культури (стимулююча доза 25 мкг/мл). Ще в 2 флакони додають 0,05 мл розчину ЛПС Е. coli в концентрації 0,01 мг/мл культури (стимулююча доза 25 мкг/мл). В усі флакони вносили по 0,2 мл крові. Флакони поміщають на 3 доби в термостат при 37оС. Щодня флакони струшували. Потім вміст кожного флакону переливають в центрифужні пробірки і центрифугують 5 хв. при 3000 об/хв. Осад ресуспензують повітрям і готують по 2 мазки на кожен флакон. Мазки фіксують, забарвлюють азуреозином по методу Романовського.
Мазки мікроскопують під імерсійним об'єктивом. Підрахунок відсотка бласттрансформації лімфоцитів роблять таким чином: на загальну кількість лімфоцитів (100 клітин) підраховують кількість середніх лімфоцитів і бластів. Результат РБТЛ визначають у відсотках бласттрансформації лімфоцитів (%).
Клінічне значення. Спонтанна проліферація лімфоцитів (бласттранс-формація) буває підвищена у хворих, що перенесли багатократні переливання крові, хворих алергічними і автоімунними захворюваннями, при бактерійних і вірусних інфекціях, а також у новонароджених.
Зниження проліферативної відповіді на ФГА свідчить про наявність імунодефіциту. Низька відповідь в РБТЛ може корелювати з дефіцитом Т-клітин в периферичній крові або із зміною показника CD4/CD8 на користь клітин-супресорів. В деяких випадках (наприклад, в період відновлення після опромінення або інтенсивної хіміотерапії) низька відповідь на Т-клітинні мітогени може бути пов'язана з викидом в периферичну кров великої кількості незрілих Т-клітин. Низька відповідь в РБТЛ може бути також обумовлена порушенням продукції таких лімфокінів як ІЛ-1 I ІЛ-2.
Реакція гальмування міграції лейкоцитів в прямому капілярному тісті. Рухливість лейкоцитів периферичної крові, їх міграція до вогнищ тканинної деструкції, хемотаксис до ауто- і гетероантигенів, перерозподіл між лімфоїдними органами при стресово-адаптивних реакціях є складовою компонентою загальної системи реактивності, здібності до збереження постійності внутрішнього середовища.
Сенсибілізовані до певного антигену лімфоцити різко знижують швидкість рухливості в середовищі, в яке вносять антиген. Реакція гальмування міграції лейкоцитів (РГМЛ) здійснюється при безпосередній взаємодії антигену з антигенспецифічними рецепторами, а також через дію чинника, що пригнічує міграцію клітин, який виділяється при контакті із специфічним антигеном. Цей феномен дозволяє продемонструвати органоспецифічну клітино-опосередковану гіперчутливість.
Хід виконання дослідження. У 6 лунок планшета для імунологічних досліджень наливають по 0,2 мл досліджуваної гепарізованої крові (25 Од гепарину на 1 мл крові). Перші 2 лунки складають контроль. У інші
2 лунки вносять по 0,05 мл розчину ФГА в концентрації 0,01 мг/мл культури (дослід 1). У 2 лунки, що залишилася, вносять по 0,05 мл розчину антигену, наприклад лікарського препарату (дослід 2). Концентрацію антигену, що вноситься, розраховують експериментально і виражають в мг/мл Отриманими сумішами заповнюють капіляри з внутрішнім діаметром 0,7 мм і завдовжки 12 см на 1/3 довжини (до мітки, яку заздалегідь наносять на відстані 1/3 довжини від будь-якого краю). На кожен контроль і досвід використовують по 2 капіляри.
Заповнені капіляри запаюють воском або пластиліном і поміщають в маркіровані центрифужні пробірки. Капіляри в пробірці необхідно зафіксувати грудочкою вати або пластиліном в строго вертикальному положенні. Після цього капіляри центрифугують впродовж 5 хв. при 800 об/хв., а потім поміщають в термостат у вертикальному положенні і інкубують при температурі 37 °С впродовж 24 год.
Облік результатів. Після інкубації роблять облік результатів. З цією метою під мікроскопом за допомогою окуляр-мікрометра визначають величину міграції основної маси лейкоцитів від межі еритроцитарного осаду в контролі і дослідах. Результати виражають у вигляді відсотка міграції у досвіді відносно контролю.
У нормі відсоток міграції складає 40-70%; підвищення до 90% або зниження до 30% є помірним; вище 90% і нижче 30% - значним.
Клінічне значення. Збільшення показника міграції свідчить про зниження функціональної активності лімфоцитів : їх здібності продукувати цитокіни. Виявлення сенсибілізованих до певного антигену лімфоцитів говорить про участь цього антигену в розвитку специфічної гіперчутливості і може бути використано в діагностиці пухлин, гломерулонефриту, диференціальній діагностиці міокардиту і кардіопатій.
РГМЛ використовують для оцінки гіперчутливості уповільненого типу (ГУТ), оскільки вона за своєю суттю є пробірним аналогом клітинних імунних реакцій ГУТ. У якості речовин, що модулюють (гальмують або активують) спонтанну міграційну активність лейкоцитів, застосовують ті ж мітогени, що і при РБТЛ. Крім того, можуть бути використані тканинні і мікробні антигени, стандартні алергени. Останні застосовують при діагностиці саркоїдозу, туберкульозу, альвеолітів і інших захворювань, що протікають з утворенням епітеліоїдно-клітинних гранулем (тканинні прояви ГУТ).
Тести навантажень з лікарськими та іншими речовинами. Зазвичай застосовують інкубацію клітин протягом певного часу з невеликими дозами, близькими до фізіологічних кількостей препаратів або без них. Тести ставлять з лікарськими препаратами, зокрема імунокоригуючими (тималін, левомізол і ін.) для того, щоб, визначивши дію препарату на клітини, прогнозувати ефективність його застосування при лікуванні.
У розеткоутворенні найчастіше використовуються наступні тести навантаження:
1) інкубація клітин при 37оС протягом 0,5-2 год.;
2) інкубація клітин протягом того ж часу з розчинами різних препаратів в концентраціях, близьких до фізіологічних, наприклад з левамізалом, теофіліном, Т-активіном, іншими імунокоригуючими препаратами;
3) інкубація клітин з різними дозами цих же препаратів.
Активацію T-лімфоцитів зазвичай оцінюють за наступними показниками:
✵ проліферація;
✵ вироблення цитокінів - інтерлейкінів-2 -4, -5, інтерферону- 0, чинника некрозу пухлин;
✵ експресія маркерів активації - CD25 і антигенів HLA класу II;
✵ цитотоксичність.
Дослідження функціональної активності фагоцитів. Виділення лейкосуспензії для постановки реакції фагоцитозу і нітросинього тетразолієвого тесту здійснюють з гепаринізованої крові.
Матеріали і устаткування: 10 % розчин медичного желатину; гепарин; середовище 199 або розчин Хенкса; 0,83 % розчин хлористого амонія; центрифуга з бакет-ротором; термостат; мікроскоп; камера Горяєва; силіконізовані пробірки.
Опис методу. Венозну кров в об'ємі 2-3 мл набирають в пробірку з гепарином в співвідношенні 10-20 Од гепарину на 1 мл крові. У кров додають 10 % розчин желатину в пропорції - на 1 мл крові 0,1 мл желатину і поміщають в термостат на 30-40 хв. при 37 °С. Після відстоювання надосад, що складається з лейкосуспензії вносять в окрему пробірку і додають 0,83 % розчин хлористого амонія для лізування домішки еритроцитів. Далі лейкосуспензію тричі відмивають середовищем 199 або розчином Хенкса в центрифузі по 5-10 хв. при прискоренні 100-200 g (500-1500 об/хв.). Осад лейкоцитів ресуспендуют в середовищі 199 і доводять концентрацію до 5х106 в мл Усі маніпуляції з клітинами з метою скорочення втрат роблять в силіконізованому посуді.
Дослідження фагоцитарної активності лейкоцитів крові.
Матеріали і устаткування: монодисперсні частки латексу; метанол; фарба по Романовському-Гімзе; предметне скло; пластикові планшети для імунологічних реакцій.
Опис методу. В силіконізовані пробірки або планшети поміщають 0,1 мл лейкосуспензії і додають 0,2 мл монодисперсних часток латексу в концентрації 5х103 /мл. Оптимальне співвідношення кількості клітин і часток латексу складає 1:100. Суміш перемішують і поміщають в термостат на 30 хв. при температурі 37°С. Після інкубації тричі відмивають середовищем 199 і готують препарат.
Мазки готують, на ретельно вимитих знежирених предметних стеклах. Краплю лейкосуспензії поміщають недалеко від краю скла і шліфованим предметним склом, поставивши його під кутом 45° до поверхні попереду краплі і почекавши, поки крапля рівномірно розподілиться уздовж його ребра, легким швидким рухом проводять вперед, не відриваючи від предметного скла раніше, ніж вичерпається уся крапля. Правильно зроблений мазок має рівномірно матовий відтінок, не досягає країв скла і закінчується загостреними язичками. Приготовані мазки сушать на повітрі, потім фіксують 10 хв. в абсолютному метиловому спирті і фарбують по Романовському-Гімзе азур-еозином.
Склад готового барвника: азур II - 3 г, водорозчинний жовтий еозин - 0,8 г, метиловий спирт - 250 мл і гліцерин - 250 мл Для забарвлення мазків беруть 2 краплі основного розчину барвника на 1 мл дистильованої води.
Можна готувати фарбу безпосередньо перед фарбуванням мазків з азура II, еозину і дистильованої води в співвідношенні 3:2:5. На один мазок нашаровують 3 мл розчину барвника. Тривалість забарвлення 4550 хв. Після фарбування мазки переглядають під мікроскопом в імерсійній системі (вважають не менше 200 клітин) і роблять розрахунок показників фагоцитозу.
1. Фагоцитарний індекс (ФІ) - відсоток клітин, що вступили у фагоцитоз, від загального їх числа. У нормі складає 65-95 %.
2. Фагоцитарне число (ФЧ) - середнє число частинок латексу, що знаходяться внутрішньоклітинно (частка від ділення загального числа поглинених частинок лактексу на число клітин, що вступили у фагоцитоз). Характеризує поглинальну здатність нейтрофілів. У нормі складає 5-10.
Клінічне значення. Вивчення показників фагоцитозу має значення в діагностиці імунодефіцитних станів: часто рецидивуючі гнійні запальні процеси, рани, що тривало не загоюються, схильність до післяопераційних ускладнень. Показники фагоцитозу допомагають в діагностиці вторинних імунодефіцитних станів, викликаних лікарською терапією. У зв'язку з тим, що фагоцити беруть участь в елімінації імунних комплексів і активність фагоцитозу тісно пов'язана з активністю компонентів комплементу, а саме С3, концентрацією IgG антитіл, наявністю інших опсонуючих чинників, дослідження фагоцитозу відіграє роль в діагностиці, оцінці активності і ефективності терапії при ревматизмі та інших хворобах сполученої системи. Найбільш інформативним для оцінки фагоцитарної активності слід рахувати фагоцитарне число, коефіцієнт фагоцитарного числа, які відбивають завершеність фагоцитозу.
Фагоцитарна активність нейтрофілів звичайно підвищується на початку розвитку запального процесу. Її зниження призводить до хронізації запального процесу та підтримання автоімунного процесу, тому що при цьому порушується функція руйнування та виведення циркулюючих імунних комплексів із організму.
Підвищення показників спостерігається при: антигенному подразненні внаслідок бактеріального запалення (продромальний період, період гострого прояву інфекції) при нормальній активності фагоцитозу; лейкоцитозі; алергічних реакціях; автоімунних захворюваннях; посиленні антитілозалежної цитотоксичності та реакції на донорський трансплантат.
Зниження показників спостерігається при: хронічних запальних захворюваннях бактеріальної та вірусної природи; вроджених дефектах фагоцитарної системи, синдромі Чедіака-Хігасі, хворобі Дауна, СЧВ, хворобі імунних комплексів, гранулематозі, дефіциті імуноглобулінів, комплементу; лікуванні цитостатиками, імунодепресантами, опроміненням іонізуючою радіацією; вторинних та первинних імунодефіцитах; новоутвореннях; тяжких опіках, травмах, стресах; кишкових та ниркових синдромах втрати білку; недостатності харчування; недостатності фагоцитозу; хронізації запального процесу.
НСТ-тест - тест відновлення нітросинього тетразолія. Спонтанний тест з НСТ (нітросинім тетразолієм) дозволяє оцінити стан киснево-залежного механізму бактерицидності фагоцитів (гранулоцитів) крові in vitro. Він характеризує стан і ступінь активації внутрішньоклітинної НАДФ-Н-оксидазної антибактеріальної системи.
Принцип методу ґрунтується на відновленні поглинутого фагоцитом розчинного барвника нітросинього тетразолію (НСТ) в нерозчинний діформазан під впливом супероксиданіону, що утворюється в НАДФ-Н-оксидазній реакції, яка ініціює процес стимуляції фагоциту. До фагоцитів додають жовтий фарбник нітросиній тетразолій, в нормі при його поглинанні метаболічна активність фагоцитів зростає, нітросиній тетразолій відновлюється, диформазан у вигляді грубодисперсних темносиніх гранул відкладається усередині або на поверхні клітин і продукти цієї реакції забарвлюють фагоцит у синій колір.
Матеріали і устаткування: 0,2 % розчин нітросинього тетразолію; 2 % водний розчин метилового зеленого; водяна баня; метанол; предметні стекла; силіконізовані пробірки.
Опис методу. Для постановки НСТ-тесту до 0,1 мл лейкосуспензії додають 0,1 мл 0,2 % нітросинього тетразолію. Суміш інкубують на водяній бані при температурі 37°С впродовж 25 хв. і при кімнатній температурі впродовж 15 хв. Далі клітини тричі відмивають середовищем 199 і готують препарати. Висушені препарати фіксують метанолом і забарвлюють 2 % водним розчином метилового зеленого від 30 с до 5 хв.
Облік реакції включає підрахунок відносної і абсолютної кількості диформазан-позитивних лейкоцитів (можливо для спеціальних досліджень розрахунок робити окремо для нейтрофілів і моноцитів), обчислення середнього цитохімічного коефіцієнта реакції (СЦК). Для визначення СЦК при обліку реакції відмічають диформазан-негативні клітини - 0 міра активності; клітини з одиничними гранулами диформазану або з площею забарвленою диформазаном до 25-30 % - 1 міра активності; клітини, цитоплазма яких на 30-70 % зайнята глибками диформазану - 2 міра активності; клітини, у яких більше 70 % цитоплазми містить гранули диформазану - 3 міра активності. У кожному препараті підраховують 300 лейкоцитів. Середній цитохімічний коефіцієнт розраховують за формулою:
![]()
де 0, 1, 2, 3 - ступінь активності відновленого диформазану;
a, b, c, d - кількість клітин кожної ступені активності відповідно. Визначають рівень спонтанного (базального) та стимульованого латексом НСТ-теста: 0,1 мл гепаринізованої крові та 0,1 мл 0,1% водного розчину НСТ інкубують в конічних пробірках при температурі 37oС на протязі 40 хв. з 0,1 мл середи 199 - спонтанний НСТ-тест, або з 0,1 мл суспензії латексу - стимульований частками латексу НСТ-тест.
Клінічне значення. Спонтанний НСТ-тест дозволяє оцінити ступінь антигенного подразнення не активованих in vitro гранулоцитів крові. Він характеризує ступінь активації внутрішньоклітинних антибактеріальних систем. Про порушення метаболізму фагоцитів судять по зниженню інтенсивності синього фарбування. При виявленні порушень визначають рівень цитохрому b558 та інших білків фагоцитів. Показники НСТ-тесту підвищуються в початковому періоді гострих бактеріальних інфекцій, тоді як при хронічному перебігу інфекційного процесу вони знижуються. Санація організму від збудників супроводжується нормалізацією показника. Різке зниження свідчить про декомпенсацію протиінфекційного захисту та є прогностично несприятливою ознакою. Показник спонтанного НСТ-тесту в нормі складає до 10 %.
НСТ-тест відіграє важливу роль в діагностиці хронічних гранулематозних захворювань, які характеризуються наявністю дефектів в НАДФ-Н-оксидазному комплексі. Для пацієнтів з хронічними гранульоматозними захворюваннями характерна наявність рецидивуючих інфекцій (пневмонія, лімфаденіт, абсцеси легенів, печінки, шкіри), що викликаються Staphylococcus aureus, Klebsiellaspp., Candida albicans, Salmonella spp., Escherichia coli, Aspergillus spp., Pseudomonas cepacia, Mycobacterium spp. і Pneumocystis carinii.
Нейтрофіли у пацієнтів з хронічними гранульоматозними захворюваннями мають нормальну фагоцитарну функцію, але внаслідок дефекту в НАДФ-Н-оксидазному комплексі не здатні знищувати мікроорганізми. Спадкові дефекти НАДФ-Н-оксидазного комплексу у більшості випадків зчеплені з хромосомою X, рідше аутосомно-рецесивні.
Підвищення показників спостерігається при: антигенному подразненні внаслідок бактеріального запалення (продромальний період, період гострого прояву інфекції) при нормальній активності фагоцитозу; хронічному гранулематозі; лейкоцитозі; алергічних реакціях; автоімунних захворюваннях; посиленні антитілозалежної цитотоксичності.
Зниження показників спостерігається при: хронічних запальних захворюваннях бактеріальної та вірусної природи; хронізації гострого запального процесу, вроджених дефектах фагоцитарної системи, синдромі Чедіака-Хігасі, хворобі Дауна, СЧВ, колагенозах, хворобах імунних комплексів, дефіциті імуноглобулінів, комплементу; лікуванні цитостатиками, імунодепресантами, опроміненням іонізуючою радіацією; вторинних та первинних імунодефіцитах, злоякісних новоутвореннях, тяжких опіках, травмах, стресах; недостатності фагоцитозу.
Індукований НСТ-тест дозволяє оцінити функціональний резерв кисеньзалежного механізму бактерицидності фагоцитів. Тест використовують для виявлення резервних можливостей внутрішньоклітинних систем фагоцитів. При збереженій внутрішньоклітинній антибактеріальній активності у фагоцитах різко зростає кількість формазан-позитивних нейтрофілів після їх стимуляції латексом. Зниження показників стимульованого НСТ-тесту нейтрофілів нижче за 40 % та моноцитів нижче за 87 % свідчать про недостатність фагоцитозу. Величина стимульованого НСТ-тесту в нормі складає 20-40 %.
Визначення імуноглобулінів IgA, IgM, IgG імуноферментним методом. Принцип методу оснований на виявлені в сироватці крові імуноглобулінів A, M, G за допомогою специфічних антиглобулінових кон’югатів (анти-A, анти-M, анти-G). Компоненти, що не зв’язалися, відмиваються, активність ферменту в складі імунних комплексів визначають за допомогою субстрат-хромогенної суміші. Інтенсивність зафарбовування хромогену зворотно-пропорційна кількості антитіл в зразку.
Склад набору: 1. Планшет полістироловий з іммобілізованим антигеном (1-4 стрипи - Ig A, 5-8 - IgM, 9-12 - IgG) (1 шт.); 2. Фосфатно-сольовий буфер (ФСБ), 30 мл (1 фл.); 3. Стандартний зразок, 30 мкл (1 уп.); 4. Кон’югати, мічені пероксидазою (анти-A, анти-M, анти-G) (1 набір); 5. Цитратно-фосфатний буфер, 1.5 мл (1 фл.); 6. Розчин субстрату, 1.5 мл (1 фл.); 7. Зупиняючий розчин, 11 мл (1 фл.).
Досліджуваний матеріал. Використовують свіжу, вільну від домішок сироватку. Зберігають зразки не більше 72 годин при +2 - (+10)°С. Довгострокове зберігання допускається в замороженому вигляді при температурі мінус 20°С. Повторні замороження та розтавання не рекомендуються. Використання гемолізованих та ліпідемічних зразків не рекомендуються.
Підготовка реагентів
1. Перед постановкою дослідження набор витримують при кімнатній температурі протягом 30 хвилин.
2. Готують необхідну кількість розчину ФСБ, для чого розводять його в 10 раз дистильованою водою. При випаданні солі в осад в концентраті необхідно прогріти його при 30-40°С до повного розчинення осаду. Приготовлений розчин використовують для розведення сироваток, кон’югату та промивання планшетів. Отриманий розчин стабільний протягом 2-х діб при кімнатній температурі чи 10 діб у холодильнику (+2 - (+10)°С).
3. Підготовка стандартного та досліджуваних зразків: перед дослідженням стандарт та сироватки розводять ФСБ в 200 разів (5 мкл в 1 мл).
4. Підготовка робочих розчинів кон’югату: анти А-ПХ - 20 мкл кон’югату розводять у 5 мл ФСБ; анти М-ПХ - 100 мкл кон’югату розчиняють у 5 мл ФСБ; анти G-ПХ - 50 мкл кон’югату розводять у 5 мл ФСБ (ПХ - пероксидаза хріну).
При постановці реакції тільки на частині планшету кількість розчину кон’югату зменшується пропорційно. Робочий розчин кон’югату готують безпосередньо перед використанням!
5. Підготовка субстратної суміші: до 9 мл дистильованої води добавляють 1 мл цитратно-фосфатного буферу та 1 мл розчину субстрата. При постановці реакції тільки на частині планшету кількість субстратної суміші зменшується пропорційно. Робочий розчин субстратної суміші готують безпосередньо перед використанням!
Проведення дослідження:
1. Внести в лунки по 100 мкл розчину ФСБ (холосте випробування), стандартного та досліджуваних зразків в 2-х повторах.
2. Внести по 100 мкл відповідних кон’югатів.
3. Інкубувати стрипи 60 хв. при кімнатній температурі, періодично струшуючи або на шейкері.
4. Промити планшет 4-5 разів ФСБ, добавляючи в лунки по 250 мкл розчину.
5. Внести по 100 мкл субстратної суміші.
6. Інкубувати в захищеному від світла місці 15-20 хвилин в залежності від ступеню розвитку окрасу.
7. Внести по 100 мкл зупиняючого розчину.
8. Не більше як через 5 хвилин виміряти оптичну щільність на аналізаторі імуноферментному при довжині хвилі 450 нм.
Оцінка результатів дослідження. Вимірюють оптичну щільність (ОЩ) в усіх лунках і проводять розрахунки, використовуючи зворотньо-пропорційну залежність:
![]()
де ОЩст - оптична щільність стандартного зразку, Сст - концентрація імуноглобуліну в ньому, ОЩх - оптична щільність досліджуваного зразку, Сх - концентрація імуноглобуліну в досліджуваному зразку.
Вміст імуноглобулінів в стандартному зразку: IgA - 2,31 г/л, IgM - 1,29 г/л, IgG - 11,49 г/л.
Очікувані коливання ОЩ стандартного зразку для Ig A не нижче 0,3 оптичних одиниць (ОО), Ig M не нижче 0,3 ОО, Ig G не нижче 0,3 ОО.
Нормальні показники. Ґрунтуючись на результатах досліджень, проведених лабораторіями, рекомендуємо користатися нормами, приведеними нижче. Концентрація імуноглобулінів в нормі:
Ig A - 1,25 - 2,5 г/л, Ig M - 0,65 - 2 г/л, Ig G - 7,5 - 18 г/л.
Вимоги безпеки: 1. Набор призначений тільки для діагностики in vitro. Категорично забороняється піпетування ротом. 2. Засобами індивідуального захисту при роботі з наборами є марлеві пов’язки та гумові рукавички. Знезараження сироваток проводити згідно з наказом МОЗ СРСР № 408 від 29.12.89 р. «О мерах по снижению заболеваемости вирусными гепатитами в стране».
Умови транспортування та зберігання: 1 Набори транспортують всіма видами закритого транспорту при температурі від +2 до +10 °С. Допускається транспортування при температурі до +37 °С не більше 72 годин. 2 Набори повинні зберігатися при температурі від +2 до G10 °C. Не допускається замороження!
Гарантійний термін зберігання становить 6 місяців від дня виготовлення набору. Після закінчення терміну зберігання набори підлягають повторному контролю якості.
Термін придатності стрипів після розкриття пакету становить 1 місяць при температурі +2 - (+10) °С. Невикористані стрипи зберігають у щільно закритому пакеті. Перед постановкою дослідження набор витримують при кімнатній температурі протягом 30 хв.
Кількісне визначення імуноглобулінів методом радіальної імунодифузії по Манчіні. Принцип методу. Визначення IgA, IgM, IgG методом радіальної імунодифузії в гелі агарози по Mancini et alзасновано на тому, що зразки досліджуваних сироваток вміщують у лунки агару, який містить антитіла до Ig одного з класів IgA, IgM, IgG у відомій концентрації. Імуноглобуліни, дифундуючи з лунок в агар, при взаємодії з відповідними антитілами будуть утворювати кільця преципітації, розмір яких знаходиться в тісній залежності від вмісту в сироватці обстежуваного Ig того чи іншого класу.
Матеріали і устаткування: 1. Скляні пластини 9х12 см 2. П-образна рамка 120х90х8 мм для полегшення заливки скла агаром. 3. Водяна баня на 50-60 °С. 4. Пастерівські піпетки з відтягнутим кінцем. 5. Волога камера. 6. Вимірник. 7. Калібрувальна лінійка. 8. Комерційні набори для визначення концентрації імуноглобулінів. 9. 0,2 М вероналовий буфер. 10. Реактив для забарвлення преципітату. 11. Пробійник круглий діаметром 1.5-2.0 мм для вирізання лунок в гелі агарози.
Опис методу. Приготування вероналового буферу: 1,84 г вероналу і 0,34 г їдкого натру розчиняють в 200 мл дистильованої води.
Приготування гелю агарози: агарозу з набору для визначення імуноглобулінів в сироватці крові у кількості 3,6 г висипають в 200 мл вероналового буферу, підігрітого до температури 50-60°С, після чого кип'ятять впродовж 10-15 хв. на водяній бані до повного розплавлення агару і отримання прозорого гелю. Розплавлений агар фільтрують через вату і розливають по 21 мл в підігріті скляні циліндри, які закривають пробками і поміщають на водяну баню з температурою 56-58 °С. Ампулу моноспецифічної сироватки з робочим титром 1:20-1:30 розводять в 1 мл вероналового буфера, виливають у відповідний циліндр, перемішують і 10-15 хв. витримують на водяній бані.
Скляні пластини розміром 9х12 см протирають ефіром, на склі поміщають обмежувальну рамку (за відсутності рамки краю можна обробити парафіном). Підготовлені таким чином пластини підігрівають і поміщають на строго горизонтальну поверхню. На середину пластини з циліндра швидко виливають розплавлений агар, що містить моноспецифічну сироватку. Гель за допомогою скляної палички швидко і рівномірно розподіляють по усій поверхні стекла, бульбашки повітря ретельно видаляють. Пластину з гелем залишають на горизонтальній поверхні до повного затвердіння агару.
За допомогою круглого штампу по трафарету в гелі вирізують лунки. Відстань від краю скла до лунок і між лунками повинно бути не менше 10 мм. На одному склі розміром 9х12 см можна розмістити до 48 лунок. Агар з лунок видаляють пастерівською піпеткою, сполученою з вакуумним або водоструминним насосом. Підготовлені пластини при необхідності можна зберігати у вологій камері при температурі 4 °С.
Досліджувану сироватку за допомогою пастерівської піпетки з тонко відтягнутим кінцем вносять в лунки до зникнення увігнутого меніска. Кожну сироватку вносять в агарові лунки, що містять ту або іншу моноспецифічну сироватку. У 4 лунки агарової пластини вносять цілісну і розведену в 2, 4, 8 разів стандартну (еталонну) сироватку з відомим змістом імуноглобулінів усіх класів. Ампула із стандартною сироваткою входить в кожен набір моноспецифічних сироваток. Після внесення досліджуваних сироваток пластини поміщають у вологу камеру, в якості якої можна використовувати ексикатор з налитою на дно водою або інший відповідний посуд з кришкою і інкубують впродовж 24 годин (для визначення IgA і IgG) або 48 годин (для визначення IgM і IgD).
Після інкубації пластини витягають з вологої камери і забарвлюють відповідним барвником: бромфеноловим синім (склад фарби: бромфеноловий синій 0.5 г, свинець оцтовокислий 4% водною розчин - 10 мл, оцтова кислота крижана 20 мл, вода дистильована до 1 л), амідо чорний 10 В (склад фарби: 1% амідо чорного в 7% водному розчині оцтової кислоти).
Облік результатів. Для оцінки результатів реакції вимірюють діаметр кілець преципітації, що утворилися навкруги лунок. Потім на напівлогарифмічному папері наносять на осі абсцис діаметри кілець стандартної сироватки, а по осі ординат - відому концентрацію кожного класу імуноглобулінів в г/л і будують калібрувальний графік, за допомогою якого обчислюють вміст імуноглобулінів в кожній досліджуваній сироватці.
У нормі в сироватці міститься 0,65-1,65 г/л IgM; 7,50-15,45 г/л IgG; 1,25-2,5 г/л IgA. У таблиці 13 і 14 приведені норми показників для цього методу.
Таблиця 13. Концентрація імуноглобулінів дорослої людини в сироватці крові в нормі
Імуноглобулін |
Діапазон коливань концентрації |
IgG, г/л |
8-20 |
IgA, г/л |
0,9-4,5 |
IgM, г/л |
0,6-2,5 |
Таблиця 14. Концентрація імуноглобулінів в сироватці крові дітей у віці до 14 років
Вік |
IgG, г/л |
IgA, г/л |
IgM, г/л |
Новонароджені |
7,5-15,0 |
<0,06 |
0,11-0,35 |
1-3 міс |
2,7-7,8 |
0,06-0;58 |
0,12-0,87 |
4-6 міс |
1,9-8,6 |
0,1-0,96 |
0,25-1,2 |
7-12 міс |
3,5-11,8 |
0,36-1,65 |
0,36-1,04 |
1-2 роки |
5,2-10,8 |
0,36-1,65 |
0,72-1,6 |
3-6 років |
6,5-14,1 |
0,83-2,17 |
0,55-2,1 |
7-9 років |
7,6-13,3 |
1,08-2,0 |
0,55-1,6 |
9-13 років |
7,7-15,1 |
1,08-3,25 |
0,7-1,5 |
Клінічне значення. Імуноглобуліни є продуктами секреції В-клітин на кінцевій стадії їх диференціювання, тобто плазматичних клітин. Рівень сироваткових Ig відображує функціональний стан В-клітинної ланки імунної системи у відповідь на стимуляцію організму антигенними подразниками. Підвищення рівня характерне для гострих та хронічних запальних процесів, аутоімунних захворюваннях та ін. Дефекти, пов’язані з порушенням метаболізму імуноглобулінів, спостерігаються при багатьох захворюваннях. Зниження рівня імуноглобулінів свідчить про недостатність гуморальної ланки імунітету, порушення їх синтезу або посилення катаболізму, адсорбція на імунних комплексах.
Підвищення концентрації IgA спостерігається при: гострій та хронічній бактеріальній, грибковій, паразитарній інфекції, хронічних захворюваннях печінки, цирозі, ревматоїдному артриті, СЧВ, хронічному лімфо-лейкозі, мієломній хворобі, моноклональній гамапатії, хворобі Вальденстрема, ендотеліомі, остеосаркомі, кандидозі, муковісцидозі, захворюваннях дихальних шляхів.
Зменшення концентрації IgА спостерігається при: фізіологічній гіпогамаглобулінемії у дітей (у віці 3-5 міс.), вродженій гіпогамаглобулінемії або агамаглобулінемії, новоутвореннях імунної системи, лікуванні цитостатиками і імунодепресантами, станах після видалення селезінки, кишкових та ниркових синдромах втрати білку, гострих вірусних, хронічних бактеріальних інфекціях.
Підвищення концентрації IgM спостерігається при: гострих та хронічних бактеріальних, грибкових, паразитарних інфекціях, гострих вірусних гепатитах, цирозі, ревматоїдному артриті, СЧВ, гострому та хронічному лімфолейкозі, мієломній хворобі, макроглобулінемії Вальденстрема, ендотеліомі, остеосаркомі, кандидозі, муковісцидозі, захворюваннях дихальних шляхів.
Зменшення концентрації IgM спостерігається при: фізіологічній гіпогамаглобулінемії у дітей (у віці 3-5 міс.), вродженій гіпогамаглобулінемії або агамаглобулінемії, новоутвореннях імунної системи, лікуванні цитостатиками і імунодепресантами, опроміненні іонізуючою радіацією, станах після видалення селезінки, кишкових та ниркових синдромах втрати білку, хронічній вірусній інфекції, недостатності гуморальної ланки імунітету.
Підвищення концентрації IgG спостерігається при: гострих та хронічних бактеріальних, грибкових, паразитарних інфекціях, гострих та хронічних захворювання печінки, цирозі, вірусному гепатиті, автоімунних захворюваннях, ревматоїдному артриті, СЧВ, саркоїдозі, муковісцидозі, хронічному лімфолейкозі, мієломній хворобі, інфекційному мононуклеозі, моноклональній гамапатії, хворобі Вальденстрема, реконвалесценції первинної бактеріальної інфекції, при гострому періоді повторної інфекції, СНІД.
Зменшення концентрації IgG спостерігається при: фізіологічній гіпогамаглобулінемії у дітей (у віці 3-5 міс.), вродженій гіпогамаглобулінемії або агамаглобулінемії, новоутворенні імунної системи, лікуванні цитостатиками і імунодепресантами, станах після видалення селезінки, кишкових та ниркових синдромах втрати білку, при хронічній вірусній інфекції, гемоглобінопатії.
Визначення загального IgE в сироватці крові імуноферментним методом. Принцип визначення. У наданій тест-системі використовується принцип двосайтового (сендвіч) імуноферментного аналізу. У лунки мікропланшета, на поверхні якого адсорбовані специфічні анти-IgЕ-епсілон-антитіла, вносять досліджуваний зразок. Антиген з зразка зв'язується з антитілами на поверхні лунки. Незв'язаний матеріал видаляється відмивкою. У лунку вносять інші антитіла проти іншого епітопу IgЕ, мічені пероксидазою. Після повторної відмивки активність ферменту, зв'язаного на поверхні лунки мікропланшету, проявляється і вимірюється
додаванням хромоген-субстратної cумiшi, стоп-розчину та фотометрією при 450 нм. Iнтенсивність кольорової реакції прямо пропорційна кількості антигену у зразку.
Склад набору: 1. Стрипи для визначення загального IgE імуноферментним методом (Заг. IgЕ IФА), 8х12 лунок (1 шт.); 2. ІФА буфер синій, 6 мл (1 фл.); 3. Набір калібраторів та контролів, по 0.5 мл (всього калібраторів: 0, 50, 200, 500, 1000 МОд/мл; та 1 контрольний зразок); 4. Концентрат відмиваючого розчину, 22 мл (1 фл.); кон'югат, 11 мл (1фл.); 5. Розчин субстрату, 11 мл (1 фл.); 6. Зупиняючий розчин, 11 мл (1 фл.).
Важливі зауваження по збереженню реагентів і виконанню тесту:
1. Не змішуйте і не використовуйте в одній постановці реагенти різних серій.
2. Після використання реагенту негайно закривайте кришку флакона чи пробірки. Увага: закривайте кожен флакон своєю кришкою.
3. Усі компоненти набору повинні зберігатися в холодильнику (+2-(+10° С). Не заморожуйте набір.
4. Після розкриття пакету ретельно заклейте лунки, що залишилися, стрічкою для заклеювання, щоб запобігти впливу вологи під час зберігання.
5. Під час всіх інкубацій необхідно заклеювати планшет клейкою стрічкою. Не допускайте пересихання лунок мікропланшета між стадіями постановки.
6. Усі проби і стандарти бажано ставити в двох паралелях (повторах).
7. Досліджувані сироватки повинні бути ретельно відцентрифуговані. Не використовуйте мутні, хильозні та гемолітичні зразки.
8. Якщо аналіз виробляється не в день узяття крові, сироватку варто зберігати при -20 °С. Повторне заморожування-відтавання не допускається.
9. Відмивання мікропланшета може проводитися як вручну, так і з використанням автоматичних пристроїв. Вносити по 250 мкл відмиваючого розчину в лунки при кожному відмиванні. Затримка при відмиванні («замочування») не потрібна. Після закінчення ручного відмивання різко перегорнїть мікропланшет на фільтрувальний папір для видалення залишків буфера.
10. Вимірюйте оптичну щільність протягом не більш 15 хвилин після зупинки реакції із субстратом
Підготовка реагентів
1. Усі реагенти, включаючи необхідне число стрипів, перед використанням повинні бути доведені до кімнатної температури (+20-(+25)°С).
2. Приготуйте відмиваючий розчин: для цього концентрат, розбавте 10-кратним об’ємом дистильованої води в чистому посуді. Отриманий розчин стабільний протягом 5-х діб при кімнатній температурі чи 30 діб у холодильнику (+2-(+10)°С).
Проведення аналізу:
1. Помістіть у рамку потрібну кількість стрипів - зразки в 2 повторах та 12 лунок для калібраторів та контрольних зразків.
2. Внесіть у лунки по 50 мкл синього ІФА буфера.
3. Внесіть у лунки по 50 мкл калібратора або досліджуваного зразка.
4. Інкубуйте 30 хвилин при температурі 37 °C.
5. Відмийте стрипи 3 рази відмиваючим розчином.
6. Внесіть у лунки по 100 мкл розчину кон'югата.
7. Інкубуйте 30 хвилин при температурі 37 °С.
8. Відмийте стрипи 5 разів відмиваючим розчином.
9. Внесіть у лунки 100 мкл розчину субстрата.
10. Інкубуйте 15 хвилин при температурі 20-25 °C.
11. Внесіть у лунки 100 мкл зупиняючого розчину.
12. Визначте оптичну щільність у лунках на фотометрі при довжині хвилі 450 нм. Бланк фотометра виставляйте проти нульового калібратора
Нормальні величини: ґрунтуючись на результатах досліджень, проведених лабораторіями, рекомендуємо користатися нормами, приведеними нижче (табл. 15). Разом з тим, відповідно до правил GLP (Гарної лабораторної практики), кожна лабораторія повинна сама визначити для себе параметри норми, характерні для обстежуваної популяції.
Таблиця 15. Одиниці виміру загального IgE в сироватці крові в залежності від віку
Стать, вік |
Одиниці, МО/мл |
Додаткові одиниці, пг/мл |
||
Нижня межа |
Верхня межа |
Нижня межа |
Верхня межа |
|
< 6 місяців |
12,0 |
25,8 |
||
6-12 місяців |
30,0 |
64,5 |
||
1-3 років |
45,0 |
96,8 |
||
4-6 років |
70,0 |
150,5 |
||
7-9 років |
90,0 |
193,5 |
||
10-15 років |
120,0 |
258,0 |
||
>15 років |
15,0 |
130,0 |
32,3 |
279,5 |
Перехід в додаткові одиниці 1 МО/мл = 2,15 пг/мл
Приклад калібровочної кривої (вісь Х - конц. МО/мл; вісь У - ОЩ) (рис. 5).
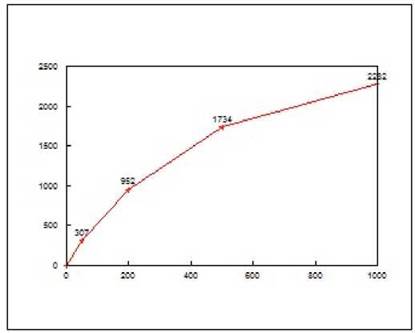
Рис. 5. Калібровочна крива для виміру вмісту загального IgE в сироватці крові.
Примітка: вісь Х - конц. МО/мл; вісь У - ОЩ.
Очікувані коливання контрольного зразка: 97 - 125 МО/мл.
Вимоги безпеки: дивись вище.
Умови транспортування: дивись вище.
Гарантії виробника: дивись вище.
Клінічне значення. Основна біологічна роль IgE - здатність зв'язуватися з поверхнею тучних клітин і базофілів людини. IgE бере участь в алергійних реакціях I (негайного) типу та у захисному протигельмінтному імунітеті, що обумовлено існуванням перехресного зв'язування між IgE і антигеном гельмінтів. Останній проникає через мембрану слизової і розміщується на тучних клітинах, викликаючи їх дегрануляцію. Медіатори запалення підвищують проникність капілярів і слизистої, у результаті чого IgE і лейкоцити виходять із кровотоку. До гельмінтів покритим IgEприєднуються еозинофіли, що викидають зміст своїх гранул і таким засобом вбивають гельмінти. Показання до визначення загального IgE: атопічні хвороби, алергійний риніт, атопічна бронхіальна астма, атопічний дерматит, алергійна гастроентеропатія, анафілактичні хвороби, системна анафілаксія, кропивниця - ангіоневротичний набряк, алергійний бронхопульмональний аспергільоз, гельмінтози, гіпер-IgE синдром (синдром Джоба), селективний IgE дефіцит, тимусна аплазія (синдром Ді-Джорджи), IgE-мієлома, реакція "трансплантат проти хазяїна" і ін.
Визначення рівня циркулюючих імунних комплексів (ЦІК) в сироватці крові. Процеси аутосенсибілізації супроводжуються накопиченням циркулюючих імунних комплексів (ЦІК), у зв'язку з чим визначення їх змісту є важливим етапом оцінки імунного статусу.
Матеріали та обладнання: 1. Сироватка крові (досліджувана). 2. Буфер боратний. 3. Поліетиленгліколь (мол. М. 6000). 4. Пробірки. 5. Центрифуга високошвидкісна типу Т-24. 6. Спектрофотометр.
Опис методу. Приготування 0,1 М боратного буфера: 3,410 г борної кислоти і 4,275 г тетраборату натрію змішують, переносять в мірну колбу і доводять до 1 л дистильованою водою, рН 8,4.
Сироватку крові в обсязі 200 мкл змішують з 5 мл 0,1 М боратного буфера. 4 мл суміші доливають до 4 мл 7% розчину поліетиленгліколю, приготовленого на 0,1 М боратному буферному розчині. Пробу інкубують 18-20 год. при температурі +4 °С. Після інкубації суміш центрифугують при 2000 об/хв. протягом 10 хв. Надосадову рідину видаляють, препарат двічі відмивають 7% розчином поліетиленгліколю на 0,1 М боратному буфері і розчиняють в 5 мл 0,1 N розчину їдкого натра.
Облік результатів. Рівень циркулюючих імунних комплексів визначають за допомогою спектрофотометра при довжині хвилі 280 нм і виражають в одиницях оптичної щільності.
Оскільки в даний час багато лабораторій оснащені стриповими фотометрами, можлива постановка даної реакції мікрометодом. Для цього досліджувану сироватку розводять боратний буфером в 3 рази. Розведення сироватки виконують наступним чином. У лунку планшета для імунологічних реакцій вносять 0,05 мл сироватки крові і 0,1 мл буфера. В паралельні лунки другого планшета вносять в першу - 0,25 мл буфера, у другу - 0,25 мл розчину поліетиленгліколю. Потім в обидві лунки цього планшета вносять по 0,05 мл розведеної сироватки з першого планшета. Планшет витримують 1:00 при кімнатній температурі. На вертикальному фотометрі з використанням світлофільтра 450 нм визначають екстинції. Обчислюють різницю показників сироватки крові з поліетиленгліколем і сироватки з буфером і множать на 100, що і є величиною ЦІК, вираженої в одиницях оптичної щільності.
Вміст ЦІК у сироватці в нормі - 30-90 МО/мл.
Клінічне значення. ЦІК - комплекси, що складаються з антигену, антитіл і пов'язаних з ними компонентів комплементу С3, С4, Clq. У нормі імунні комплекси, що утворилися в кровотоці, фагоцитуються і руйнуються як фагоцитами, так і печінкою. Однак при збільшенні їх розміру (при надлишку антигену і наявності в їх структурі IgM, Clq-компонента комплементу) комплекси можуть відкладатися в периваскулярному просторі і кірковому шарі нирок, викликаючи активацію комплементу і запальних процесів. Патологічні реакції на імунні комплекси можуть бути обумовлені підвищенням швидкості їх утворення над швидкістю елімінації, дефіцитом одного або декількох компонентів комплементу або функціональними дефектами фагоцитарної системи. Визначення рівня імунних комплексів в сироватці крові має важливе значення в діагностиці гострих запальних процесів і алергічних реакцій 3-го типу, при яких рівень ЦІК підвищується, а також в оцінці ефективності проведеного лікування. Підвищення рівня ЦІК в крові характерно для:
- гострих бактеріальних, грибкових, паразитарних і вірусних інфекцій;
- аутоімунного захворювання, колагенозів, ревматизму, гломерулонефриту, алергічних альвеолітів, васкулітів, феномена Артюса;
- імунокомплексних захворювань, сироваткової хвороби;
- алергічних реакцій 3-го типу.
Визначення гемолітичної активності комплементу. Уніфікований метод визначення гемолітичної активності комплементу по 50% гемолізу.
Принцип методу. Активність системи комплементу - гемолітична здатність сироватки крові людини лізувати еритроцити тварин. Комплемент, що міститься в досліджуваній сироватці, викликає гемоліз сенсибілізованих еритроцитів барана в присутності сироватки кролика, імунізованого баранячими еритроцитами (гемолітична сироватка).
Активність комплементу виражають в гемолітичних одиницях. За одну 50% гемолітичну одиницю комплементу (СН50) приймають таку його кількість, яка викликає гемоліз 50% 0,5 мл стандартної суспензії сенсибілізованих еритроцитів барана при 37 °С за 45 хв.
Спочатку гемолітична активність комплементу визначалася мінімальною кількістю сироватки, яка здатна викликати лізис 100% певної кількості еритроцитів барана. Проте вивчення літичної активності комплементу в залежності від його кількості виявило сигмоідальний характер кривої кореляції, причому повний гемоліз настає в широкій зоні верхньої частини кривої, тому гемолітичну активність комплементу виражають в СН50 - одиницях оцінки загальної (сумарної) функціональної активності ранніх (C1, C4, C2) і термінальних (С3-С9) компонентів системи комплементу, активованої за класичним шляхом.
В нормі 1СН50 становить 50-70 СН50/мл.
Реактиви: 1. Гемолітична сироватка (гемолізини). Випускаються стандартні серії препарату в ампулах з титром гемолітичної сироватки, зазначеним на етикетці. Такі сироватки мають тривалий термін придатності при зберіганні при температурі 2-8 °С. 2. Еритроцити барана. 3. Веронал-медіналовий буфер. Склад буфера (в грамах): 85 NaCl, 5,75 - веронал; 3,75 - мединал; 0,22 - СаCl2х2Н2О, 1 - Mg5Cl2х6H2O, рН 7,3-7,8 (5,75 г веронала розчиняють в 500 мл гарячої дистильованої води, суміш охолоджують до +20 °С, додають інші компоненти і доводять дистильованою водою до об'єму 2 л. Буфер зберігають при температурі 3-5 °С).
Хід визначення
Підготовчий етап:
1. Приготування буфера - в день постановки методики до однієї частини буферного розчину додати 4 частини дистильованої води. Розведений буферний розчин придатний протягом 12 год.
2. Обробка досліджуваної сироватки хворого - кров хворого, узяту з вени в кількості 2-3 мл, залишають на 2 год. при кімнатній температурі, потім центрифугують 10-15 хв. при 1500 об/хв. Сироватку обережно виділяють і дослідження проводять в той же день.
Приготування гемолітичної системи. Гемолітична система - це суміш рівних обсягів розведеної до триразового титру гемолітичної сироватки і 3% суспензії еритроцитів барана від обсягу щільного осаду (100 мл 3% суспензії і 100 мл розведеної гемолітичної сироватки: 0,1 мл гемолітичної сироватки і 99,9 мл ізотонічного розчину хлориду натрію).
Приготування 3% суспензії еритроцитів барана: дефібриновану кров барана відмивають 3 рази 5-10-кратними обсягами ізотонічного розчину хлориду натрію, який після третього відмивання еритроцитарної суспензії повинен бути безбарвним. З щільного осаду еритроцитів готують 3% (за об'ємом) суспензію еритроцитів барана у фізіологічному розчині.
Стандартизація суспензії еритроцитів барана. Стандартизацію суспензії еритроцитів барана здійснюють методом фотоколориметрування. Для фотоколориметрування застосовують зелений світлофільтр. 1 мл 3% суспензії відмитих еритроцитів барана додають в пробірку до 9 мл дистильованої води, отриману лізовану кров вливають в 10-мл кювету, в інші дві кювети (такого ж об'єму ) наливають розчин (суміш з 1 мл ізотонічного розчину і 9 мл дистильованої води).
У лівий кюветоутримувач ставлять кювету з розчинником, в правий - кювету з лізованою кров'ю. Певної концентрації еритроцитів барана відповідає певний показник шкали оптичної щільності. Якщо 3% завись еритроцитів барана приготовлена правильно, то шкала оптичної щільності лізата еритроцитів показує 0,4.
Якщо показник оптичної щільності менше 0,4, то до приготовленої суспензії еритроцитів барана слід додати відповідну за графіком кількість еритроцитів. Якщо ж показник оптичної щільності вище 0,4, то до приготовленої суспензії еритроцитів барана слід додати відповідну кількість ізотонічного розчину хлориду натрію (рис. 6).
Після приготування 3% суспензії еритроцитів барана готують гемолітичну сироватку.
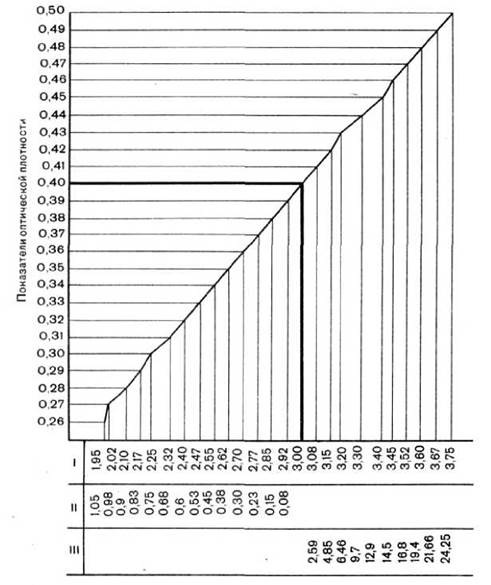
Рис. 6. Крива стандартизації суспензії еритроцитів барана за даними фотоколориметри [30].
Примітка: Кювета 10 мл. Світлофільтр зелений. I - суспензія еритроцитів барана (%), II - еритроцити барана (мл), які потрібно додати до 100 мл суспензії, щоб отримати 3% завись, III - ізотонічний розчин хлориду натрію (мл), який потрібно додати до 100 мл суспензії, щоб отримати 3% завись.
Розведення гемолітичної сироватки. Перед дослідом ампулу розкривають, ліофільний препарат, що міститься в ній, розводять стерильним ізотонічним розчином хлориду натрію згідно інструкції. Гемолітичну сироватку беруть в розведенні, яке в 3 рази перевищує її вихідну концентрацію. Так, якщо титр гемолітичної сироватки дорівнює 1:1200, готують розведення 1:400. Виходячи з необхідного, для постановки реакції обсягу гемолітичної системи відмірюють потрібну кількість гемолітичної сироватки.
Після цього ампулу запаюють і залишок гемолітичної сироватки зберігають до наступного досліду в холодильнику при 4-8 °С. Тільки після приготування 3% суспензії еритроцитів барана і розведення по титру гемолітичної сироватки можна приступити до приготування гемолітичної системи.
Сенсибілізація еритроцитів барана. До 1 обсягу суспензії еритроцитів барана додають рівний об'єм розведеної гемолітичної сироватки, що містить 4 гемолітичні одиниці (розведення гемолітичної сироватки 1:400). Змішування гемолітичної сироватки (0,1 мл і 99,9 мл ізотонічного розчину натрію хлориду) з еритроцитами барана виконують швидко, причому гемолітичну сироватку домішують до суспензії еритроцитів, а не навпаки. Суміш витримують при температурі 37 °С в термостаті 30 хв. для сенсибілізації еритроцитів. Під час інкубації суміш кілька разів струшують. Сенсибілізовані еритроцити повинні бути використані в той же день, до використання їх зберігають при 4 °С. Сенсибілізовані еритроцити барана називаються гемолітичною системою, яку використовують для титрування комплементу в пробірці.
Титрування комплементу. Досліджувану сироватку, розведену 1:10 буферним розчином, розливають у 2 пробірки: 0,1 і 0,25 мл. Розлиту сироватку (1:10) доводять веронал-медіналовим буфером до обсягу 1,5 мл. Потім в кожну пробірку додають 1,5 мл стандартизованої гемолітичної системи.
Одночасно з дослідними пробірками ставлять контроль на відсутність гемолізу сенсибілізованих еритроцитів: 1,5 мл гемолітичної системи та 1,5 мл веронал-медіналового буфера. Пробірки струшують і поміщають в термостат при температурі 37 °С на 45 хв. Після інкубації їх охолоджують при температурі 2-4 °С протягом 18-19 год. На наступний день проводять фотоколориметрування надосадової рідини з кожної пробірки (проти ізотонічного розчину хлориду натрію або дистильованої води в контрольній кюветі). Для врахування ступеня гемолізу необхідно використовувати шкалу стандартних розведень лізованих еритроцитів по А. П. Коннікова, яку готують для кожної партії еритроцитів і гемолітичної сироватки (табл. 16).
Таблиця 16. Шкала стандартних розведень лізованих еритроцитів по А. П. Коннікову
Розведення еритроцитів |
№ пробірки |
|||||
1 |
2 |
3 |
4 |
5 |
6 |
|
Гемологічна система розведення навпіл, мл |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
Дистильована вода, мл |
0,8 |
0,7 |
0,6 |
0,5 |
0,4 |
0,3 |
Гемоліз, % |
20 |
30 |
40 |
50 |
60 |
70 |
Для обчислення 50% одиниці гемолізу будують калібрувальну криву. Контролем служить оптична щільність пробірки № 4 зі шкали Коннікова, яка відповідає 50% гемолізу. На осі ординат відкладають величину оптичної щільності, виміряної при фотоколориметрії як контролю, так і досліджуваного матеріалу, і проводять горизонталь, паралельну осі абсцис, до перетину з перпендикулярами, встановленими на осі абсцис у крапках, відповідних 0,1 і 0,25 розведенням сироватки.
Приклад: пробірка зі шкали Коннікова № 4, що відображає 50% гемолізу, відповідає показаннями фотоелектроколориметра. Результати дослідження: фотоколориметрування першої пробірки, яка містить 0,1 мл сироватки, показує 0,07; другої пробірки, що містить 0,25 мл - 0,12. З'єднують ці дві точки і лінію з'єднання продовжують до перетину з лінією 50% гемолізу. З точки перетину опускають перпендикуляр на лінію абсцис, де відзначені свідчення розведення сироватки (наприклад 0,25).
Розрахунок ведуть за формулою: 0,25 мл (1:10)
CH50 = 1 мл:х, де Х = 1/0,25 = 100/25 = 4 СН50
У зв'язку з тим що 0,25 мл - це випробувана сироватка, розведена 1:10, результат треба помножити на 10, тобто. в 1 мл досліджуваної сироватки буде 40CH50. В сироватках здорових донорів зазвичай міститься 20-40 гемолітичних одиниць комплементу. Рівень комплементу у жінок нижчий, ніж у чоловіків, у межах 10%.
Клінічне значення. У клінічній практиці зустрічаються захворювання як зі зниженою активністю комплементу сироватки крові, так і випадки підвищення його активності (табл. 17).
Таблиця 17. Захворювання, для яких характерна зміна змісту комплементу
Зниження |
Підвищення |
СЧВ з ураженням нирок |
Обструктивна жовтянка |
Гострий гломерулонефрит |
Тіреоїдит Хашимото |
Сироваткова хвороба |
Гостра ревматична лихоманка |
Імунокомплексні захворювання |
Ревматоїдний артрит |
Цироз печінки |
Вузликовий периартеріїт |
Комбіновані імунодефіцити |
Дерматоміозит |
Септичний ендокардит |
Гострий інфаркт міокарда |
Виразковий коліт |
|
Рецидивуючі ангіоневротичні набряки |
Тифозна лихоманка |
Синдром Рейтера |
|
Пароксизмальна холодова гемоглобінурія |
Діабет I типу |
Міастенія Гравіс |
Подагра |
Вірусний гепатит з ураженням суглобів |
|
Змішана кріоглобулінемія |
|
Лімфома |
|
Збільшення загальної кількості комплементу відбувається при: обструктивній жовтяниці, тиреоїдиті Хашимото, гострій ревматичній лихоманці, вузликовому поліартеріїті, дерматоміозиті, гострому інфаркті міокарду, виразковому коліті, тифозній лихоманці, цукровому діабеті І типу, синдромі Рейтера, подагрі.
Зменшення загальної кількості комплементу відбувається при: СЧВ з ураженням нирок, гострому гломерулонефриті, сироватковій хворобі, імунокомплексних захворюваннях, цирозі печінки, комбінованих імунодефіцитах, септичному ендокардиті з гломерулонефритом, рецидивуючих ангіоневротичних набряках, пароксизмальній холодовій гемоглобінурії, міастенії Гравіс, вірусному гепатиті з ураженням суглобів, змішаній кріоглобулінемії, лімфомі.
Крім загальної гемолітичної активності комплементу, за допомогою радіальної імунодифузії по Манчіні визначають концентрацію окремих компонентів комплементу (частіше С3 та С4 ). Визначення C3 і C4 дозволяє встановити переважаючий шлях активації комплементу. C4 витрачається лише при активації за класичним шляхом. C3 бере участь як у класичному, так і в альтернативному шляху активації, проте при активації за альтернативним шляхом рівень C3 знижується значніше.