Введение в молекулярную биологию: От клеток к атомам - Энтони Рис, Майкл Стернберг 2002
Нуклеиновые кислоты и гены
Генная инженерия: клонирование генов
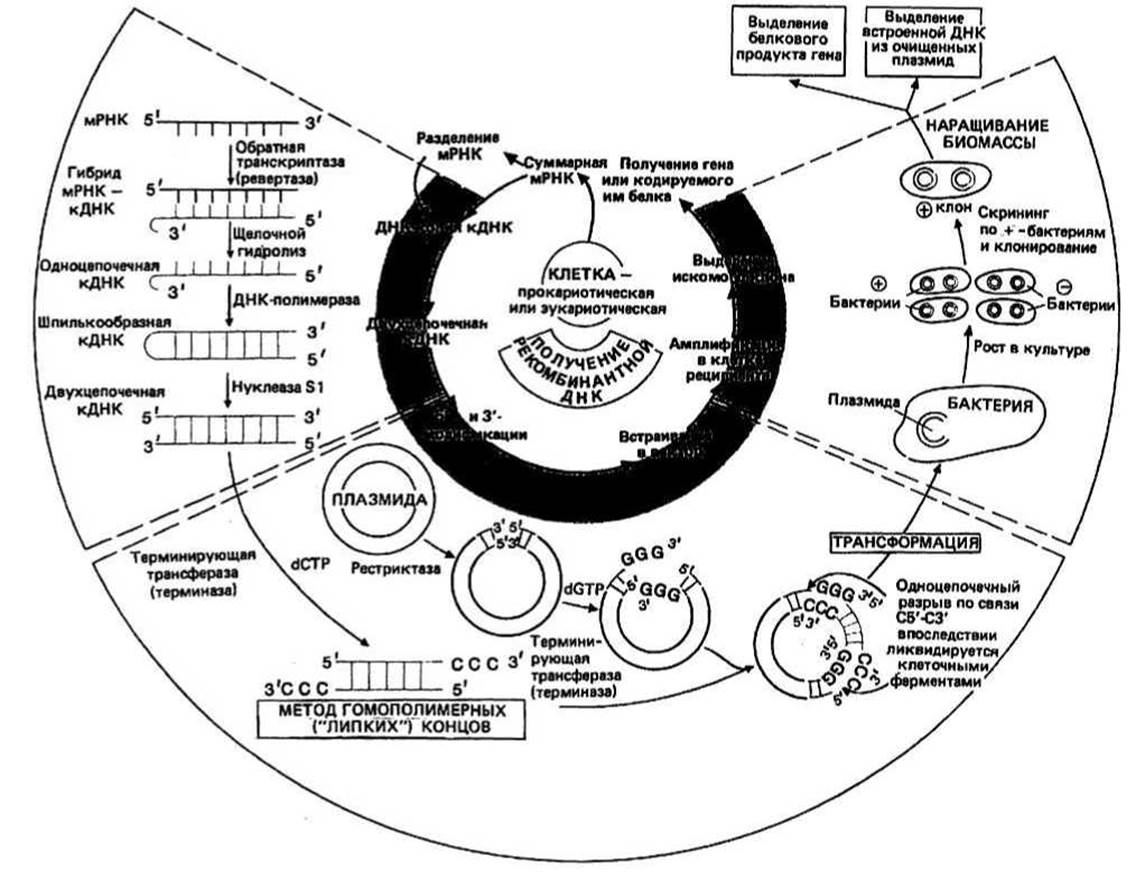
Рис. 30.1.
Клонирование генов - это процедура, включающая выделение и амплификацию отдельных генов в реципиентных клетках, про- или эукариотических. Эти клетки, содержащие нужный нам ген, можно использовать для получения либо а) большого количества белка, кодируемого данным геном, либо б) большого количества самого гена в высокоочищенном виде. В настоящее время используют две схемы клонирования гена. Согласно первой из них, геномную ДНК сначала расщепляют случайным образом с помощью рестрицирующих эндонуклеаз (см. ниже) на небольшие фрагменты примерно такой же длины, что и ген. Далее каждый фрагмент вводят с помощью вектора в реципиентную клетку, которая затем размножается, амплифицируя при этом ген или гены, содержащиеся в данном фрагменте. К этой методике мы больше возвращаться не будем. Согласно второй схеме, с информационной РНК, выделяемой из однотипных клеток организма, снимают ДНК-копии (кДНК), которые затем вводят в реципиентные клетки, в среднем по одному гену на клетку, и амплифицируют тем же способом, что и в первом случае.
Реципиентные клетки, т.е. клетки, выбранные для клонирования гена, могут быть как про-, так и эукариотическими. Чаще всего для этой цели используют бактерии, поскольку их легко получать в большом количестве. Если, однако, ген был выделен из клеток млекопитающих по первой методике, то его нужно клонировать в клетках эукариот, например в клетках дрожжей, из-за неспособности ДНК, содержащей интроны (гл. 27), экспрессироваться в прокариотической клетке. Рассмотрим теперь вторую методику. Матричную (информационную) РНК (мРНК) выделяют из клеток или тканей, в которых экспрессируется искомый ген. Так, для клонирования проинсулинового гена следует использовать (3-клетки поджелудочной железы, так как именно для них характерно высокое содержание проинсулиновой мРНК. Суммарную клеточную мРНК с помощью центрифугирования в градиенте сахарозы можно разделить на фракции, впрочем, довольно сильно перекрывающиеся. При такой грубой очистке число посторонних молекул мРНК в препарате уменьшается. Затем с молекул мРНК, попавших в нужный нам диапазон молекулярных масс (для белка таких размеров, как проинсулин, длина соответствующей молекулы мРНК составит примерно 25 000 нуклеотидов, или 25 т.п.н.), снимаются ДНК-копии.
Синтез ДНК - копий осуществляется ферментом, называемым обратной транскриптазой, или ревертазой (еще одно его название — РНК-зависимая ДНК- полимераза), который выделяют обычно из соответствующих РНК-содержащих вирусов. Чтобы этот фермент начал работать, требуется короткая (около 10 нуклеотидов) одноцепочечная ДНК-затравка; для этой цели, как правило, используют oligo(dT). Затравочная ДНК самопроизвольно образует двухцепочечный комплекс с отрезком poly(dA), который всегда присутствует на З-конце молекул эукариотической мРНК (гл. 22). По завершении стадии копирования исходную цепь РНК разрушают (деполимеризуют). Деполимеризацию исходной РНК-цепочки осуществляют путем щелочного гидролиза. Цепи ДНК устойчивы к обработке щелочью, а РНК полностью деполимеризуется. Получившаяся в результате ДНК является одноцепочечной (оц), лишь на конце молекулы образуется «шпилька» с небольшой петлей. Такая шпилька образуется потому, что на 5'-конце большинства мРНК имеется последовательность, одна половина которой комплементарна другой (палиндром) и которая в результате копирования оказывается и в кДНК. Таким образом, концевой участок цепочки кДНК, где расположена эта последовательность, может замыкаться сам на себя с образованием петли и отрезка двойной спирали.
Двухцепочечную (дц) кДНК получают путем достраивания оц-кДНК до двухцепочечной формы, выполняемого ферментом ДНК-полимеразой I. Для того чтобы этот фермент функционировал, также в принципе требуется затравочная ДНК, однако здесь ее вполне заменяет короткий отрезок двойной спирали, образуемый шпилькой. На одном из концов такой дц-кДНК все еще остается одноцепочечная петля; она удаляется с помощью фермента нуклеазы S1. Этот фермент разрезает петлю и, кроме того, подравнивает цепочки ДНК, удаляя всю оставшуюся оц-ДНК. После такой обработки кДНК можно встраивать в вектор.
Вектор - это нечто вроде молекулярного «такси», способного переносить чужую ДНК внутрь бактериальной клетки таким образом, чтобы она могла там реплицироваться. Существует два основных типа векторов: бактериальные плазмиды и бактериофаги. Здесь мы рассмотрим только первый тип.
Плазмиды — это встречающиеся в клетках внехромосомные элементы, представляющие собой замкнутые кольцевые молекулы дц-ДНК (гл. 26). Они способны реплицироваться независимо от геномной ДНК бактерий. Часто плазмиды содержат гены, белковые продукты которых обеспечивают нечувствительность к тем или иным антибиотикам. Этим свойством пользуются для отделения бактерий, содержащих плазмиды («+»-бактерии), от «—»-бактерий, лишенных плазмид. Чтобы включить кДНК в плазмиду, замкнутое кольцо плазмиды надо «разомкнуть». Для этого плазмиды подвергают воздействию рестриктаз.
Рестриктаза - (гл. 18) разрезает дц-ДНК по определенным нуклеотидным последовательностям, называемым участками рестрикции (обычно это короткие палиндромные последовательности); разные рестриктазы узнают разные палиндромы. В плазмидах, встречающихся в природе, часто бывает много таких участков для каждой из рестриктаз. Поскольку в идеальном случае нам нужна одна-единственная точка разреза, есть смысл в направленном отборе или «конструировании» плазмид с таким свойством. Например, в плазмиде pBR322, широко используемой в качестве вектора, для многих рестриктаз имеется лишь по одному участку рестрикции; в ней также имеются гены, обеспечивающие резистентность к ампициллину и пенициллину; и в ней нет некоторых «несущественных» генов, имевшихся в ее прототипе. Оставлены лишь те гены, которые необходимы для осуществления функций трансформации бактерий и репликации плазмиды.
Сшивание (лигирование) — процедура, в ходе которой чужеродная ДНК встраивается между (или сшивается с) двумя концами плазмидной ДНК с помощью фермента, называемого ДНК-лигазой. Чтобы эта операция могла осуществиться, необходимо, чтобы концы кДНК и плазмидной ДНК были «липкими». Для этого на концах должны быть оц-последовательности, способные образовывать комплекс друг с другом через спаривание оснований и обеспечивающие сцепление двух пар концов. Так образуется плазмида, которая называется рекомбинантной. Описываемая ниже процедура, с помощью которой это достигается, называется методом гомополимерных концов. Существует еще одна процедура, называемая связыванием по сайтам рестрикции, но мы ее рассматривать не будем.
Метод гомополимерных концов основан на присоединении к 3'-концам цепей, образующих дц-ДНК, коротких отрезков оц-ДНК с регулярной последовательностью (гомополимерных). Если каждый подобный гомополимер состоит из нуклеотидов одного вида и если два таких гомополимера с взаимно комплементарными основаниями присоединены соответственно к плазмиде и к кДНК, то последние, оказавшись рядом, замкнутся друг на друга с образованием рекомбинантной плазмиды.
Трансформация происходит после того, как рекомбинантную плазмиду добавляют к бактерии-реципиенту: плазмида проникает внутрь бактерии и включается в ее жизненный цикл. Поскольку не все бактериальные клетки в реакционной смеси будут трансформированы, желательно провести их отбор, с тем чтобы размножаться могли лишь рекомбинантные бактерии. Отбор может быть основан на том, что плазмиды обеспечивают резистентность к тем или иным антибиотикам. Это означает, что только те бактерии, в которых есть плазмиды, будут размножаться в присутствии соответствующего антибиотика.
Скрининг («просеивание») — это процедура, необходимость применения которой обусловлена тем, что в исходном препарате кДНК представлено много разных мРНК и лишь часть плазмид несет нужный нам ген. Методики, которые при этом используются, слишком специальны, и мы не будем их здесь рассматривать; подробное описание их имеется в приложенных ссылках. Как только нужную нам бактерию удалось выделить, ее нетрудно клонировать и размножить в культуре. Это уже содержание следующего этапа, называемого амплификацией.
Амплификация осуществляется благодаря тому, что в одной бактериальной клетке может синтезироваться много копий интересующей нас плазмиды, а также за счет получения большого количества клеток с такими плазмидами. После выделения и очистки плазмиды обрабатывают соответствующей рестриктазой, которая вырезает встроенные в них копии искомого гена. Амплифицированный таким образом ген можно использовать для дальнейших экспериментов в области генной инженерии, аналогичных тем, что упомянуты в списке рекомендуемой литературы. Кроме того, бактерии можно применять для получения белкового продукта гена, встроенного в плазмиду, если выполняются два условия: а) происходит транскрипция этого гена и б) нужный белок секретируется бактерией.