ОСНОВЫ БИОТЕХНОЛОГИИ МИКРОВОДОРОСЛЕЙ - Д. С. ДВОРЕЦКИЙ - 2015
2. ОСНОВЫ БИОХИМИИ МИКРОВОДОРОСЛЕЙ
2.1. Фотосинтез
Фотосинтез - это процесс, при котором происходит поглощение электромагнитной энергии Солнца фотосинтетическим аппаратом растений - хлорофиллом и вспомогательными пигментами, и восстановление за счёт неё атмосферного углекислого газа в сложные органические соединения [5]. Процесс фотосинтеза можно описать следующим суммарным уравнением:
![]()
Процесс фотосинтеза представляет собой цепь окислительно-восстановительных реакций, где происходит восстановление углекислого газа до органических веществ. Всю совокупность фотосинтетических реакций принято подразделять на две фазы - световую и темновую.
Световая фаза фотосинтеза. Прохождение световой фазы связано с мембранами тилакоидов при участии хлорофилла и других пигментов, фермента АТФ-синтетазы, встроенного в мембрану тилакоидов, и белков- переносчиков.
Для световой фазы фотосинтеза характерно то, что энергия солнечной радиации, поглощённая хлорофиллами, преобразуется сначала в электрохимическую, а затем в энергию макроэргических связей АТФ. Это достигается путём переноса электронов и ионов водорода с помощью специальных переносчиков через мембрану тилакоидов (рис. 5).
Рис. 5. Схема фотосинтеза (стрелками показан перенос протонов и электронов)
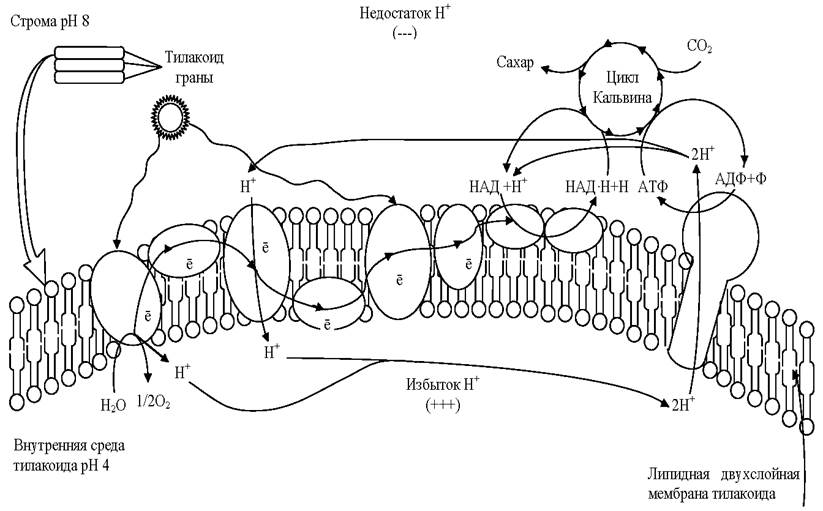
Световая фаза фотосинтеза разделяется на фотофизическую и фотохимическую. В фотофизической фазе происходит поглощение квантов света молекулами хлорофиллов П700(фотосистема I) и П680 (фотосистема II) и переход этих молекул в возбуждённое состояние.
В фотохимической фазе обе фотосистемы работают согласованно.
Фотосистема I. Возбуждённая молекула П700 отдаёт электрон акцептору. От него по системе переносчиков этот электрон попадает на внешнюю сторону тилакоида (обращённую в строму). При этом молекула П700 окисляется и П700 превращается в П+700:
![]()
Фотосистема II. Возбуждённая молекула П680 отдаёт электрон акцептору. От него по системе переносчиков электрон переходит в фотосистему I и восстанавливает молекулу П700. При этом молекула П700 возвращается в исходное состояние и становится вновь способной поглощать свет и переходить в возбуждённое состояние.
Молекула же П680, отдав электрон, превращается в П+680. Для её восстановления используются электроны, отщепляемые от молекул воды в процессе так называемого фотолиза,или фотоокисления:
2Н2O - 4е- —> 4Н+ + O2.
Благодаря фотолизу внутри тилакоида накапливаются протоны и образуется молекулярный кислород, который диффундирует в атмосферу. Кислород является побочным продуктом реакций фотосинтеза.
Протоны, образовавшиеся при фотолизе, не могут проникнуть через мембрану тилакоида и накапливаются внутри, создавая Н+-резервуар. Таким образом, по разные стороны мембраны накапливаются протоны и электроны, т. е. возникает электрохимический мембранный потенциал. Когда он достигает величины 200 мВ, протоны проталкиваются силой электрического поля через каналы фермента АТФ-синтетазы, встроенного в мембрану тилакоидов, т. е. начинает работать протонная помпа. На выходе из протонного канала создаётся высокий уровень энергии, которая используется для фосфорилирования имеющихся в матриксе хлоропластов молекул АДФ:
![]()
Перенесённые протоны взаимодействуют с электронами и молекулой НАДФ (кофермент никотинамидадениндинуклеотидфосфат), образуя комплекс НАДФ•Н + Н+:
НАДФ+ + 2е- + 2Н+ —> НАДФ•Н + Н+.
Таким образом, активированные световой энергией электроны используются для присоединения атома водорода к его переносчику, т. е. на восстановление НАДФ+ в НАДФ•Н + Н+.
В конечном итоге, в световой фазе фотосинтеза образуются АТФ, НАДФ-восстановленный кофермент и кислород, являющийся побочным продуктом фотосинтеза. Полученные АТФ и НАДФ-восстановленный кофермент используются в темновой фазе фотосинтеза.
Темновая фаза фотосинтеза происходит параллельно световой фазе. Этот сложный процесс, осуществляемый в строме хлоропластов без непосредственного поглощения света, включает большое количество реакций, приводящих к восстановлению СO2 до уровня органических веществ, за счёт использования энергии АТФ и НАДФ•Н+Н+, синтезированных в световую фазу. Существуют разные пути восстановления. Основным из них является так называемый С3-путь, или цикл Кальвина (рис. 6).
Рис. 6. Цикл Кальвина
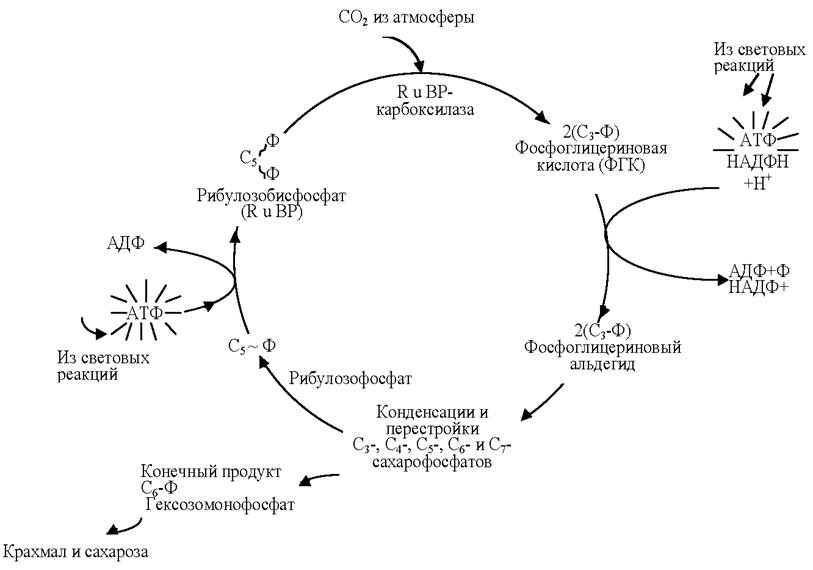
Восстановительный пентозофосфатный цикл или цикл Кальвина - серия биохимических реакций, осуществляемая при фотосинтезе организмами фото- и хемосинтетиками (растения, водоросли, пурпурные, цианобактерии и др.), является наиболее распространённым (но не единственным) из механизмов автотрофной ассимиляции углекислого газа. За открытие химизма усвоения растениями углекислого газа в процессе фотосинтеза американский биохимик Мелвин Эллис Кальвин был удостоен Нобелевской премии.
Цикл Кальвина состоит из трёх стадий:
1. Карбоксилирование. К рибулозо-1,5-бифосфату присоединяется СO2 под действием фермента рибулозобисфосфат-карбоксилаза/оксигеназа. Этот белок составляет основную фракцию белков хлоропласта и, предположительно, наиболее распространённый фермент в природе. В результате образуется промежуточное неустойчивое соединение, распадающееся на две молекулы 3-фосфоглицериновой кислоты (ФГК).
2. Восстановление ФГК. Сначала она фосфорилируется АТФ под действием фосфороглицерокиназы с образованием 1,3-дифосфоглицериновой кислоты (ДФГК), затем при воздействии триозофосфатдегидрогеназы и НАДФН ацилфосфатная группа ДФГК дефосфорилируется и восстанавливается до альдегидной и образуется глицеральдегид-3-фосфат - фосфорилированный углевод (ФГА).
3. Регенерация акцептора СO2. На этой стадии участвуют 5 молекул ФГА, которые через образование 4-, 5-, 6- и 7-углеродных соединений объединяются в 3-, 5-углеродных рибулозо-1,5-бифосфата, для чего необходимы 3АТФ.
Для синтеза одной молекулы глюкозы необходимо две молекулы ФГА, 6 молекул СО2, 12 молекул НАДФ•Н + Н+ и 18 молекул АТФ и 6 оборотов цикла Кальвина.
В темновой фазе фотосинтеза, таким образом, энергия макроэргических связей АТФ преобразуется в химическую энергию органических веществ, т. е. энергия как бы консервируется в химических связях органических веществ.
На скорость фотосинтеза оказывают влияние различные факторы окружающей среды: интенсивность падающего света, наличие влаги, минеральных веществ, температура, концентрация СО2 и др.
Уникальность и общебиологическое значение фотосинтеза определяются тем, что ему обязано своим существованием всё живое на нашей планете. Этот процесс является основным источником образования первичных органических веществ, а также единственным источником свободного кислорода на Земле. Из кислорода образовался и поддерживается озоновый слой, защищающий живые организмы от воздействия коротковолновой ультрафиолетовой радиации. Кроме того, благодаря фотосинтезу регулируется содержание СО2 в атмосфере.
В изучение процесса фотосинтеза, раскрытие его механизма большой вклад внесли: русский учёный К. А. Тимирязев, американский М. Кальвин, австралийские М. Д. Хетч и К. Р. Слэк, а также белорусские учёные академики Т. Н. Годнев и А. А. Шлык.
2.2. Энергетический обмен в клетках
Энергетический обмен в клетках любых организмов подразумевает высвобождение потенциальной энергии химических связей органических или неорганических веществ. Будучи заключённой в химических связях различных веществ, энергия недоступна для непосредственного использования клетками, в том числе и клетками микроводорослей и растений, которые преобразовали эту энергию из световой в химическую. Для этого потенциальная энергия органических молекул должна быть высвобождена и переведена в пригодную для использования форму [5, 15].
Образование и накопление энергии, доступной клетке, происходит в процессе клеточного дыхания. Для осуществления клеточного дыхания большинству организмов необходим кислород - в этом случае говорят об аэробном дыхании или аэробном высвобождении энергии. Однако некоторые организмы могут получать энергию из пищи без использования свободного атмосферного кислорода, т. е. в процессе так называемого анаэробного дыхания (анаэробного высвобождения энергии).
Таким образом, исходными веществами для дыхания служат богатые энергией органические молекулы, на образование которых в своё время была затрачена энергия. Основным веществом, используемым клетками для получения энергии, является глюкоза.
Аэробное (кислородное) дыхание. Процесс аэробного дыхания можно условно разделить на несколько последовательных этапов. Первый этап - подготовительный, или этап пищеварения, включающий в себя расщепление полимеров до мономеров. Эти процессы происходят в пищеварительной системе животных или цитоплазме клеток. На данном этапе не происходит накопления энергии в молекулах АТФ.
Следующий этап - бескислородный, или неполный. Он протекает в цитоплазме клеток без участия кислорода.
На данном этапе дыхательный субстрат подвергается ферментативному расщеплению. Примером такого процесса является гликолиз - многоступенчатое бескислородное расщепление глюкозы. На промежуточных стадиях гликолиза образуются трёхуглеродные ферменты, используемые для биосинтеза ряда веществ.
В реакциях гликолиза шестиуглеродная молекула глюкозы (С6) расщепляется на две молекулы пировиноградной кислоты (С3). При этом от каждой молекулы глюкозы отщепляется четыре атома водорода, и образуются две молекулы АТФ. Атомы водорода присоединяются к переносчику НАД (никотинамидадениндинуклеотид), который переходит в свою восстановленную форму НАД•Н + Н+ (НАД очень сходен с НАДФ, т. е. с переносчиком атомов водорода при фотосинтезе).
Суммарная реакция гликолиза имеет вид
С6Н12O6 + 2АДФ + 2Н3РO4 + 2НАД+ —> 2С3Н4O3 + 2АТФ + 2ННА • Н + Н+ + Н2O.
Полезный выход энергии этого этапа - две молекулы АТФ, что составляет 40...60% выделившейся энергии рассеивается в виде тепла.
Наиболее важным является кислородный этап аэробного дыхания, т. е. он требует присутствия кислорода. Продукт гликолиза - пировиноградная кислота - заключает в себе значительную часть энергии, и дальнейшее её высвобождение осуществляется в митохондриях.
В аэробных условиях пировиноградная кислота декарбоксилируется (теряет молекулы СO2), соединяется со специфическим коферментом А, образуя комплекс ацетил-КоА, и вовлекается в цикл Кребса.
Цикл трикарбоновых кислот или цикл Кребса - это ключевой этап энергетического обмена всех аэробных организмов. В процессе цикла трикарбоновых кислот выделяется и запасается в клетках не только значительное количество энергии, но также происходит синтез молекул- предшественников, участвующих в других биохимических превращениях, синтезируются важные для жизнедеятельности клетки соединения, такие как аминокислоты, жирные кислоты и т. д. Цикл трикарбоновых кислот был открыт немецким биохимиком Хансом Кребсом, за что его удостоили Нобелевской премией в 1953 г.
Полное сгорание энергетического субстрата подразумевает окисление до CO2 и воды ацетильного остатка, связанного с коферментом А (ацетил-КоА).
У эукариотических организмов все реакции цикла Кребса протекают внутри митохондрий. Данный цикл состоит из восьми последовательных реакций (рис. 7).
Цикл трикарбоновых кислот начинается с присоединения ацетил- КоА к оксалоацетату (соль щавелевоуксусной или кетоянтарной кислоты) с образованием соли трикарбоновой лимонной кислоты - цитрата. Затем цитрат претерпевает ряд последовательных превращений, сопровождающихся двумя декарбоксилированиями, т. е. выделением СO2, в конечном итоге приводящим к регенерации оксалоацетата.
Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление одной молекулы ацетил- КоА.
Рис. 7. Цикл Кребса
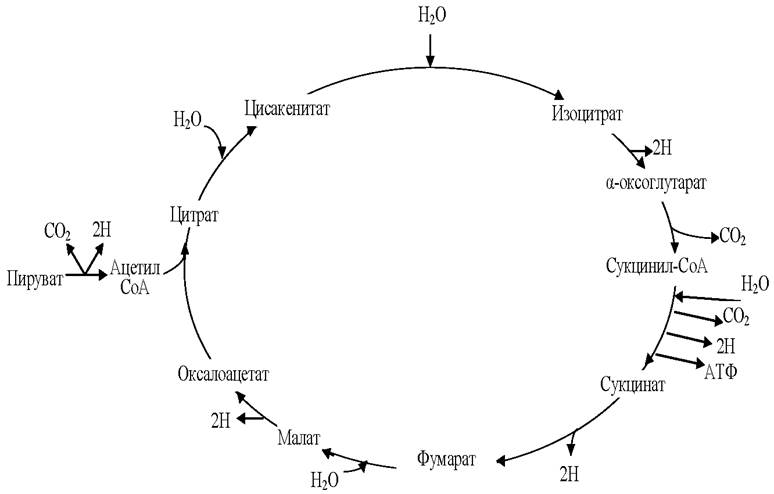
Суммарное уравнение цикла трикарбоновых кислот:
2С3Н4О3 + 6Н2О + 8НАД- + 2ФАД+ —> 6СО2 + 8НАД • Н2 + 2ФАД • Р + 2ААТФ.
Углекислый газ выделяется из митохондрий в цитоплазму клетки, а затем в окружающую среду.
Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов (или в цепи дыхательных ферментов), локализованной в митохондриях.
Атомы водорода, акцептированные НАД и ФАД (кофермент флавинадениндинуклеотид), вступают в цепь реакций, конечный результат которых - синтез АТФ. Синтез АТФ происходит в результате процесса, который называется окислительным фосфорилированием, и протекает в следующей последовательности (рис. 8):
✵ атомы водорода отщепляются от НАД и ФАД, захватываются переносчиками, встроенными во внутреннюю мембрану митохондрий, где происходит их окисление:
Н —> Н+ + е-;
✵ Н+ выносятся переносчиками на наружную поверхность крист, накапливаются в межмембранном пространстве, образуя протонный резервуар;
✵ электроны (е-) атомов водорода возвращаются по цепи дыхательных ферментов в матрикс и присоединяются к атомам кислорода, который постоянно поступает в митохондрию. Атомы кислорода при этом становятся отрицательно заряженными:
1/2 О2 + е- —> О2- ;
✵ на мембране возникает разность потенциалов. Когда разность потенциалов достигает 200 мВ, начинает действовать протонный канал в молекулах фермента АТФ-синтетазы, которые встроены во внутреннюю мембрану;
✵ через протонный канал протоны Н- устремляются обратно в матрикс митохондрий, создавая высокий уровень энергии, большая часть которой идёт на синтез АТФ из АДФ и фосфорной кислоты, а сами протоны соединяются с отрицательно заряженными частицами кислорода, образуя воду - второй конечный продукт клеточного дыхания:
36АДФ + 36Н3РO4 + Е —> 36АТФ;
24Н+ + 12O2- —> 12Н2O.
Рис. 8. Схема переноса протонов и электронов через внутреннюю мембрану митохондрии в ходе кислородного этапа клеточного дыхания (электронтранспортная цепь)
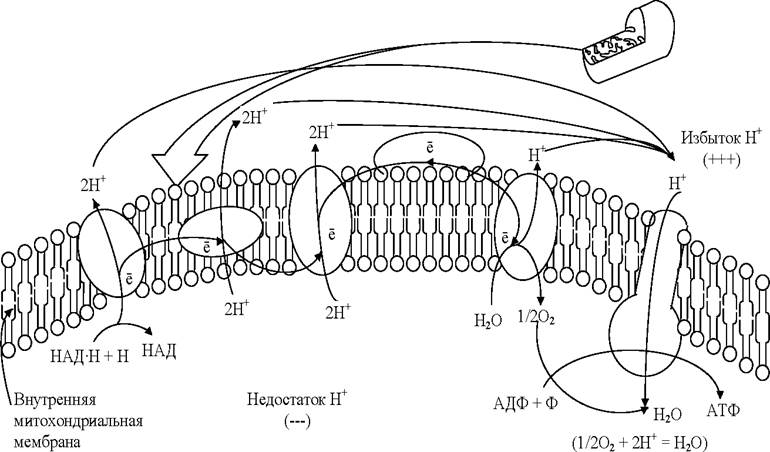
Таким образом, кислород, поступивший в митохондрии, необходим для присоединения электронов, а затем и протонов. При отсутствии кислорода процессы, связанные с транспортом протонов и электронов в митохондриях, прекращаются, а, следовательно, невозможно протекание и бескислородного этапа, так как все переносчики атомов водорода оказываются загруженными.
Аэробное дыхание, включающее бескислородный и кислородный этапы, можно выразить суммарным уравнением
С6Н12O6 + 6O2 + 6Н2O + 38АДФ + 38Н3РO4 —> 6СO2 + 12Н2O + 38АТФ.
При распаде молекулы глюкозы высвобождается 200 кДж / моль и образуется 38 молекул АТФ. В АТФ запасается 55% энергии, остальная рассеивается в виде тепла.
При отсутствии или недостатке кислорода, играющего роль конечного акцептора электронов в кислородном дыхании, цепь передачи электронов через мембрану не осуществляется, а значит, не создаётся протонный резервуар, обеспечивающий энергией синтез АТФ. В этих условиях клетки способны синтезировать АТФ, расщепляя питательные вещества в процессе анаэробного дыхания. Анаэробное дыхание осуществляют многие виды бактерий, микроскопические грибы и простейшие. Некоторые клетки, временами испытывающие недостаток кислорода (например, мышечные клетки или клетки растений), тоже обладают способностью к анаэробному дыханию.
Анаэробное дыхание - эволюционно более ранняя и энергетически менее рациональная форма получения энергии из питательных веществ по сравнению с кислородным дыханием.
В основе анаэробного дыхания лежит процесс, в ходе которого глюкоза расщепляется до пировиноградной кислоты, и высвобождаются атомы водорода. Акцептором атомов водорода, отщепляемых в результате дыхания, является пировиноградная кислота, которая превращается в молочную. Схематически ход анаэробного дыхания можно выразить следующими уравнениями:
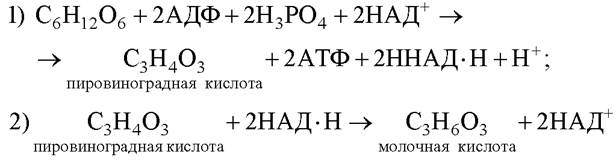
Описанный процесс получил название молочнокислого брожения. Молочнокислое брожение осуществляют молочнокислые бактерии (например, кокки из рода стрептококк). Образование молочной кислоты по такому типу происходит также в животных клетках в условиях дефицита кислорода.
В природе широко распространено спиртовое брожение, которое осуществляют дрожжи. В отсутствие кислорода дрожжевые клетки образуют из глюкозы этиловый спирт и СО2. На первых этапах спиртовое брожение идёт аналогично молочнокислому, но последние реакции приводят к образованию этилового спирта. От каждой молекулы пировиноградной кислоты отщепляется молекула СO2 и образуется молекула двууглеродного соединения - уксусного альдегида, который затем восстанавливается до этилового спирта атомами водорода. Суммарное уравнение
С6Н12O6 + 2АДФ + 2Н3РO4 —> 2С2H5OH + 2АТФ + 2СO2.
Спиртовое брожение, кроме дрожжей, осуществляют некоторые анаэробные бактерии. Этот тип брожения наблюдается в растительных клетках в отсутствие кислорода.
Наиболее распространённым питательным веществом, которое используется для анаэробного высвобождения энергии, является глюкоза. Однако следует помнить, что любое органическое вещество при соответствующих условиях может выступать источником энергии для синтеза АТФ.
При недостатке в клетке глюкозы в дыхание могут вовлекаться жиры и белки. Продуктами брожения являются различные органические кислоты (молочная, масляная, муравьиная, уксусная), спирты (этиловый, бутиловый, амиловый), ацетон, а также углекислый газ и вода.
2.3. Пищевые потребности микроводоослей
Для роста и размножения микроводорослям необходимы питательные вещества, удовлетворяющие потребности в питательных веществах и энергии. Основными химическими элементами, составляющими 98% структур клеток, являются: углерод, азот, кислород и водород. Эти элементы называются органогенными. Кроме того, клеткам микроводорослей необходимы фосфор, калий, сера, натрий, магний и др. Для нормального роста и функциональной активности клеток микроводорослей необходимо, чтобы все эти элементы регулярно поступали в клетку в требуемых количествах. Важно также, в какой форме химические элементы присутствуют в питательной среде и могут быть усвоены микроорганизмами - органической или минеральной. Микроводоросли, как большинство растительных организмов, по пищевым потребностям являются автолитотрофами [8, 16].
Рассмотрим кратко основные пищевые потребности микроводорослей [8].
Источники углерода. Углерод является важнейшим элементом, его доля в составе биомассы составляет около 50%. Поскольку микроводоросли являются автотрофными организмами, они способны использовать в качестве единственного источника углерода диоксид углерода. При этом для интенсивного развития микроводорослей не требуется его принудительная подача в питательную среду.
Источники азота. Большинство микроводорослей являются организмами с белковой направленностью метаболизма, поэтому при культивировании требуют достаточно большого количества азота. Обеспеченностью клеток указанным элементом в значительной степени определяются процессы биосинтеза. Исключение азота из питательной среды быстро приводит к замедлению роста микроводорослей. После истощения внутриклеточных запасов азота синтез биомассы полностью прекращается, снижается синтез белка, интенсивно образуются углеводы (до 50%) и липиды (до 80%) [8]. Регулируя продолжительность культивирования водорослей в безазотной среде, можно получить биомассу с различным соотношением белков, углеводов и липидов. Для обеспечения максимального биосинтеза белков требуется, как правило, более высокий уровень снабжения культур азотом, чем для достижения максимальной продуктивности биомассы. В качестве источника азота, в зависимости от вида микроводоросли, используется нитрат калия, сульфат аммония, нитрат аммония, бикарбонат аммония и мочевина.
Источники фосфора. Фосфор является одним из основных элементов минерального питания и играет важную роль в обмене веществ. При участии фосфора в клетке фотоавтотрофов протекают биохимические реакции азотного и углеводного обмена. Фосфаты образуют в клетках буферные системы, образуя реакцию среды. Фосфор входит в состав соединений, образующих протоплазму и ядро. Водоросли используют фосфор преимущественно в форме PO3-4, HPO2-4, H2PO-4, однако ряд водорослей, в том числе Scenedesmus и Chlorella, способны использовать фосфор из органических соединений. Поглощение фосфора микроводорослями происходит с затратой энергии, поэтому зависит от фотосинтеза и дыхания. В голодающих по фосфору клетках фосфаты вскоре после их поглощения преобразуются в запасные питательные вещества в виде полифосфатов.
Недостаток фосфора у хлореллы отрицательно сказывается в первую очередь на процессах ассимиляции, тогда как клетки делятся обычно нормально. При недостатке фосфора у Chlorella, Anabaena и Pediastrum наблюдается увеличение относительного содержания углеводов. Отмечено также незначительное снижение количества липидов и изменение их жирно-кислотного состава. При высокой концентрации в среде фосфора обнаружено наибольшее содержание в клетках микроводорослей (Chlorella, Scenedesmus, Ankistrodesmus)тиамина, биотина, рибофлавина, пиридоксина, никотиновой кислоты и каротина. На синтез 1 кг сухого вещества биомассы хлореллы обычно расходуется 15...18 г фосфора.
Источники калия. Калий является незаменимым элементом питания для микроводорослей. В клетках калий в большой мере определяет коллоидно-химические свойства цитоплазмы и функциональную активность клеток, регулируя собственные вещества клетки. Поглощение калия клетками микроводорослей является активным метаболическим процессом и связано с использованием световой энергии в автотрофных условиях. При недостатке калия у микроводорослей ингибируется фотосинтез и усиливается дыхание. Нарушается утилизация углеводов, в результате чего возрастает их содержание в клетках. Хлорелла развивается нормально в широком диапазоне концентраций калия, ингибирование роста в непрерывной интенсивной культуре наблюдается лишь при 6200 мг/л элемента (в виде KNO3) в среде. Недостаток калия проявляется агглютинацией клеток и их укрупнением, что свидетельствует о задержке деления. Наблюдаются уродливые формы деления и плазмолиз клеток. Калий часто вносится в среду в концентрациях, больших, чем требуется для водорослевой культуры, что связано с применением нитрата калия, дозируемого, как правило, по азоту, а также с использованием фосфатов калия для увеличения буферности среды и гидроокиси калия для нейтрализации питательного раствора.
Источники магния. Магний входит в состав хлорофилла и ряда других органических соединений. Магний, связанный с органическими веществами клетки, участвует во многих ферментативных процессах. Особенно существенна его роль в фотосинтезе и сопряжённых с ним реакциях. При недостатке магния в питательной среде для хлореллы за счёт снижения биосинтеза белка возрастает накопление в клетках углеводов, снижается рост культуры.
Содержание магния в питательной среде в пределах 100...240 мг/л в таких условиях обеспечивает нормальный рост хлореллы. При концентрациях магния в среде менее 10 мг/л снижается механическая прочность клеток. Вследствие этого утилизация элемента в непрерывной культуре не может быть полной, но может достигнуть 80...90%. На синтез 1 кг сухой биомассы хлореллы расходуется 4.6 г магния. Магний обычно применяют в виде сульфата, который одновременно служит источником серы, причём в этом соединении магний и сера находятся в нужных для хлореллы соотношениях.
Источники серы. Сера входит в состав белков, ферментов, пептидов, серосодержащих аминокислот, а также является компонентом многих других органических соединений клетки. Некоторые соединения серы участвуют в окислительно-восстановительных реакциях, биосинтезе и метаболизме различных веществ. В частности, важна роль серы в определении свойств и структурных превращений белковой молекулы. Большинство водорослей усваивают окислённые соединения серы - сульфаты.
В процессе метаболизма в клетке сульфаты восстанавливаются до сульфгидрильного уровня. При определённых условиях в клетке может происходить процесс, обратный восстановлению сульфата, - окисление органических соединений серы до неорганического сульфата.
Физиологическая роль серы у хлореллы связана с процессами деления клеток. Сера в питательных средах для микроводорослей чаще всего применяется в виде сульфата. Определённые виды микроводорослей способны использовать в качестве источника серы и другие её соединения. Chlorella pyrenoidosa одинаково эффективно использует серу в виде сульфатов и тиосульфатов, а также серу аминокислот метионина и цистеина. Некоторые водоросли способны утилизировать восстановленные формы серы - сероводород и сульфид.
При культивировании хлореллы содержание серы в клетках составляет 4...11 г на 1 кг сухой биомассы. Сера вносится в питательную среду обычно в виде сульфатов магния и калия или аммония. При культивировании в производственных условиях практикуют использование кали- магнезии.
2.4. Питательные среды для культивирования микроводарослей
Питательная среда - это субстрат, содержащий вещества-источники элементов, необходимых для поддержания обменных процессов, протекающих в клетках, в процессе их жизнедеятельности - получение и обмен энергией и построение структурных элементов клетки. Микроводоросли обладают способностью изменять химический состав клеток в зависимости от условий культивирования. Изменением состава питательной среды можно добиться изменения содержания белка в клетках от 8 до 60% и более, углеводов от 6 до 37%, жиров от 5 до 85% [3, 8].
Промышленное производство биомассы микроводорослей осуществляется в жидких питательных средах. Учитывая физиологические особенности микроводорослей, для их культивирования применяют синтетические питательные среды, в состав которых входят неорганические минеральные соли - источники азота (КNO3, сульфат аммония, мочевина), фосфора (фосфаты), калия (КNО3), серы (MgSO4, КSO4, NН3SO4) и т. д. Существуют разработки по культивированию биомассы микроводорослей на сточных водах [11].
Питательные среды для микроводорослей составляют в зависимости от целевого продукта. По этому признаку питательные среды можно раз
делить на две группы. К первой группе относятся среды, богатые азотом, позволяющие получать большое количество биомассы микроводорослей, в том числе обогащённой белком. К таким средам относятся Тамийя, ТАР, А-5. Химический состав этих сред приведён в табл. 1.
Вторая группа питательных сред предназначена для культивирования микроводорослей в стрессовых условиях с целью накопления в клетках липидов. Характерной особенностью этих питательных сред является пониженное содержание источников азота. Примерами таких сред являются Майерса, Тамия со сниженным содержанием азота. Химический состав этих сред приведён в табл. 1.
1. Питательные среды для культивирования микроводорослей
Название питательной среды |
Состав макроэлементов, г/л |
Состав раствора микроэлементов |
Среда Тамийя |
KNO3 - 5,0; MgSO4•7H2O - 2,5; КН2РО4 - 1,25; FеSO4•7Н2О - 0,003 |
1 мл раствора микроэлементов по Арнону в 1 л среды: H3BO3 - 2860 мг/л; MnCl2•4H2O - 1810 мг/л; ZnSO4•7H2O - 222 мг/л; MoO3 - 17,64 мг/л; NH4VO3 - 22,96 мг/л |
Среда Тамийя с мочевиной |
Мочевина - 3; MgSO4•7H2O - 2,5; КН2РО4 - 1,25; FеSO4•7Н2О - 0,003 |
1 мл раствора микроэлементов по Арнону в 1 л среды: H3BO3 - 2860 мг/л; MnCl2•4H2O - 1810 мг/л; ZnSO4•7H2O - 222 мг/л; MoO3 - 17,64 мг/л; NH4VO3 - 22,96 мг/л |
Среда Тамийя OPTIM |
KNO3 - 3,2; MgSO4•7H2O - 0,125; КН2РО4 - 0,25; FeSO4•7H2О - 0,013 |
1 мл раствора микроэлементов в 1 л среды: H3BO3 - 2860 мг/л; MnCl2•4H2O - 1810 мг/л; ZnSO4•7H2O - 222 мг/л; MoO3 - 17,64 мг/л; NH4VO3 - 22,96 мг/л |
Среда ТАР |
2,42 г 2-Амино-2-гидрокси- метил пропан-1,3-диол |
Раствор микроэлементов по Хантеру: |
(буферный раствор); |
EDTA 50 г в 250 мл воды; |
|
25 мл раствора № 1 (соли); |
ZnSO4•7H2O - 22 г в 100 мл воды; |
|
0,375 мл раствора № 2 (фосфаты); |
H3BO3 - 11,4 г в 200 мл воды; |
|
1,0 мл раствора № 3 (микроэлементы); |
MnCl2•4H2O - 5,06 г в 50 мл воды; |
|
1,0 мл ледяной уксусной кислоты; |
CoCl2•6H2O - 1,61 г в 50 мл воды; |
|
вода - 1 л. |
CuSO4•5H2O - 1,57 г в 50 мл воды; |
|
1. Раствор солей № 1. |
FeSO4•7H2O - 4,99 г 50 мл воды |
|
NH4Cl - 15,0 г; МgSO4•7H2O - 4,0 г; |
||
СаСl2•2Н2O - 2,0 г; вода - 1 л. 2. Раствор фосфатов № 2 К2НРO4 - 28,8 г; КН2РO4 - 14,4 г; вода - 100 мл |
||
Среда М-8 |
КNO3 - 3; |
1 мл раствора микроэлементов в 1 л среды: |
КН2РO4 - 0,74; |
Al2(SO4)3•18H2O - 3,58 г/л; |
|
Na2HРO4•2H2O - 0,26; |
MnCl2•4H2O - 12,98 г/л; |
|
СаСl2•2Н2O - 0,13; |
CuSO4•5H2O - 1,83 г/л; |
|
Fе•ЕDТA - 0,01; |
ZnSO4•7H2O - 3,2 г/л |
|
FеSO4•7Н2O - 0,13; МgSO4•7H2O - 0,4 |
||
Среда N-8 |
КNO3 - 1; |
1 мл раствора микроэлементов в 1 л среды: |
КН2РO4 - 0,74; |
Al2(SO4)3•18H2O - 3,58 г/л; |
|
Na2HРO4•2H2O - 0,26; |
MnCl2•4H2O - 12,98 г/л; |
|
СаСl2•2Н2O - 0,013; |
CuSO4•5H2O - 1,83 г/л; |
|
Fе-ЕDТА - 0,01 |
ZnSO4•7H2O - 3,2 г/л. |
|
MgSO4•7H2O - 0,05 |
||
Среда Бенеке |
Ca(NO3)2 - 0,5; К2НРО4 - 0,2; МgSО4•7Н2О - 0,1; лимоннокислое железо - 0,0033; лимонная кислота - 0,0033 |
- |
Среда № 3 |
Мочевина - 3; КН2РО4 - 1,5; МgSО4•7Н2О - 0,75; FеSO4•7Н2О - 0,009; EDTA - 0,037 |
1 мл раствора микроэлементов по Арнону в 1 л среды: Н3ВO3 - 2860 мг/л; МnСl2•4Н2O - 1810 мг/л; ZnSO4•7Н2O - 222 мг/л; МоO3 - 17,64 мг/л; NН4VO3 - 22,96 мг/л |
Среда № 4 |
(NH4)2SO4 - 0,2; Ca(H2PO4)2 - 0,03; NaHCO3 - 0,1; MgSО4•7Н2О - 0,008; KCl - 0,025; FeCl, 1%-ный раствор 1 мл; почвенный экстракт 0,5 мл |
- |
Среда BG-11 |
NaNO3 - 0,3 г/л; K2HPO4•3H2O - 0,04 г/л; MgSO4•7H2O- 0,075 г/л; CaCl2•4H2O - 0,036 г/л; лимонная кислота - 0,006 г/л; Fe2(SO4)3 - 0,006 г/л; NH4Cl - 0,3г/л; Na2CO3 - 0,02 г/л; Na2ЭДTА (Трилон Б) - 0,001 г/л |
Раствор микроэлементов 1 мл/л: На3ВO3 - 2,86 г/л; МnСl2•4Н2O - 1,81 г/л; CuSO4•7Н2O - 0,022 г/л; СuSO4•5Н2O - 0,079 г/л; Na2Мо4•2Н2O - 0,39 г/л; Со(NO3)2•6Н2O - 0,05 г/л |
Среда Прата |
КNO3 - 0,1; КН2РО4 - 0,01; MgSО4•7Н2О - 0,01; FеСl3•6H2O - 0,001; Агар-агар - 1,2% |
- |
Среда А5 |
Мочевина - 1,8; КН2РО4 - 0,4; MgSО4•7Н2О - 0,5; NН4Н2РО4 - 0,12; 3MgСО3•Mg(OН)2•3Н2O - 0,05 |
1 мл концентрированного раствора микроэлементов М-1: Лимоннокислое железо - 23 272 мг/л; МnSO4•7H2O - 1009,4 мг/л; СuSО4•5H2О - 78 мг/л; ZnSО4•7H2О - 176 мг/л; Na2МоO4•2H2O - 50 мг/л; H3ВО3 - 571 мг/л; VOSО4 - 78 мг/л; СoSО4•7H2О 95 мг/л |
Среда Майерса |
КNO3 - 1,213; MgSО4•7Н2О - 1,204; КН2РО4 - 1,224; Fе2(SO4)3 - 0,0747 |
1 мл раствора микроэлементов по Арнону в 1 л среды: H3ВO3 - 2860 мг/л; МnСl2•4H2O - 1810 мг/л; ZnSO4•7H2O - 222 мг/л; МоO3 - 17,64 мг/л; NH4VO3 22,96 мг/л |
Среда Ягужинского |
КNO3 - 0,5; MgSО4•7Н2О - 0,1; Nа2HРO4 - 0,2; FеSО4•7H2О - 2 |
- |
2.5. Стехиометрия процесса культивирования микроводорослей
Основной целью расчёта стехиометрических соотношений в биотехнологии является определение прироста биомассы или продукта на заданное количество субстрата [7]. Иногда применяется и обратный пересчёт.
Стехиометрическое уравнение для любых микробиологических процессов можно записать так [7]:
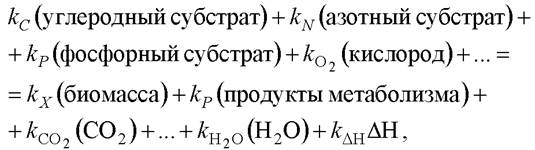
где к - стехиометрические коэффициенты.
При этом в биологии, как и в химии, действует закон сохранения материи: атомы органогенных элементов (кислорода, азота, углерода, водорода, фосфора, серы и т. д.) перегруппировываются, но общее количество элементов, входящих в структуры клетки, остаётся равным количеству, которое клетка получила из питательной среды. Биомасса состоит из множества различных веществ - белков, нуклеиновых кислот, липидов и т. д., состав и соотношение которых нельзя указать определённо. Поэтому при расчётах стехиометрических коэффициентов пользуются условной «формулой» биомассы, полученной эмпирически. «Формула» биомассы показывает массу соответствующего элемента, содержащегося в биомассе, отнесённую к атомной массе этого элемента. Коэффициенты в «формуле» биомассы, как правило, дробные, и приводятся к одному атому углерода (так называемый С-моль). Как правило, в расчётах используется усреднённая формула биомассы, предложенная Стоутхамером для С-моля - СH1,8О0,5N0,2 и обобщённая формула субстрата СmHnОрNq.
Энергетический выход биомассы - отношение энергии, заключённой в субстрате, к энергии, заключённой в биомассе:
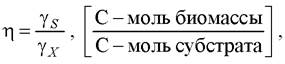
где ys, ух - степень восстановленности соответственно субстрата и биомассы, равная сумме числа электронов в атомах веществ (эквивалент химической валентности).
Поскольку энергетический выход является величиной безразмерной, от него можно перейти к массовому выходу:
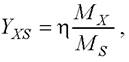
где Мх, Мs - молеклярные массы С-молей биомассы и субстрата соответственно.
Пример. Рассчитать количества потребляемого углекислого газа и выделяемого кислорода при культивировании фотосинтетических организмов (микроводорослей) в стрессовых условиях с целью накопления неполярных липидов.
1. Около 65% всех жирных кислот хлореллы приходится на ненасыщенные кислоты [39, 40]. Так как доля ненасыщенных кислот в жирнокислотном составе хлореллы велика, а соотношение атомов, входящих в состав кислот, мало отличается, рассчитаем усреднённую формулу липидов хлореллы с учётом остатка глицерина. Индексы атомов у усреднённой формулы жирных кислот найдём как среднеарифметическое значение индексов атомов данных кислот (пальмитиновая С15H31СООH, миристиновая С13H27СООH, олеиновая С17H33СООH, лауриновая С11H23СООH):

Таким образом, усреднённая формула жирных кислот: С15Н30О2.
Усреднённую формулу липидов составим из остатка усреднённой формулы кислот и остатка глицерина, что можно условно описать уравнением
СзН5(ОН)з + 3С14Н29СООН = СзН5(ОСОС14Н29)3 + 3Н2О.
Таким образом, усреднённая формула липидов микроводоросли имеет вид С48Н92О6 или С24Н46О3.
Приведя индексы полученной формуле к одному С-молю, получим СН1,92О0,13.
2. Уточним формулу Стоутхамера для биомассы микроводоросли, содержание липидов в которой составит 30% от сухих веществ:
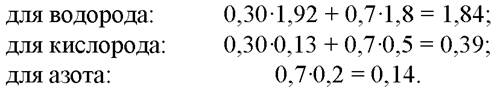
Усреднённая формула С-моля биомассы хлореллы, синтезирующей около 30% липидов в сухом веществе, примет вид СН1,84O0,39N0,14.
3. Рассчитаем количество углеродного питания (углекислого газа), необходимого для получения 1 г биомассы [14]:
![]()
Массовая доля углерода в углекислом газе
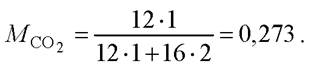
Масса СО2, необходимого для получения 1 г биомассы, составит
![]()
Если использовать газовоздушную смесь (гвс) с содержанием углекислого газа 0,8%, то необходимое количество газовой смеси на производство 1 тонны биомассы составит Gгвс = 1,98 / 0,008 = 247,5 (т).
Объём используемой гвс
VСO2 = 22,4 • 247500 / (44 • 0,008) = 15 750 (л) = 15,75 (м3).