ОСНОВЫ БИОТЕХНОЛОГИИ МИКРОВОДОРОСЛЕЙ - Д. С. ДВОРЕЦКИЙ - 2015
3. ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ ПРОДУКТОВ ИЗ МИКРОВОДОРОСЛЕЙ
3.1. Методы отделения биомассы микроводорослей от культуральной жидкости
Переработка накопленной биомассы микроводорослей начинается с процесса отделения биомассы от водных растворов. Технология сбора и обезвоживания микроводорослей должна стремиться к максимальному энергосбережению для снижения себестоимости готового продукта [3, 7, 17]. На сегодняшний день рассматриваются несколько способов обезвоживания биомассы микроводорослей:
1) сепарация или центрифугирование;
2) фильтрация;
3) флокулирование;
4) флотация.
При сепарации и центрифугировании суспензия клеток помещается в поле центробежных сил. При центрифугировании частицы суспензии оседают на стенках осадительных центрифуг. При сепарировании жидкость движется между вращающимися коническими тарелками. В процессе вращения частицы биомассы отбрасываются по направлению от центра вращения, сползают по коническим тарелкам к переферии, формируя у внутренней стенки корпуса слой сгущённой биомассы, при этом осветлённая жидкость движется вверх (рис. 9). Осаждённые клетки остаются живыми и сохраняют свои биохимические свойства [7, 17, 18].
Рис. 9. Принципы работы: а - осадительной центрифуги; б - сепаратора
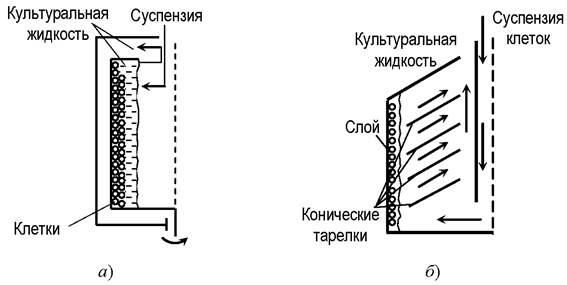
Процесс разделения в поле центробежных сил оценивается по показателю, называемому фактор разделения Фр. Фактор разделения показывает, во сколько раз ускорение центробежного поля больше ускорения свободного падения. У обычных центрифуг этот фактор составляет до 3500, у суперцентрифуг - свыше 5000... 7000, у ультрацентрифуг - до 20 000.
Центрифугирование и сепарация являются процессами с высоким энергопотреблением. В условиях промышленного культивирования микроводорослей для разделения большого количества суспензии может потребоваться значительное число единиц оборудования.
Фильтрация - это задержание взвешенных частиц пористой перегородкой под действием разности давления жидкости до и после перегородки [7, 17]. Если частицы задерживаются самой перегородкой, размеры отверстий в которой меньше размера частиц, такая фильтрация называется ситовой. Если размер отверстий в перегородке больше размера частиц, такая фильтрация называется через слой осадка - первые частицы проскакивают через перегородку, а затем на перегородке формируется слой осадка, который служит перегородкой (рис. 10).
Рис. 10. Схемы фильтрации: а - через ситовую перегородку; б - через слой осадка
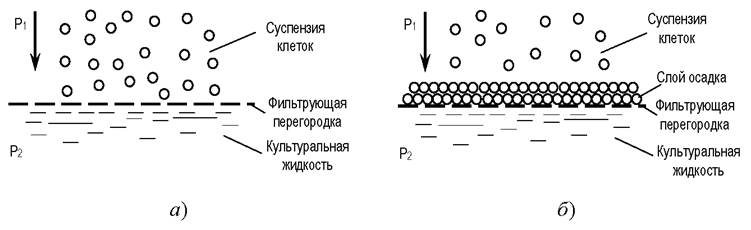
Фильтрация является процессом энергоёмким и длительным по времени; требуется регулярная замена фильтрующих перегородок.
Флокулирование - это процесс, основанный на физиологической способности микроорганизмов оседать в процессе культивирования. Её нельзя отождествлять с осаждением клеток, являющимся физическим процессом [19].
Этот метод перспективен для выделения микроводорослей сам по себе, либо может быть направлен на снижение затрат при фильтрации. Организация процесса флокулирования предполагает применение реагентов-осадителей.
1. Коагулянты. К коагулянтам относятся сернокислое железо, трёххлористое железо, сернокислый алюминий, оксихлорид алюминия, сернокислый марганец и др. Внесение этих реагентов в суспензию микроводорослей вызывает изменение заряда поверхности клеток, их агломерацию и последующую седиментацию биомассы в культуре. Недостатком такого метода является то, что коагулянты содержат ионы токсичных металлов, а также изменяют pH культуральной жидкости, делая её не пригодной для повторного использования.
2. Флокулянты. Значительный интерес представляют гидрофильные флокулянты на основе полимеров, например, полиакриламида или хитозан. Флокулянты широко применяются для обезвоживания осадков от избытка активного числа очистных сооружений хозяйственно-бытовых сточных вод и не являются токсичными. Однако при использовании флокулянтов могут возникнуть сложности, поскольку, помимо клеток микроводорослей, они могут флокулировать взвешенные частицы и компоненты питательной среды, присутствующие в культуральной жидкости. Присутствие балластных веществ в полученной сгущенной суспензии затруднит её дальнейшую переработку.
3. Биофлокулянты. Биофлокулянтами могут выступать микроорганизмы, например, бактерии, диатомовые водоросли и др. Применение их ограничено, поскольку биофлокулирующие организмы требуют введения в культуральную жидкость дополнительных питательных веществ, а также способны вызывать заражение самой монокультуры микроводоросли.
4. Автофлокуляция. Это процесс самопроизвольного осаждения микроводорослей, может происходить при изменении условий окружающей среды, например, увеличении pH среды, изменении осмотического давления и др. Кроме того, эффективность флокуляции может повышаться при внесении в суспензию автофлокулирующих микроводорослей, не требующих введения дополнительных химических реактивов и специальных условий культивирования.
Следует отметить, что сам механизм флокуляции остаётся недостаточно изученным.
Флотация - это процесс выделения клеток микроорганизмов из культуральной жидкости за счёт их адгезии (прилипания) к поднимающимся в жидкости пузырькам газа, сбора пены и её конденсации. Собранная пена отстаивается, в результате чего происходит её осушение [7]. По способу организации различают барботажную флотацию, напорную флотацию и электрофлотацию.
При барботажной флотации через культуральную жидкость пропускают пузырьки газа, формирующие пену; для интенсификации процесса в культуральную жидкость вносят флотореагенты, представляющие собой ПАВ.
При напорной флотации жидкость, находящуюся под давлением, насыщают газом, а затем осуществляют сброс давления. Образующиеся при этом пузырьки оказывают флотационное действие.
Электрофлотация - это процесс образования пены под действием электролиза. При электролитическом разложении воды на аноде выделяются пузырьки кислорода, а на катоде - пузырьки водорода, которые и формируют пену. Электрофлотация является наиболее эффективным изо всех флотационных процессов, но при организации её требуется частая замена изношенных электродов. Кроме того, электрофлотация является энергоёмким процессом.
3.2. Методы разрушения клеточных оболочек микроводорослей
Поскольку целевые продукты биосинтеза микроводорослей - липиды, белки, витамины и др. - являются внутриклеточными продуктами, выделению их предшествует разрушение или дезинтеграция клеточной стенки. Дезинтеграция клеток - это процесс необратимого анатомического нарушения целостности клеток. Разрушение клеточных стенок способствует как лучшему проникновению экстрагента, так и выходу целевых продуктов из клетки, в окружающую среду [20].
В естественных условиях разрушение клеток может происходить под влиянием внешних и внутренних факторов: физических, химических, биологических и генетических.
При подборе методов дезинтеграции следует учитывать структуру клеточных оболочек, их механические и биохимические характеристики (сопротивление нагружению, деформации, разрушению, формообразование и т. д.). Клеточная оболочка является сложным структурным межфазным граничным образованием, служит для поддержания пространственного единства клетки и обеспечивает устойчивость к колебаниям осмотического давления, проницаемость для большого числа веществ, обладает электрическим зарядом, большим комплексом ферментов и специальных структур, что позволяет клетке адаптироваться к непрерывно меняющимся условиям внешней среды.
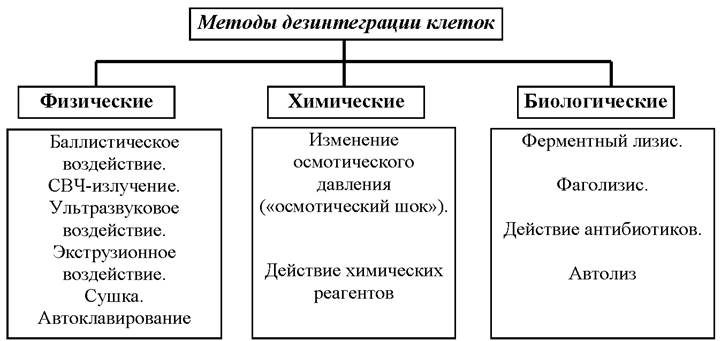
Виды и методы дезинтеграции, применяемые в биотехнологии, представлены на схеме (рис. 11) [20].
Для разрушения клеточных оболочек микроводорослей на практике применяются следующие методы.
1. Баллистическое воздействие. Чаще всего, применяются дезинтеграторы со свободными мелющими телами (мельницы со стеклянными бусами). Разрушение клеточной оболочки происходит при непосредственном механическом контакте мелющих тел и клеток. Недостатком баллистических методов являются энергоёмкость и сложность оборудования.
Рис. 11. Классификация методов воздействия для разрушения клеточных оболочек
2. Воздействие СВЧ-излучения. СВЧ-поле взаимодействует с полярными молекулами внутри клетки, вынуждая их выстраиваться согласно быстроменяющемуся электрическому полю. Молекулы, вращаясь относительно своей оси, вызывают значительное межмолекулярное трение, которое приводит к возрастанию температуры, нагреву вплоть до вскипания внутриклеточной воды, которая, расширяясь, разрывает клеточную оболочку.
3. Ультразвуковое воздействие, разрушающее микробную стенку, обусловлено физико-химическими явлениями, имеющими кавитационную природу. Кавитация - это комплекс взаимосвязанных процессов - потоки, удары, перепады давления и температуры, образование свободных радикалов, возникающих под действием ультразвука и локализованное в малых объёмах. Этот метод пока применим преимущественно в лабораторной практике.
4. Экструзионный метод подразумевает воздействие на клетки перепада давления. Для этого суспензию клеток продавливают через узкие отверстия под высоким давлением в камеры низкого давления. Клеточный распад при этом происходит за счёт соударения клеток в быстром течении потока, а также за счёт возникновения напряжений сдвига при сбросе давления. Для реализации этого процесса применяют инжекторные сопла и гомогенизаторы типа «френч-пресса».
5. Сушка клеток вызывает дегидрационный шок за счёт изменения содержания в клетке и вокруг неё свободной воды. В оболочке клетки появляются разрывы и трещины, а сами клетки погибают. Ресуспендирование высушенных клеток позволяет выделить внутриклеточные метаболиты.
6. «Осмотический шок» возникает в клетках при резком изменении осмотического давления, например, при повышении/снижении концентрации соли или сахара в окружающей среде. Оболочки клеток разрываются под давлением воды, проникающей внутрь клетки. Наибольшую эффективность осмотический шок проявляет при дезинтеграции клеток с малопрочной и проницаемой клеточной оболочкой.
7. Автоклавирование - это нагревание среды насыщенным паром под давлением 1,1…2,0 атм в специальных аппаратах - автоклавах. При этом температура пара составляет 119…127 °С. Такое воздействие реализует принцип теплового шока. Белки клеток коагулируют и теряют свои функциональные свойства. Липиды, входящие в состав клеточной стенки, окисляются, утрачивают свою структурообразующую функцию, в результате стенка становится проницаемой.
8. Применение химических реагентов предполагает воздействие щелочей, кислот, солей, детергентов, хелатных агентов и органических растворителей. Эти реагенты, воздействуя на клеточную оболочку, вызывают денатурацию и коагуляцию белков, окисление компонентов клеточной стенки, разрушение мембранной структуры. Недостатком этого метода является воздействие реагентов на другие клеточные структуры, вызывая загрязнение или разрушение целевого продукта и стоков.
9. Ферментный лизис - это обработка суспензии клеток гидролитическими ферментами или ферментными комплексами, разрушающими связи между веществами клеточной стенки. Это очень эффективный и быстрый способ, но его применение ограничено лабораторными условиями из-за высокой стоимости ферментных препаратов. Перспективно применение иммобилизованных ферментных препаратов.
10. Действие антибиотиков в значительной мере зависит от состава клеточной оболочки. Механизм их действия различен [21].
Нарушение синтеза клеточной стенки. Антибиотики действуют на ферменты клеточной стенки транспептидазу и карбоксипептидазу, связывая их. В результате клетка теряет способность образовывать поперечные сшивки между ферментами пептидогликана, при делении клетки не происходит формирования новой клеточной стенки, и микроорганизм гибнет.
Нарушение синтеза белка. Белки собираются из аминокислот на рибосомах. Действие антибиотиков заключается в том, что их молекулы ковалентно связываются с большими субъединицами рибосом и ингибируют связывание т-РНК с инициирующим экзоном м-РНК, тем самым угнетая начальную стадию синтеза белка.
Нарушение синтеза нуклеиновых кислот. Активный центр антибиотиков связывается с активным центром фермента РНК-полимеразы, блокируя синтез РНК.
Повреждение цитоплазматической мембраны (ЦПМ). Активный центр антибиотиков взаимодействует с липидами ЦПМ, образуя в мембране поры.
Для переработки биомассы микроводорослей перспективными являются комплексные методы, включающие комбинацию механического воздействия, теплового шока и ферментативного гидролиза биомассы.
3.3. Экстракционные методы выделения метаболитов из микроводорослей
Эктракционные методы используют в биотехнологии микроводорослей для получения липидов, полипептидов, пигментов и других внутриклеточных компонентов. Целевой продукт извлекается из дезинтеграта - предварительно разрушенных клеток - жидкостью (экстрагентом) из твёрдой или жидкой фазы (рафината). После перехода в экстрагент целевого продукта эта смесь называется экстракт. Твёрдую фазу после извлечения из неё растворённого вещества называют шрот [7].
В качестве экстрагентов, в зависимости от вида извлекаемого вещества, используется вода, водные растворы щелочей и кислот, органические растворители. Высокоэффективная технология извлечения липидов подразумевает использование легколетучих экстрагентов для снижения энергетических затрат при последующей отгонке [7].
Наиболее часто в технологии извлечения липидов из живых клеток и тканей используется смесь органических растворителей, один из которых полярный, а второй - неполярный [22].
При погружении клетки в органический растворитель, последний взаимодействует с клеточной оболочкой, формирует вокруг клетки статичную плёнку. Эта плёнка не разрушается в любом потоке растворителя и при перемешивании.
Нейральные липиды химически представляют собой цепочки трёх сложных эфиров высших жирных кислот и трёхатомного спирта глицерина (триглицериды) [16]. Между остатками жирных кислот возникают слабые ван-дер-ваальсовы взаимодействия, поэтому нейтральные липиды образуют пространственные структуры - глобулы, локализованные непосредственно в цитоплазме. Полярные липиды (фосфолипиды) представляют собой сложные эфиры многоатомных спиртов и высших жирных кислот, содержащие остатки фосфорной кислоты. Характерной особенностью полярных липидов является наличие в молекуле гидрофильной и гидрофобной частей. Полярные липиды в клетке формируют мембранные образования и находятся в виде липидно-белковых ассоциаций [16].
Неполярные органические растворители (гексан, петролейный эфир, бензин, хлороформ и др.) проникают через ЦПМ в цитоплазму, взаимодействуют с нейтральными липидами, образуя с ними связи, аналогичные ван-дер-ваальсовым. Полученный комплекс «органический растворительнеполярные липиды» диффундирует через клеточную мембрану и плёнку органического растворителя, окружающую клетку, в объём растворителя.
Однако ван-дер-ваальсовых взаимодействий недостаточно для разрушения белково-липидных ассоциаций в мембранах клетки.
Полярные органические растворители (метанол, этанол, изопропанол и др.) способны образовывать с полярными липидами водородные связи, в результате чего замещаются связи в липидно-белковых ассоциациях клеточных мембран. Образовавшийся комплекс «органический растворитель-полярные липиды» диффундирует через клеточную оболочку и статичную плёнку в объём растворителя [22].
3.4. Аппаратура для культивирования микроводорослей
Оборудование для культивирования микроводорослей, применяемое в настоящее время можно разделить на две группы: открытые и закрытые установки биосинтеза. К открытым установкам относятся бассейны или пруды, которые могут быть как естественного, так и искусственного происхождения (рис. 12). Обычно они представляют собой неглубокие водоёмы, хорошо прогреваемые солнцем, в которых обеспечена возможность подачи воды, питательных компонентов, а нередко, и сточных вод. Такие установки являются весьма перспективными и высокопродуктивными для промышленного культивирования микроводорослей, например, как источника технических липидов, поскольку их можно применять на землях, не пригодных для строительства, сельхозугодий, а также как элемент биологической очистки сточных вод [23, 31].
Рис. 12. Открытые системы для выращивания микроводорослей: а - открытый пруд для культивирования Spirulina в Азии; б - пруд для культивирования Chlorella vulgaris

Открытые установки просты по конструкции, дёшевы и удобны для массового культивирования микроводорослей. Но главным преимуществом открытых систем является возможность применения естественных энергетических ресурсов, что позволяет снизить себестоимость биомассы водорослей. Их стоимость в 2-3 раза ниже, чем в закрытых системах. Основным недостатком таких систем является сложность управления процессом биосинтеза и сезонность в широтах с умеренным или холодным климатом.
Для получения больших объёмов биомассы с заданными свойствами используют закрытые системы, которые называются фотобиореакторы. Все фотобиореакторы, которые существуют в настоящее время, можно условно разделить на две группы - ёмкостные фотобиореакторы и трубчатые фотобиореакторы.
Примером ёмкостных фотобиореакторов является установка, разработанная Азовским научно-исследовательским институтом рыбного хозяйства (рис. 13) [24].
Установка состоит из ёмкости 1, оснащённой источниками дневного света 12 и системой подачи газа. Ёмкость 1 выполнена из светопрозрачного материала, герметично закрыта крышкой 4 и разделена на две секции вертикальной светоотражающей перегородкой 3, которая не касается дна и крышки ёмкости.
Рис. 13. Установка культивирования микроводорослей Азовского научно-исследовательского института рыбного хозяйства: 1 - ёмкость; 2 - кожух; 3 - перегородка; 4 - крышка; 5 - газовый клапан; 6 - штуцер для подачи газовой смеси; 7 - газопровод; 8 - баллон; 9 - манометр; 10 - водяной насос; 11 - циркуляционный штуцер;
12 - источники дневного света; 13 - таймер
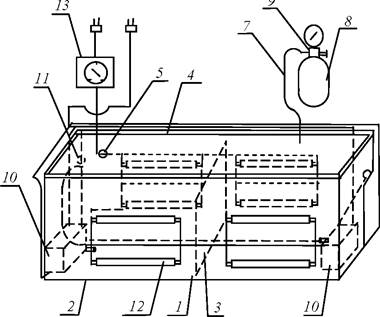
Рис. 14. Установка для культивирования микроводорослей ВНИИ орошаемого земледелия: 1 - светоотражающий короб; 2 - стеклянная ёмкость; 3 - нагревательное устройство; 4 - решётка с гнёздами; 5 - источники света; 6 - трубопровод подачи газа
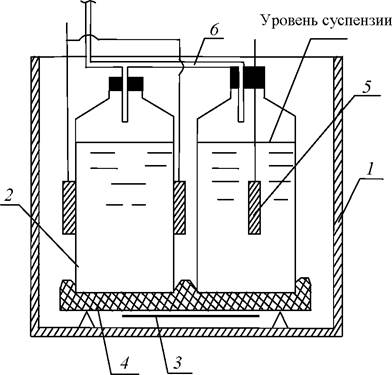
Герметичность установки преследует две цели: снижение потерь газов в атмосферу и исключение применения пеногасителей при интенсивном барботировании газа в реакционном пространстве. Перегородка предназначена для периодического переключения световых и темновых периодов освещения суспензии микроводорослей при непрерывном культивировании. Крышка ёмкости 4 оборудована газовым клапаном 5 для сброса излишков газовоздушной смеси и штуцером 6 для подачи газа по газопроводу 7 из баллона 8. Для подвода газовоздушной смеси в торцах ёмкости установлены водяные насосы 10 с подсосом газов из пространства под крышкой. Помимо постоянного внесения смеси газов в культуральную жидкость, работа насосов 10 обеспечивает тщательное перемешивание без использования внешних источников газа.
Источники дневного света 12 размещены снаружи ёмкости, с противоположных сторон каждой секции. Их включение и выключение осуществляется посредством таймера один раз в сутки. Для концентрации света вся установка помещена в кожух 2 из светоотражающего материала. Для поддержания оптимальных условий культивирования ёмкость оснащена водонагревателем с терморегулятором.
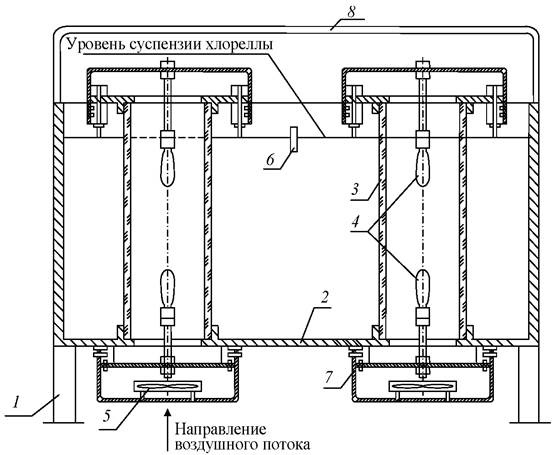
Установка для культивирования микроводорослей ВНИИ орошаемого земледелия, представленная на рис. 14 [25], отличается от предыдущей тем, что в светоотражающем коробе 1, снабжённом равноудалёнными источниками света 5, располагаются стеклянные ёмкости 3 в гнёздах решётки 4.
Под решёткой 4 размещается нагревательное устройство 3. Каждая ёмкость снабжена датчиками освещённости, концентрации суспензии и температуры, которые заведены на пульт управления. Подача углекислого газа осуществляется по трубопроводу 6 в каждую ёмкость, отвод газа из ёмкостей производится через индивидуальные штуцеры. По окончании цикла культивирования ёмкости через крышку удаляют, заменяя на новые.
Ещё одна ёмкостная установка для культивирования микроводорослей представлена на рис. 15 [26]. Установка представляет собой ёмкость 2, установленную на каркасе 1, в которой производится культивирование микроводорослей. Внутри ёмкости смонтированы светопрозрачные обечайки 3, внутри которых установлены лампы искусственного освещения 4, подключённые к источнику питания, с помощью которого создаётся необходимая освещённость среды. Температура культуральной жидкости регулируется с помощью терморегулятора 6, погружённого в культуральную жидкость. Изменение температуры культуральной жидкости производится с помощью вентиляторов 5, которые включаются при повышении температуры выше оптимальной и выключаются при чрезмерном снижении температуры.
Рис. 15. Установка для выращивания микроводорослей: 1 - каркас; 2 - ёмкость; 3 - светопрозрачные обечайки; 4 - лампы искусственного освещения; 5 - вентилятор; 6 - терморегулятор; 7 - корпус вентиляторов; 8 - корпус установки
На рисунке 16 представлена оригинальная конструкция ёмкостного реактора [27].
Рис. 16. Гибкий фотобиореактор: 1, 2 - боковые рабочие поверхности; 3 - опорные элементы; 4 - натягивающие элементы; 5 - каркас
Рабочая ёмкость реактора ограничена двумя боковыми поверхностями 1 и 2, выполненными из эластичного прозрачного материала. Боковые кромки ёмкости соединяются, например, посредством сварки. Длину ёмкости выбирают, исходя из обеспечения производительности. Рабочая ёмкость помещена в каркас 5, снабжённый опорными элементами 3, которые могут размещаться в различных конфигурациях. У концевых участков рабочая ёмкость снабжена натягивающими элементами 4. При заполнении рабочей ёмкости культуральной жидкостью к боковым поверхностям прикладывается давление, натягивая их. Удержание ёмкости происходит за счёт опорных компонентов 3. Долив и слив культуральной жидкости, подвод газа и другое осуществляется посредством коммуникаций, которые подключаются к концевым участкам 4. Для распределения газо-воздушной смеси рабочая ёмкость может быть снабжена перфорированным шлангом по всей длине.
Сотрудниками Тамбовского технического университета предложена следующая конструкция ёмкостного фотобиореактора (рис. 17) [30].
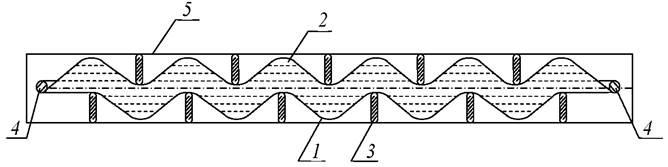
Фотобиореактор для культивирования микроводорослей состоит из непрозрачного корпуса 1, в нижней части которого расположены змеевиковые перфорированные трубки для подачи питательной среды 2 и газовоздушной смеси 3, соединённые штуцерами 4 и 5 с трубопроводами газовоздушной смеси и питательной среды соответственно. В толщу культуральной жидкости помещены светодиодные нити 6, расположенные в прозрачных капсулах 7, вставленных в перфорированную крышку 8. Предлагаемое устройство работает следующим образом. Через змеевиковые перфорированные трубки для подачи питательной среды 2 и газовоздушной смеси 3, соединённые штуцерами 5 и 6 с соответствующими трубопроводами, осуществляется барботирование углекислого газа через слой суспензии микроводорослей 9, заполняющей корпус фотобиореактора 1.
Рис. 17. Емкостной фотобиореактор: а - схема фотобиореактора; б - схема размещения змеевиковых перфорированных трубок в днище корпуса фотобиореактора;
1 - корпус фотобиореактора; 2 - змеевиковая перфорированная трубка для подачи питательной среды; 3 - змеевиковая перфорированная трубка для подачи газовоздушной смеси; 4 - штуцер для подачи газовоздушной смеси; 5 - штуцер для подачи раствора питательной среды; 6 - светодиодные нити; 7 - горизонтальная штанга
Через одно из отверстий крышки, в которое не установлена прозрачная капсула, осуществляется заполнение фотобиореактора суспензией микроводорослей 9, после чего в него также устанавливается прозрачная капсула 7, в которую помещаются светодиодные нити 6. Освещение внутреннего объёма корпуса фотобиореактора осуществляется с помощью светодиодных нитей 6, установленных в прозрачных капсулах 7, расположенных в перфорированной крышке 8.
К основным недостаткам ёмкостных фотобиореакторов относятся большие габаритные размеры и сложность обеспечения нужного уровня инсоляции (освещения) клеток микроводорослей.
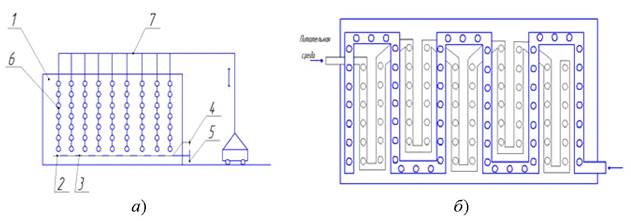
Примером трубчатого фотобиореактора является установка, разработанная ООО «Фитосила-Биос» [29]. Она представлена на схеме на рис. 18.
Рис. 18. Трубчатый фотобиореактор: 1 - панель; 2, 3 - ёмкости; 4 - порты для приборов; 5 - штуцеры; 6 - устройство механического пеногашения; 7 - каналы; 8 - магнит для очистки стенок
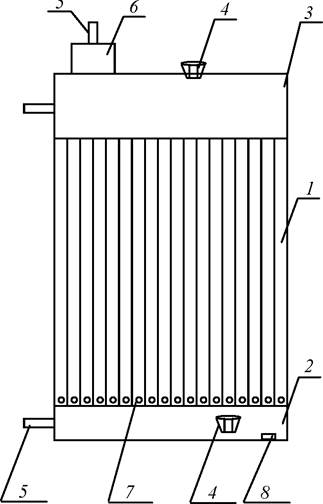
Конструктивно она представляет собой плоскую панель 1, состоящую из параллельных каналов, выполненных из светопрозрачного химически и биологически инертного материала. Каналы снизу и сверху объединяются в общие ёмкости 2 и 3, снабжённые портами 4 для приборов КИПиА и штуцерами 5. Подвод газовоздушной смеси производится через каналы 7, установленные внизу каждого чётного канала светоприёмной плоскости с одной стороны и нечётного канала с другой стороны, что обеспечивает аэрлифт как вверх, так и вниз. В верхнем канале установлено устройство механического пеногашения 6. Постоянный магнит 8 сечением, равным сечению канала, располагается внутри фотобиореактора. Он приводится в движение внешним магнитным полем и служит для очистки светоприёмных поверхностей от биоплёнки.
Наиболее известны в этой области разработки компании Valcent Products Inc. США (технология Vertigro). Система Vertigro аналогична предыдущей конструкции, но предназначена для размещения на открытых площадках. Она состоит из вертикальных биореакторов, сделанных из тонких плёночных материалов, позволяющих проникать солнечному свету (рис. 19) [23].
Рис. 19. Фотобиореактор Vertigro

Фотобиореакторы корпорации GreenFuel Technologies, и компании Arizona Public Service представляют собой ряд под углом или вертикально расположенных прозрачных труб для выращивания водорослей диаметром 10...20 см. Высота биореактора 2,5 м и выше. Биореакторы ориентируются на солнце. Выхлопные газы электростанции закачиваются в биореактор, создавая циркуляцию воды и водорослей в реакторе. «Созревшие» водоросли выпадают в осадок на дно реактора. Поглощение СО2 происходит во время светового дня (рис. 20).
Рис. 20. Фотобиореакторы корпорации GreenFuel Technologies

Фотобиореакторы фирм BioKing и AEN Engineering GmbH&Co представляют собой систему прозрачных горизонтально расположенных пластиковых труб, по которым принудительно циркулирует культуральная жидкость, содержащая микроводросли. В эту жидкость подаётся углекислый газ и различные добавки, необходимые для роста культуры и убирается выделяющийся в процессе жизнедеятельности кислород (рис. 21) [23].
Рис. 21. Фотобиореакторы фирм ВioKing и AEN Еngineering GmbH&Co

Фотобиореакторы и другие виды закрытых систем не позволяют получать большие объёмы биомассы, либо требуют применения сложных технических устройств и средств управления, что удорожает себестоимость производимой продукции. Сами конструкции закрытых фотобиореакционных установок сложны и дорогостоящи, что препятствует их широкому распространению.