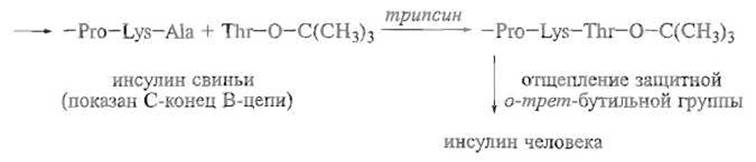Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Пептиды
Ферментативный синтез пептидов
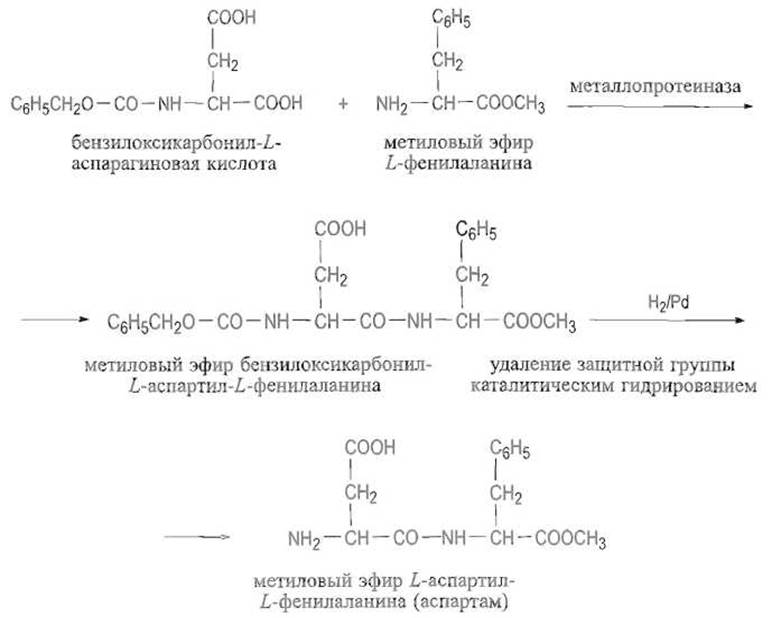
Протеолитические ферменты в обычных условиях катализируют гидролиз пептидных связей. Однако могут быть подобраны такие условия, при которых равновесие оказывается сдвинутым в сторону образования пептидной связи. Так, в концентрированных растворах бензилоксикарбонил-Т-аспарагиновой кислоты и метилового эфира 1-фенил аланина металлопротеиназы, например термолизин, катализируют образование пептидной связи между ними, причем продукт реакции (метиловый эфир бензилоксикарбон ил-А-аспартил- L-фенилаланина), будучи малорастворимым, выпадает в осадок в виде соли с еще одной молекулой метилового эфира Z-фенилаланина. Именно эта низкая растворимость продукта, которая выводит его из сферы реакции, смещает равновесие в сторону синтеза. После снятия защитной группы каталитическим гидрированием получают метиловый эфир L-acпартия-L-фенилаланина — аспартам — соединение, превосходящее сахарозу по сладости в 200 раз. Процесс используют для промышленного получения аспартама:
Еще один споcоб смещения равновесия в сторону синтеза — проведение катализируемой протеиназой реакции пептидного синтеза в органическом растворителе в присутствии малых количеств воды, достаточных только для гидратации фермента. Применяют при ферментативном синтезе и предварительную активацию одного из компонентов. Так, эфиры ацидированных пептидов в присутствии сериновых протеиназ быстро реагируют с аминокомпонентами — производными аминокислот или пептидов, образуя более длинные пептиды. Сдвиг равновесия в сторону синтеза в этом случае обеспечен активацией ацилирующего пептида за счет его превращения в сложный эфир; скорость катализируемого ферментом синтеза пептидной связи из эфира пептида гораздо выше скорости гидролиза этой же пептидной связи ферментом.
Описаны катализируемые ферментами частичные трансформации пептидов, например превращение свиного инсулина в инсулин человека, отличающийся от первого только заменой С-концевого остатка аланина в В-цепи на треонин. Это достигается путем катализируемого ферментом отщепления аланина и присоединения вместо него защищенного по карбоксильной группе остатка треонина, присутствующего в реакционной смеси в большом избытке: