Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Выделение белов
Ионообменная хроматография белков
Метод ионообменной хроматографии, основанный на различиях в соотношении и распределении заряженных групп на поверхности белка, принадлежит к числу наиболее используемых. В хроматографии белков практически не применяют синтетические ионообменные смолы на основе полистирола, весьма популярные в аналитической химии аминокислот и пептидов. Это объясняется, во-первых, большим содержанием поперечных сшивок, делающих материалы такого рода практически непроницаемыми для белков, во-вторых, сорбцией белков, подчас необратимой, на гидрофобной поверхности полистирола.
По указанным соображениям для разделения белков используют ионообменники, в которых матрица («подложка») отчетливо гидрофильна. Особенно распространены ионообменники, получаемые присоединением ионогенных групп к целлюлозе, поперечно- сшитым декстранам (сефадексы).
Для получения катионитов в качестве ионогенной чаще всего используют карбоксильную группу, рКа которой, несколько изменяющийся в зависимости от микроокружения, близок к 4 (карбоксиметил (СМ)-производные целлюлозы, сефадекса, содержащие группировки (СН - О - СН2СОООН).
Карбоксильные группы таких ионитов отрицательно заряжены при pH5 и выше и, следовательно, способны связывать белки, которые в этих условиях несут положительный заряд. Связывание белков усиливается, если на их поверхности встречаются скопления («гроздья») катионных групп. При прочих равных условиях с катионитом лучше связываются белки большей молекулярной массы, что объясняется неоперативностью многоточечного взаимодействия обширных участков поверхности такого белка с анионными группами ионообменника.
Десорбция белков, связанных катионитом, обычно достигается повышением ионной силы элюирующего раствора, причем взаимодействующие между собой заряженные группы белка и ионита оказываются в окружении противоположно заряженных ионов солей. В результате при определенной концентрации соли, характерной для каждого белка, электростатические взаимодействия между ним и ионитом снимаются, и белок элюируется с колонки. Плавное увеличение ионной силы раствора, применение линейного или более сложного градиента концентрации соли вызывает десорбцию сначала наиболее слабо удерживаемых молекул, затем более прочно связанных белков и т.д. В препаративных опытах нередко прибегают к ступенчатой элюции, при которой концентрация соли повышается скачками. Это ускоряет разделение и позволяет собрать белок в небольшом объеме, однако легко приводит к образованию одним и тем же белком нескольких ложных пиков.
При промывании колонки с ионитом раствором соли подходящей концентрации белок десорбируется, иногда образуя довольно длинный «хвост», что может быть следствием неравномерного распределения ионных групп в сорбенте. Участки с их повышенным содержанием, скопления таких групп прочнее удерживают белок, что и вызывает задержку элюции и образование «хвоста». В такой ситуации скачкообразное повышение ионной силы элюирующего раствора резко улучшает условия десорбции, поэтому часть белка, которая в обычных условиях образовывала бы «хвост», десорбируется скачком, давая ложный пик.
Ввиду этого следует определять белковый состав каждой фракции независимым методом, например электрофорезом в полиакриламидном геле, или подвергать сомнительные пики повторной хроматографии в тех же условиях. Несоблюдение таких предосторожностей нередко приводит к ошибочному обнаружению «множественных форм» белков.
В принципе для десорбции белков с катионитов можно прибегать и к градиенту pH. Например, понижение pH до 3-4 приводит к протонированию карбоксилатных ионов карбоксиметилцеллюлозы или аналогичных ионитов и постепенной десорбции связанных с ними белков. Можно рассчитывать и на достижение изоэлектрической точки сорбированного белка, что опять-таки вызвало бы его десорбцию. Однако такой прием используют не часто не только из-за опасности денатурации белков при понижении pH, но и из-за осложнений, связанных с сорбцией ионитом части ионов элюирующего раствора и неопределенностью вызываемых этим локальных изменений pH. По таким же соображениям не рекомендуется использовать в ионообменной хроматографии белков растворы, содержащие несколько разных катионов или анионов.
Помимо карбоксильных катионитов, о которых шла речь выше, применяют катиониты, содержащие сульфогруппы —SO-3, например сульфопропилсефадекс. В отличие от карбоксильных сульфогруппы сохраняют отрицательный заряд практически при всех pH, используемых в хроматографии белков.
Ионогенные группы фосфоцеллюлозы слабее, чем у сульфопропил-сефадекса, но сильнее карбоксильных. Оказалось, что этот ионообменник может применяться в качестве биоспецифического сорбента при выделении некоторых ферментов фосфорного обмена. Среди анионитов наибольшее распространение получили диэтил-аминоэтил (DEAE)-целлюлоза и ее аналоги с иными матрицами:

диэтиламиноэтильная группа, присоединенная к целлюлозе или другой полисахаридной матрице
Основность диэтиламиноэтильной группы в сорбентах этого типа несколько ниже обычной из-за влияния окружающих ее гидроксильных групп, так что ее рКа равен 9,5 DEAE-целлюлоза эффективна как анионообменник вплоть до pH 8,5—9,0. Аниониты, содержащие четвертичные аммонийные группы, — QAE-сефадекс или QAE-сефароза — сохраняют положительный заряд и при более высоких pH.
Хроматография белков на DEAE-целлюлозе и аналогичных анионитах, подобно хроматографии на катионитах, определяется многоточечным связыванием отрицательно заряженных групп белка (прежде всего карбоксильных) с катионными группами ионообмениика. Как и при хроматографии на катионитах, десорбции белков достигают повышением ионной силы элюирующего раствора, ее можно проводить ступенчато или с применением градиента концентрации соли. И в этом случае не рекомендуют градиенты pH и использование растворов, содержащих разные анионы Например, при десорбции белков хлористым натрием с DEAE-целлюлозы, уравновешенной ацетатным буфером, помимо экранирования разноименно заряженных групп сорбента и белка происходит замещение удерживаемых анионитом ацетат-ионов ионами хлора. Если элюция проводится в слабокислых растворах, де сорбированные ацетат-ионы, связывая протоны, вызовут сдвиг pH в щелочную сторону, что приведет к локальному изменению условий элюции и сделает процесс трудноконтролируемым.
В последнее время в хроматографии белков все шире применяют ионообменники на основе гидрофильных органических полимеров, получаемых в форме шариков строго одинакового диаметра (10 мкм) и обладающих большой рабочей поверхностью. Стандартность гранул таких ионитов снижает размывание хроматографических пиков за счет различий во времени диффузии белковых молекул внутри сорбента — фактор, ограничивающий эффективность обычных ионообменников с неодинаковыми гранулами. Носители этого типа жестки, что позволяет достигать весьма высоких скоростей протекания растворов через колонку при давлении поряд ка 20 атм*. Совместное действие этил факторов резко повышает эффективность и скорость хроматографии белков на такого рода сорбентах, получившей название быстрой жидкостной хроматографии белков (английское сокращенное обозначение FPLC). В качестве сорбентов используют Моно-Q — сильный анионит с четвертичными аммонийными группами, Моно-S — сильный катионит, содержащий сульфогруппы, или Моно-Р — катионит с фосфатными группами (рис. 3.2).
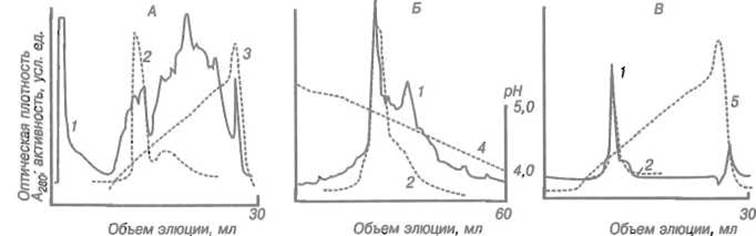
Рис. 3.2. Очистка щелочной фосфатазы ионообменной хроматографией.
I — оптическая плотность при 280 нм, отражающая общее содержание белка; 2 — активность щелочной фосфатазы;
А — разделение неочищенного препарата на анионите Mohо-Q при pH 8 в градиенте концентрации NaCl 0-0,35 М (3); Б — хроматофокусирование на Моно-Р щелочной фосфатазы, очищенной на предыдущей стадии в градиенте pH (4); В — хроматография фракции, выделенной на Моно-Р, на анионите Моно-Q в градиенте концентрации NaCl (5)
К сожалению, до сих пор не удалось разработать достаточно эффективный способ препаративного электрофореза белков в гелях, хотя их аналитическое разделение электрофорезом в полиакриламидном геле дает очень хорошие результаты и является ведущим методом в исследовании белковых смесей и индивидуальных белков.
* 1 атм = 0,1 МПа.