Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Вторичная структура
ß-Изгиб
Как а-спираль, так и ß-структура обычно представлены в глобулярных белках сравнительно короткими отрезками, поэтому значительная часть вторичной структуры белка приходится на разного рода петли, позволяющие изменить направление пептидной цепи. Наиболее экономный структурный элемент, позволяющий повернуть полипептид на 180°, используя всего три пептидные группировки, получил название ß-изгиба (рис. 5.12). ß-Изгиб стабилизируется одной водородной связью. Его образованию могут мешать объемистые боковые цепи аминокислот, поэтому предпочтительно включение в него остатка глицина. Заметим, что ß-изгиб практически всегда оказывается на поверхности белковой глобулы, поэтому нередко он играет существенную роль в ее взаимодействии с другими молекулами, например с иммуноглобулинами.
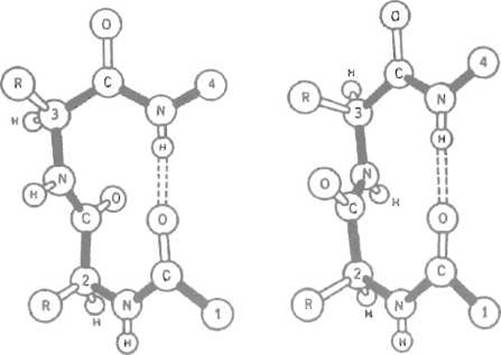
Рис. 5.12. ß-Изгиб (две возможные структуры.) Поворот пептидной цепи на 180° происходит на отрезке, содержащем четыре аминокислотных остатка, причем между кислородом карбонильной группы 1-го остатка и водородом NH-группы 4-го образуется стабилизирующая изгиб водородная связь
Приведенная на рис. 5.13 карта Рамачандрана для реального белка, основанная на данных рентгеноструктурного анализа, показывает, что большинство аминокислотных остатков имеет конформацию, свойственную a-спирали или ß-структуре. Лишь точки, соответствующие углам φ и ψ для остатков глицина, оказываются мало связанными конформационными ограничениями и распределены почти по всему полю карты.
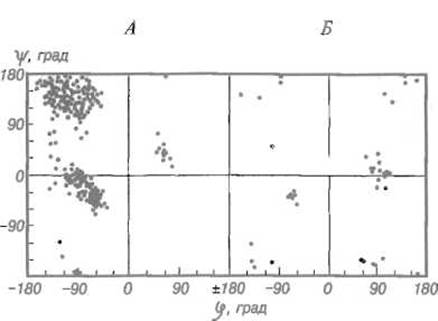
Рис. 5.13. Карта Рамачандрана для глутатионредуктазы.
А — точки, отвечающие конформации 419 аминокислотных остатков (исключая глицин), сгущаются в понижениях, долинах, которые соответствуют а-спирали (нижний левый квадрант) и ß-структуре (верхний левый квадрант), встречаются и на перевале между ними. Небольшая группа остатков имеет конформацию, характерную для левой а-спирали (φ = 60°, ψ = 40°); Б — точки, отвечающие 41 остатку глицина, из которых 29 соответствуют наборам углов φ и ψ, не разрешенным для других аминокислотных остатков
Таблица 5.1 Относительное содержание в глобулярных белках аминокислотных остатков, принадлежащих различным типам вторичной структуры (по данным рентгеноструктурного анализа)
|
Содержание аминокислот, % |
||||
|
Белок |
а-спираль |
ß-структура |
ß-изгиб |
нерегулярные участки |
|
Миоглобин |
79 |
0 |
5 |
16 |
|
Парвальбумин |
62 |
5 |
17 |
16 |
|
Аденилаткиназа |
54 |
12 |
19 |
15 |
|
Инсулин |
51 |
24 |
12 |
13 |
|
Лактатдегидрогеназа |
45 |
24 |
6 |
25 |
|
Лизоцим |
41 |
16 |
23 |
20 |
|
Цитохром с |
39 |
0 |
24 |
37 |
|
Карбоксипептвдаза А |
37 |
15 |
26 |
22 |
|
Термолизин |
36 |
22 |
18 |
24 |
|
Субтилизин BPN |
31 |
10 |
22 |
37 |
|
Ингибитор трипсина |
28 |
33 |
3 |
36 |
|
Папаин |
28 |
14 |
17 |
41 |
|
Нуклеаза |
24 |
15 |
18 |
43 |
|
Рибонуклеаза А |
23 |
40 |
13 |
24 |
|
а-Химотрипсин |
9 |
34 |
34 |
23 |
|
Эластаза |
7 |
52 |
26 |
25 |
|
Конканавалин |
2 |
51 |
9 |
38 |
Относительное содержание вторичных структур различного типа в белках меняется в очень широких пределах (табл. 5.1), причем доля нерегулярных структур подчас оказывается весьма значительной.