Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Вторичная структура
ß-Структура
Набор углов, отвечающий этой структуре, соответствует на карте Рамачандрана обширной глубокой впадине. В отличие от а-спирали ß-структура стабилизируется взаимодействиями между соседними отрезками пептидной цепи, т е. несколько более далекими контактами. Эти отрезки могут быть направлены в одну сторону — параллельная ß-структура (угол φ = -119°, ψ = +113°) — или в противоположную — антипараллельная ß-структура (φ = -139°, ψ = +135°).
Рассмотрим систему водородных связей между двумя отрезками пептидной цепи, образующими параллельную ß-структуру. В этом случае (рис. 5.7) NH-гpyппa какого-либо остатка в отрезке А дает водородную связь с карбонильной группой і-го остатка пептидной цепи В, а карбонильная группа того же аминокислотного остатка цепи А — с NH-группой (і+2)-го остатка в параллельной цепи В. Важно, что (і+1)-й остаток цепи В при этом как бы пропущен и его NH- и карбонильная группы во взаимодействии с цепью А не участвуют. Точно так же далеко не все С=О- и NH-группы цепи А участвуют во взаимодействии с цепью В.
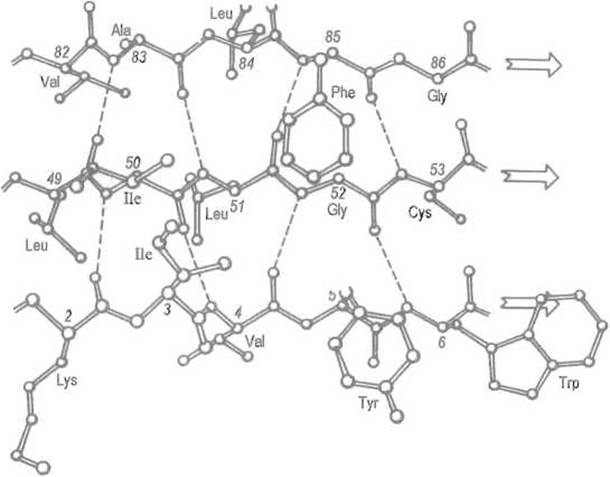
Рис. 5.7. Параллельная ß-структура.
Показана модель параллельного ß-складчатого слоя в флаводоксине. Водородные связи (пунктирные линии) образуют 19-членные циклы Стрелки указывают направление хода пептидных цепей
Таким образом, два отрезка параллельной ß-структуры соединяются водородными связями, что приводит к формированию больших циклов из 12 атомов. Еще раз подчеркнем, что в каждой из цепей во взаимодействии с соседней участвует только половина групп, которые могли бы образовать водородные связи. Следовательно, каждый из этих участков пептидной цепи может образовать такую же систему водородных связей еще с одним отрезком, тот, в свою очередь, с другими и т.д. В отличие от а-спирали, насыщенной водородными связями и не способной поэтому взаимодействовать с другими участками белка на уровне вторичной структуры, каждый отрезок пептидной цепи в ß-структуре открыт для формирования более протяженной системы водородных связей.
В антипараллельной ß-структуре (рис. 5.8) водородные связи образуются между противоположно направленными пептидными группировками соседних отрезков, что приводит к чередованию 8- и 14-членных циклов. И в этом случае во взаимодействии с соседней пептидной цепью участвуют не все, а каждый второй аминокиелотный остаток. Половина пептидных групп остается свободной, что дает возможность присоедините к каждому из двух антипараллельно направленных отрезков еще по одному отрезку пептидной цепи, и т.д. Таким образом, и антипараллельная ß-структура не насыщена водородными связями и способна давать весьма протяженные образования, в которые включено несколько участков пептидной цепи.
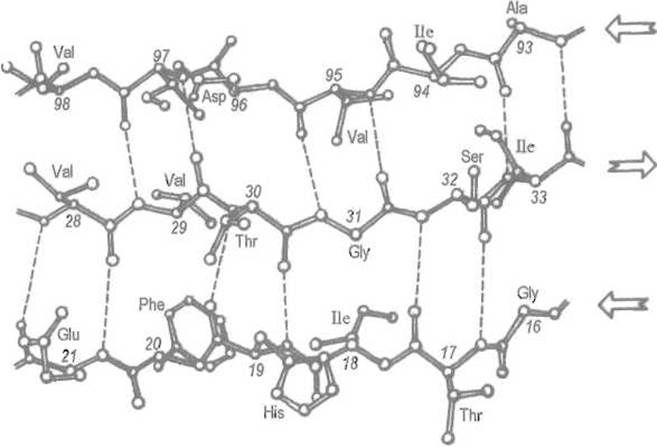
Рис. 5.8. Антипараллельная ß-структура.
Показан антипараллельный ß-складчатый слой в супероксиддисмутазе. Водородные связи (пунктирные линии) образуют чередующиеся 8- и 14-членные циклы
Число аминокислотных остатков в отрезке пептидной цепи, образующем ß-структуру, обычно колеблется от 3 до 8. Протяженная ß-структура, так называемый ß-слой или ß-складчатый лист (рис. 5.9), чаще всего состоит из 2-6 цепей, хотя иногда их число достигает и десяти.
Боковые группы аминокислотных остатков, соседних в пептидной цепи, при образовании ß-структуры оказываются по разные стороны ее поверхности. Сама же поверхность имеет складчатую форму, причем складки заданы а-углеродными атомами остатков, находящихся в соседних цепях. Отходящие от а-углеродных атомов боковые группы образуют и своего рода гребни. Это позволяет формировать довольно протяженные поверхности, насыщенные однотипными (например, гидрофобными) боковыми радикалами. Гидрофобные поверхности ß-складчатого слоя, взаимодействуя между собой или с гидрофобными же гребнями а-спиралей, могут участвовать в построении внутримолекулярных гидрофобных ядер, стабилизирующих пространственную структуру белка.
Следует иметь в виду, что поверхность ß-складчатого листа редко является плоской, чаще она закручена влево, если смотреть перпендикулярно ходу отрезков. Угол между соседними отрезками цепи составляет при этом около 25°. Многократное повторение такого мотива приводит к закручиванию листа в структуру, подобную винтовой лестнице. В результате угол между крайними отрезками пептидной цепи в ß-листе колеблется от 0° в структуре конканавалина А до 70—80° в дезоксирибонуклеазе I, 100° — в нуклеотидсвязывающем домене дегидрогеназ и достигает даже 220° в карбангидразе (рис. 5.10).

Рис. 5.9. ß-Складчатый слой.
А — антипараллельный ß-складчатый слой; вид «сверху»; прерывистыми линиями обозначены водородные связи, зачернены ß-атомы боковых групп: Б — вид «сбоку»; хорошо видны складчатость и размещение боковых групп по обе стороны слоя
Описаны также «барабаны», получающиеся при сворачивании протяженного ß-листа, когда крайние отрезки пептидной цепи смыкаются, формируя между собой систему водородных связей, которая свойственна ß-структуре. Очевидно, что ß-структура в таких случаях утрачивает характер локального образования, подчас пронизывая всю белковую глобулу (и перерастает рамки данного в начале главы определения вторичной структуры). Учитывая это, к протяженным ß-складчатым листам, играющим важную роль в формировании третичной структуры белка, применяют термин супервторичная структура.
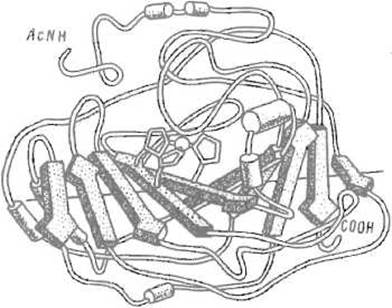
Рис. 5.10. Протяженный ß-складчатый слой (в карбангидразе человека). Десять отрезков ß-структуры (преимущественно антипараллельной) закручены относительно друг друга, образуя супервторичную структуру, которая напоминает винтовую лестницу. Угол между первым и последним отрезками близок к 220°. Показаны ацетилированный аминный — AcNH и карбоксильный — СООН концы полипептидной цепи
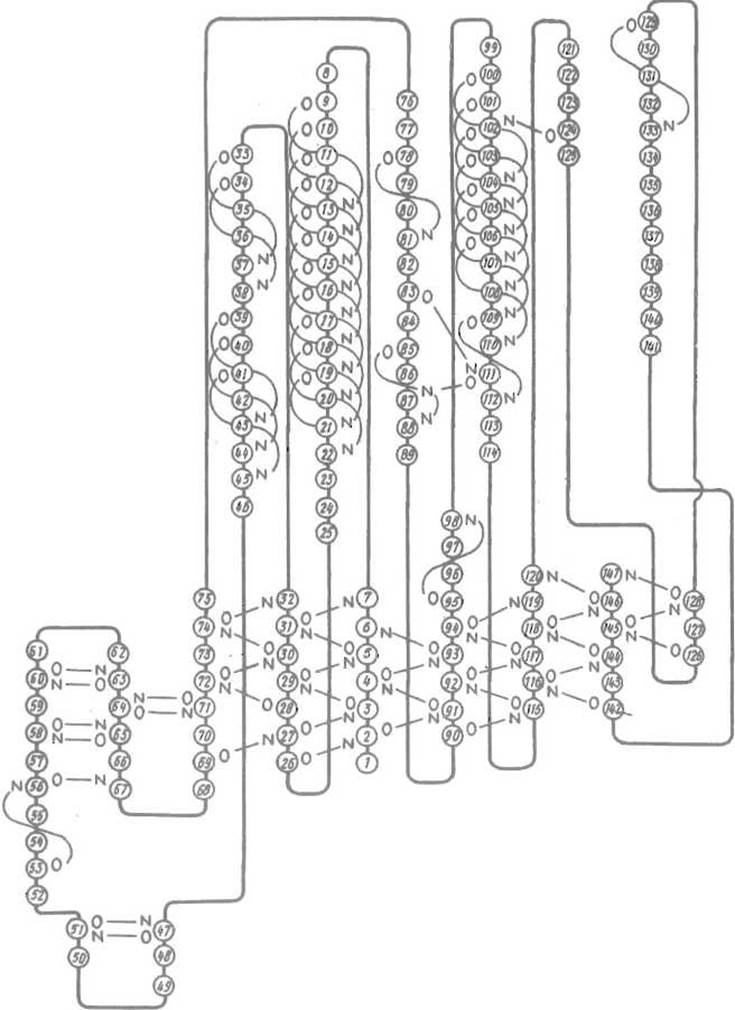
Рис. 5.11. Схема вторичных структур в НАД-связывающем домене глицеральдегидфосфатдегидрогеназы.
Тонкими линиями показаны водородные связи в а-спиралях (например, от NH-группы остатка 19 к С=О остатка 15 и т.д.), участках параллельной (от NH и С=О остатка 3 к соответственно С=О остатка 27 и NH остатка 29) и антипараллельной ß-структуры (отрезки 56-61 и 62-67). Есть и участки последовательности, например 134-141, которые не образуют системы водородных связей
На рис. 5.11 приведена схема НАД-связывающего домена глицеральдегидфосфатдегидрогеназы, иллюстрирующая многообразие вторичных структур в этой молекуле.