Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Вторичная структура
а-Спираль
В 1950-х годах Л. Полинг и Р. Кори, основываясь на данных о структуре кристаллов аминокислот и простых пептидов, рассмотрели возможные периодические конформации полипептидной цепи и пришли к выводу, что наиболее вероятна структура, названная ими а-спиралью. При этом в основу выбора именно этой вторичной структуры были положены следующие критерии:
1. Образование плотноупакованной компактной структуры без пустот и перекрывания атомов.
2. Максимальная насыщенность структуры водородными связями с тем условием, чтобы геометрия водородной связи О ∙∙∙ Н ∙∙∙ N была близка к линейной.
3. Соблюдение межатомных расстояний и углов, свойственных аминокислотам и простым пептидам.
С соблюдением этих условий можно построить как правую, так и левую а-спирали, однако правая а-спираль (рис. 5.5) оказывается энергетически несколько выгоднее левой, если пептидная цепь образована L-аминокислотами. Левой а-спирали отвечает на карте Рамачандрана небольшая впадина с углами φ = +57° и ψ = +47°.
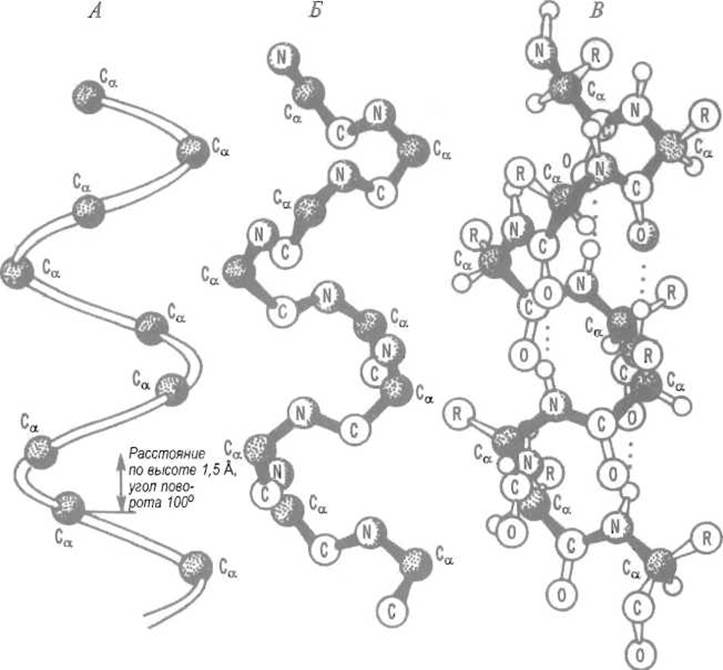
Рис. 5.5. Правая а-спираль. А — показаны только Са-атомы; Б — все атомы скелета пептидной цепи; В — более полная структура.
Пептидная цепь (от N- к С-концевому остатку) направлена сверху вниз. Водородные связи соединяют карбонильный кислород і-го остатка с водородом NH-группы (і+4)-го. В пространстве соседствуют боковые цепи аминокислот, разделенных двумя или гремя остатками. Размещение атомов в спирали кажется свободным только потому, что они для наглядности показаны в уменьшенном масштабе. С учетом реальных радиусов атомов а-спираль представляет собой плотно упакованную структуру, лишенную внутреннего канала и не проницаемую даже для воды. В проекции на ось спирали расстояние между соседними Са -атомами составляет 1,5 А, угол поворота, приходящийся на один остаток, равен 100°. На полный поворот спирали (360°) приходится 3,6 остатка
Теоретические выводы Полинга и Кори в дальнейшем полностью оправдались. а-Спираль действительно представляет собой один из основных, хотя и не единственный тип вторичной структуры.
а-Спираль характеризуют следующие параметры. Теоретически предсказанные величины двугранных углов: φ = -58° и ψ = -41°; средние значения, по данным рентгеноструктурного анализа 57 белков, φ = -62°, ψ = -41°. Ее радиус равен 2,3 Å1, высота подъема спирали, приходящаяся на один аминокислотный остаток, — 1,5 А, среднее число остатков на один оборот — 3,6, шаг спирали (т.е. высота, на которую пептидная цепь поднимается за один оборот) — 5,4 Å. Все карбонильные группы в а-спирали ориентированы в одном направлении — вперед, если считать по хода пептидной цепи, от аминного конца к карбоксильному, а N—Н-группы — назад.
Между С=О- и N—Н-группами устанавливаются водородные связи (рис. 5.5.) так, что карбонильная группа 1-го остатка образует связь с N—Н-группой (і+4)-го, карбонильная группа (і+Н)-го — с N—Н-группой (і+5)-го и т.д. То, что «над» карбонильной группой і-го остатка оказывается NH-группа, а не карбонил (і+4)-го остатка, примерно и соответствует 3,6 остатка на оборот спирали.
Каждая пептидная группа поляризована и характеризуется определенным дипольным моментом, причем отрицательный заряд концентрируется на кислороде карбонильной группы, а положительный — на атоме азота. Из-за однонаправленности пептидных групп в а-спирали их дипольные моменты согласуются и а-спираль как целое приобретает дипольный момент, на ее концах концентрируются частичные отрицательный и положительный заряды, что может играть в белке существенную функциональную роль.
Возможности образования водородных связей между пептидными группами в а-спирали использованы сполна. В этом смысле а-спираль является как бы насыщенной, внутренне замкнутой Она не способна (в отличие от ß-структуры) к взаимодействию с другими элементами вторичной структуры за счет образования водородных связей между пептидными группами.
В формировании пространственной структуры белка важную роль играют нековалентные контакты, в которых участвуют боковые цепи аминокислот, входящих в а-спираль. При этом существенно, что на поверхности а-спирали оказываются сближенными боковые цепи аминокислот, разделенных двумя или тремя остатками в пептидной цепи. Если в этих позициях находятся гидрофобные аминокислоты, они образуют своеобразный гидрофобный гребень. Взаимодействие между такими гребнями используется как способ упаковки а-спиралей в пространственной структуре белка. Точно так же могут быть образованы и гидрофильные, в частности заряженные, поверхности. Поэтому а-спираль может быть чисто гидрофобной, что характерно для трансмембранных участков белков, или амфифильной, т е, обладающей как гидрофобной, так и гидрофильной сторонами (рис. 5.6).
1 1Å = 0,1 нм.
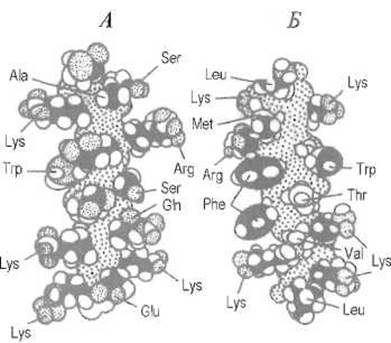
Рис. 5.6. Распределение гидрофильных и гидрофобных аминокислот на поверхности одной из а-спиралей аполипопротеина С-1. А — гидрофильная поверхность, Б — гидрофобная поверхность, на которой легко проследить гребень, который образуют (снизу-вверх) боковые цепи лейцина, валина, двух остатков фенилаланина, метионина и снова лейцина
Длина а-спиральных участков в глобулярных белках относительно невелика и обычно составляет 5-15 аминокислотных остатков, редко превышая 3-4 оборота спирали; в фибриллярных белках она гораздо протяженнее. Иногда наблюдаются изломы а-спирали, обычно в местах включения остатков пролина, прерывающих систему водородных связей. При этом ось спирали отклоняется на 20-30°