Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Вторичная структура
Роль водородных связей в формировании вторичной структуры
До сих пор, обсуждая вторичную структуру, мы рассматривали упрощенную модель поведения аминокислотного остатка в пептидной цепи, концентрируя внимание на стерических ограничениях, которые могут быть вызваны его ближайшими соседями. Следующий шаг, усложняющий картину и вместе с тем приближающий ее к реальности, — учет нековалентных взаимодействий между ближними остатками в периодической вторичной структуре. При этом мы по-прежнему абстрагируемся от вклада боковых групп и пренебрегаем дальними взаимодействиями с другими частями молекулы.
Главная цепь полипептида содержит только один периодически повторяющийся элемент, способный устанавливать водородные связи, — пептидную группировку, которая при этом может выступать и как донор, и как акцептор.
Насколько существенной может быть стабилизация вторичной структуры за счет водородной связи? Для ответа на этот вопрос следует учесть фактор, который до сих пор не рассматривался, — влияние окружающей белок воды. Вода способна эффективно конкурировать за образование водородных связей, имея возможность быть и донором и акцептором:

Можно предвидеть, что влияние воды будет снижаться при формировании компактной пространственной структуры белка, росте содержания пептидных связей, повышении вероятности их взаимодействия друг с другом. Действительно, изучение простейшей модельной системы N-метилацетамида (СН3—СО—NH—СН3) показало, что при малых его концентрациях образование димеров, например
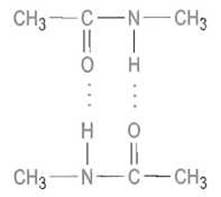
за счет возникновения межмолекулярных водородных связей практически не наблюдается. Лишь при очень высокой концентрации N-метилацетамида (до 10 М) он практически полностью димеризуется. В отсутствие же воды, например в тетрахлориде углерода, полная димеризация достигается уже при 0,2 М концентрации амида.
В белке реализуются оба эффекта — пептидные связи сближены, находясь в свернутой цепи, вероятность их встречи примерно такая же, как в 9 М растворе N-метилацетамида. Разумеется, очень существенно и то, что сближение пептидных связей в белке происходит не случайным образом, как в концентрированном растворе амида, а в кооперативной системе. В то же время в компактной белковой глобуле полярность окружения пептидной связи значительно меньше, чем в воде. Сложение этих двух факторов и делает водородную связь между пептидными группировками весьма важным структурообразующим фактором.
Таким образом, стабильность вторичной структуры существенным образом зависит от ее включения в компактную третичную структуру белка. Напротив, в пептидах из-за меньшего их размера вторичная структура не обеспечивает необходимой стабильности. Так, даже довольно длинный природный пептид — глюкагон, содержащий 29 аминокислотных остатков, — существует в растворе как равновесная смесь конформеров, и только при образовании комплекса с белком-рецептором, т.е. при включении в компактную структуру за счет нековалентных взаимодействий, он образует а-спираль.