Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Вторичная структура
Стерические ограничения и вторичная структура пептидной цепи
Углы вращения вокруг связей N—Сa и Сa—С(О) называют соответственно углами φ и ψ (рис. 5.2). Для отсчета этих двугранных углов прибегают к следующему приему. Если представить, что наблюдатель смотрит вдоль связи N—Сa, то «следующая» связь Сa—С(О) может оказаться заслоненной «предшествующей» связью С(О)—N. Такой конформации (заслоненной или цисоидной, очевидно, невыгодной стерически) соответствует угол φ = 0°. Если связь Сa —С(О) не заслонена и для достижения заслоненной конфигурации связь С(О)—N нужно вращать по часовой стрелке, угол φ считается положительным и возрастает до 180°. В последнем случае достигается трансоидная конфигурация. В противоположном направлении отсчитываются отрицательные значения угла φ от 0° до -180°. Аналогично для определения угла ψ смотрят вдоль связи Сa—С(О), при этом заслоненной конформации (когда связь N—Сa закрывает связь С(О)—N) приписывается угол ψ = 0°, а трансоидной — угол + или —180°.
Значения углов φ и ψ для какого-либо аминокислотного остатка характеризуют его положение во вторичной структуре. Если указать эти значения для всей последовательности аминокислот, то ими определится свертывание данного полипептида в пространстве. Как отмечалось, принципиально возможны любые наборы значений двугранных углов φ и ψ, однако многие из них сопряжены со значительными стерическими помехами и отвечают весьма невыгодным энергетическим конформациям.
Для описания стереохимии аминокислотных остатков в белках удобна карта Рамачандрана, представляющая собой квадрат, по одной стороне которого отложены значения угла φ от -180° до +180°, а по другой — значения угла ψ (рис. 5.3, 5.4). Если бы не накладывалось никаких ограничений на стереохимию полипептидной цепи, то углы φ и ψ могли бы принимать любые значения и точка, характеризующая их набор, а значит, и конформацию того или иного аминокислотного остатка, могла бы оказаться в любом месте карты.
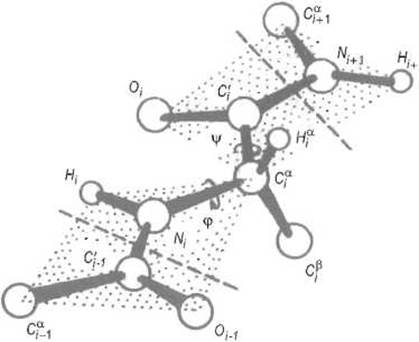
Рис. 5 2. Двугранные углы полипептидной цепи.
Угол у определяется поворотом связи Ni—Cai вокруг связи Cai—С'i, если смотреть по ходу пептидной цепи, т.е. от Cai к углероду карбонильной группы С'i, как показано стрелкой. Принято считать, что если первая связь закрывает связь С'i— Ni+1 (цисоидная конфигурация), то угол (ψ = 0°, если же эти связи находятся в наиболее удаленных положениях (трансоидная конфигурация), то угол ψ равен +180 или -180°. Положительным считается вращение по часовой стрелке. Угол φ определяется поворотом связи С'i-1, вокруг связи Ni — Сai. Цисоидной конфигурации, при которой связи, примыкающие к Ni—Cai, закрывают одна другую, соответствует φ = 0°, трансоидной — φ = ±180°. На рисунке изображена так называемая вытянутая конформация пептида, при которой углы φ и ψ равны +180°.
В действительности допустимы вовсе не любые комбинации углов φ и ψ. Это связано с тем, что при изменении обоих углов изменяется и положение атомов в соседних аминокислотных остатках относительно друг друга. Сближение в пространстве атомов, особенно объемистых (кислорода, углерода, азота), приводит к их взаимному отталкиванию. Преодоление этого отталкивания требует значительных энергетических затрат, что делает такую конфигурацию полипептидной цепи неустойчивой. Карты Рамачандрана подобны географическим, на них нанесены горизонтали, соответствующие тому или иному энергетическомy уровню. Более выгодной конформации соответствует меньший энергетический уровень, который на карте Рамачандрана выглядит как долина, впадина; наименее выгодной отвечает гребень, хребет.
Рассмотрим карту Рамачандрана для остатков глицина, не имеющих боковой группы (см. рис. 5.3). В этом случае разрешена довольно большая часть карты, возможен широкий набор углов φ и ψ. Однако случаи, когда эти углы близки к нулю, невыгодны: это отвечает заслоненной конфигурации, при которой особенно сказывается перекрывание атомов кислорода карбонильных групп. Конформационная карта Рамачандрана для глицина проста — она показывает крестообразную «запрещенную» возвышенность вдоль осей с φ = 0°, ψ = 0° и довольно обширные понижения, охватывающие не менее половины общей поверхности.
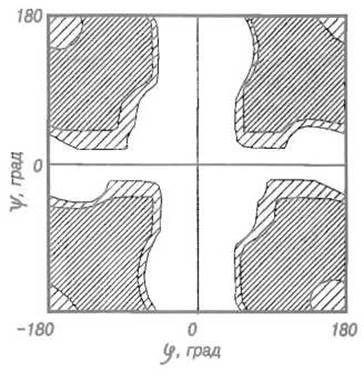
Рис. 5.3. Карта Рамачандрана для глицина.
Отложена потенциальная энергия для пары пептидных звеньев с остатком глицина между ними (изоэнергетические линии). Для глицина неблагоприятны конформации, занимающие на этой карте крестообразную возвышенность вдоль значений φ и ψ, близких к 0°, что соответствует заслоненной конфигурации; обширные понижения (затемнены) отвечают разрешенным областям. Ср. рис. 5.13, на котором показано, что остатки глицина в реальных белках позволяют прилегающим пептидным связям занимать относительно друг друга весьма различные конформации.
Эта особенность глицина как остатка с наименьшими конформационными ограничениями играет специфическую роль в формировании пространственной структуры белка. Характерно, что на картах Рамачандрана для реальных белков точки, соответствующие остаткам глицина, не сгущаются в двух главных долинах, как это свойственно для других аминокислот, а распределяются почти по всему полю. Очевидно, что остатки глицина используются в тех точках пространственной структуры белка, где необходима нестандартная конформация, в частности при резких поворотах пептидной цепи. Не случайно, что остатки глицина, казалось бы, неспособные из-за отсутствия боковой цепи непосредственно участвовать в функционировании белка, чаще других оказываются инвариантными в семействах эволюционно родственных белков, что указывает на их незаменимость в структурообразовании.
Очевидыо, что набор разрешенных конформаций существенно уменьшится, если отойти от рассматривавшейся до сих пор упрощенной схемы и учесть стерическое влияние боковых цепей аминокислот. Было бы нелегко проанализировать вклад всех 19 боковых цепей, однако в этом нет необходимости. Наиболее значительные ограничения на конформационную свободу аминокислотных остатков накладывает появление простейшего заместителя у Са-атома — метальной группы в остатке аланина. Дальнейшие усложнения боковой цепи происходят сравнительно далеко от главной цепи и мало влияют на выбор ею оптимальной конформации. Карта Рамачандрана для аланина в достаточном приближении верна и для других аминокислот.
На этой карте (рис. 5.4) выявляются две долины, отвечающие стабильным конформациям, т.е. оптимальным сочетаниям углов φ и ψ, и неглубокая впадина. Одна из долин соответствует правой а-спирали, характерной для белков (φ = -57°, ψ = -47°), другая — параллельной ß-структуре (φ = -119°, у = +113°) и антипараллельной ß-структуре (φ = -139°, у = +135°).

Рис. 5.4. Карта Рамачандрана для L-аланина.
Показано распределение потенциальной энергии для остатка аланина, окруженного двумя пептидными звеньями в координатах φ и ψ (см. подпись к рис. 5.3). Глубокая долина в верхнем левом квадранте соответствует конформации, характерной для ß-структуры; соединенная с ней перевалом долина в левом нижнем квадранте — правой а-спирали (aR), обычно встречающейся в белках. Небольшое понижение в правом верхнем квадранте соответствует крайне редкой левой а-спирали (аL). Следует обратить внимание, что карту можно свертывать относительно осей φ, ψ = 0°, поэтому, например, долина, соответствующая ß-структуре, продолжается у нижнего обреза карты слева
То, что для обычных аминокислот разрешены лишь две области, две долины на конформационной карте, а значит, и два набора (с известными допусками) углов φ и у, в какой-то мере предопределяет и ограниченность набора периодических вторичных структур. Так, присоединяя к аминокислотному остатку с набором φ = -57°, ψ = -47° другой остаток с примерно такими же двугранными углами, затем третий и т.д., получим периодическую вторичную структуру — а-спираль. Точно так же, соединяя в цепь остатки с двумя другими разрешенными наборами углов, придем к двум известным типам ß-структуры.