Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Вторичная структура
Структурные особенности пептидной связи
Вторичной структурой называют пространственное расположение атомов главной цепи молекулы белка на отдельных ее участках.
В соответствии с этим определением любой участок белка имеет вторичную структуру. Иногда рассматривают как вторичную структуру только те ее элементы, которые являются периодическими. а-спираль и ß-структуру. Однако в белках нередко встречаются такие участки пептидной цепи, которые уложены вполне определенным способом, хотя их пространственная структура не содержит какого-либо периодически повторяющегося, регулярного мотива. Тем не менее к ним вполне приложимо понятие вторичной структуры. Следует различать два вида вторичных структур: регулярные и нерегулярные.
Понятие вторичной структуры, как подчеркивается в его определении, относится не ко всей белковой молекуле в целом, а к отдельным, более или менее протяженным участкам ее полипептидной цепи. Обсуждая вторичную структуру, мы, по крайней мере на первых порах, абстрагируемся от дальних взаимодействий в молекуле белка, а также от вклада боковых групп аминокислотных остатков, концентрируясь на главной цепи белка. Ближние взаимодействия, которым принадлежит важнейшая роль в формировании вторичной структуры, определяются прежде всего особенностями пептидной связи.
Пептидной называют связь, образованную а-аминной и а карбоксильной группами аминокислот. Традиционное изображение пептидной связи
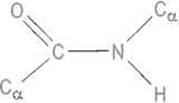
не вполне правильно передает ее электронную структуру. Двойная связь С = О карбонильной группы поляризована и в определенном смысле может быть представлена как одинарная связь с разделением зарядов:
![]()
причем отрицательный заряд локализуется на атоме кислорода Изучение кристаллических структур соединений, содержащих амидную связь, показало, что расстояние С—О в них примерно на 10% больше свойственного карбонильной группе в альдегидах и кетонах. Напротив, связь С—N за счет смещения свободной электронной пары азота к углероду приобретает в определенной мере характер двойной и укорочена опять-таки примерно на 10%. По Л. Полингу, электронная структура пептидной связи передается двумя резонансными структурами:
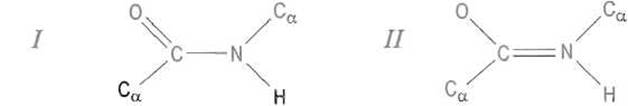
причем на долю структуры II с двойной связью углерод—азот в гибриде приходится около 40%. В результате азот пептидной связи практически полностью утрачивает основность. То обстоятельство, что связь С—N в пептидной группировке имеет характер частично двойной, приводит к важным стереохимическим последствиям: вращение вокруг нее сильно ограничено, она задает плоскость, в которой располагаются шесть атомов: О и С карбонильной группы, атомы азота и водорода группы NH и Са-атомы обоих аминокислотных остатков.
Плоскостная геометрия пептидной группировки и затрудненность поворота вокруг С—N-связи делают возможным существование достаточно устойчивых цис- и транс-изомеров, разделенных значительным энергетическим барьером (около 20 ккаль/моль1), что делает превращение одного изомера в другой редким событием. Они отличаются тем, что Са -атомы главной цепи размещаются по одну (цис-) или по разные (транс-) стороны пептидной связи С—N (рис. 5.1):

* 1 ккал = 4,184 кДж.

Рис. 5.1. Структура пептидной связи: А — транс- (типичная), Б — цис- (редко встречающаяся) конфигурация пептидной связи.
Атомы Cаі, Cаі+1, С и О карбонильной группы, N и связанный с ним И лежат в одной плоскости. Указаны межатомные расстояния в ангстремах и валентные углы. О конфигурации судят по ходу главной цепи
Транc-изомер пептидной связи энергетически выгоднее цис-изомера примерно на 2,6 ккал/моль, так как сближение Са-атомов в последнем вызывает пространственные затруднения. Эта разница между изомерами в значительной мере снимается, составляя 0,5 ккал/моль, если азот пептидной связи принадлежит пролину, поскольку в таком случае в обоих изомерах в цис-положении к Са-атому ацилирующего аминокислотного остатка оказываются Са- или Сδ-атомы пролина. Рентгеноструктурный анализ подтвердил, что пептидные связи в белках являются плоскими и представлены почти исключительно транс-изомерами. Цис- пептидные связи редки: их встречается, как правило, не более одной-двух на белок среднего размера, причем преобладают связи, образованные остатками пролина. Среди 32,5 тыс. пептидных связей в большой выборке изученных пространственных структур только 116 (0,36%) имели цис-кoнфигурацию, однако среди 1,5 тыс. связей Хаа1—Рrо1 цис-изомеров оказалось 6,5%. В качестве примера укажем цис-пептидные связи, образованные остатками Рrо-93 и Pro-114 в панкреатической рибонуклеазе, Pro-168 в субтилизине и связь Ser-197 — Туr-198 в карбоксипептидазе А.
Таким образом, пространственное строение полипептидной цепи может быть представлено как последовательность плоских элементов — пептидных группировок, соединяющихся между собой через Сa-атомы, которые служат своего рода шарнирами. Вращение плоских пептидных группировок может происходить вокруг двух простых связей, которые соединяют атом азота с Сa-атомом (N—Са) и Сa-атом с углеродом карбонильной группы (Сa—С(О)). Жестких запретов для вращения вокруг этих связей нет, однако есть некоторые предпочтительные конформации.
1 Хаа — обозначение любой аминокислоты.