Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Первичная структура белка
Определение первичной структуры пептидов
4.5.1. Определение С-концевых аминокислот
Определение С-концевых аминокислот и последовательностей пептидов разработано недостаточно. Единственным химическим методом идентификации С-концевых аминокислот, получившим распространение, является исчерпывающий гидразинолиз пептидных связей. При нагревании совершенно сухого препарата белка или пептида с безводным гидразином все пептидные связи расщепляются им с образованием соответствующих гидразидов аминокислот:
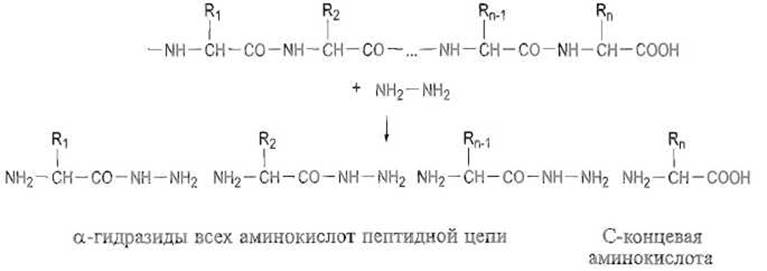
Последние, будучи основаниями (кроме а-гидразидов дикарбоновых аминокислот), легко отделяются (например, ионообменной хроматографией в условиях обычного аминокислотного анализа) от единственной свободной аминокислоты, содержащейся в продуктах гидразинолиза, которая и является С-концевым остатком.
Ферментативный метод, позволяющий не только идентифицировать С-концевой остаток, но и определить С-концевую последовательность небольшой длины, основан на последовательном отщеплении аминокислот от карбоксильного конца пептида (или белка) при действии карбоксипептидаз.
Карбоксипептидаза А. Фермент поджелудочной железы животных, содержащий ион цинка в активном центре. Активен в слабощелочной или нейтральной среде. Являясь экзопептидазой, фермент отщепляет от карбоксильного конца полипептидной цепи нейтральные и особенно легко гидрофобные аминокислоты. Труднее отщепляются остатки дикарбоновых аминокислот, еще труднее глицин и остатки, за которыми следует пролин. Не отщепляются вовсе пролин и остатки аргинина и лизина.
Карбоксипептидаза В. Также содержится в поджелудочной железе и гомологична карбоксипептидазе А, от которой отличается главным образом специфичностью, отщепляй С-концевые остатки аргинина и лизина.
Карбоксипептидаза Y (от англ. yeasts — дрожжи). Содержится в клетках дрожжей. Имеет остаток серина в активном центре и обладает весьма широкой специфичностью, отщепляя почти любые аминокислотные остатки (в том числе и остатки пролина) от карбоксильного конца полипептидной цепи. Аналогичные ферменты выделены из грибов и растений.
При действии карбоксипептидаз на пептидный или белковый субстрат после отщепления С-концевого остатка хотя бы от части молекул открывается возможность высвобождения из цепи следующего остатка, затем третьего с С-конца и т.д. Ввиду этого для определения С-концевой последовательности необходимо количественно определить накопление аминокислот в зависимости от времени реакции. Анализ данных дополнительно осложняется весьма значительными различиями в скорости отщепления аминокислот, отражающими специфичность фермента. Так, гидрофобные аминокислоты настолько легко отщепляются карбоксипептидазой А, что их количество нередко оказывается почти таким же, как и содержание ранее отщепившихся гидрофильных остатков, пептидные связи которых гидролизуются гораздо медленнее. Скорость гидролиза зависит и от природы аминокислот, предшествующих отщепляемому остатку Р'1 остатков — Р1, Р2 и т.д.
Таким образом, метод обычно дает возможность определить чередование лишь немногих, обычно 2-5, аминокислотных остатков на карбоксильном участке пептида.
4.5.2. Определение N-концевых аминокислот и последовательностей
Методы анализа пептидов с аминного конца разработаны значительно лучше, чем с карбоксильного, и являются основными при определении первичной структуры белков.
Идентификация N-концевой аминокислоты важна как одно из доказательств индивидуальности пептида или белка. Классическим является применение для этой цели реакции динитрофенилирования. Динитрофторбензол реагирует с а-аминогруппой белка или пептида с образованием окрашенного в желтый цвет (λmах ≈ 350 : 360 нм, молярная экстинкция около 15 000) 2,4-динитрофенил (Dпр)-производного (см. гл. 1). Одновременно в реакцию вступают и ε-аминогруппы остатков лизина, и гидроксильные группы тирозина. Затем динитрофенил-производное гидролизуют 5,7 М НСl при 105°С, причем расщепляются все пептидные связи, но сохраняются Dпр-аминокислоты (кроме производных глицина и пролина). Их выделяют из гидролизата и идентифицируют.
Метод почти полностью вытеснен так называемым дансильным методом. В этом случае в качестве реагента на аминогруппу используют 5-диметиламинонафталин-1-сулъфохлорид (дансилхлорид) (см. гл. I). Кислотный гидролиз полученного дансилпептида дает дансил-производное N-концевой аминокислоты, которое идентифицируют двумерной хроматографией на полиамидных пленках. Анализ облетается интенсивной флуоресценцией дансил-производных в ультрафиолетовом свете, что обеспечивает высокую чувствительность метода, позволяющего работать с количествами пептида порядка нескольких наномоль.
Наиболее продуктивно определение N-концевой последовательности в пептидах и белках фенилтиогидантоиновым методом ступенчатого отщепления аминокислотных остатков, предложенным П. Эдманом. Метод основан на следующей цепи реакций.
Обрабатывая пептид в щелочной среде фенилизотиоцианатом, его превращают в фенилтиокарбамил-производное:

Смысл этой операции состоит во введении нуклеофильного атома серы в положение, благоприятствующее реакции с углеродом карбонильной группы N-концевого остатка, которая происходит на следующей стадии при обработке фенилтиокарбамил-производного трифторуксусной кислотой:
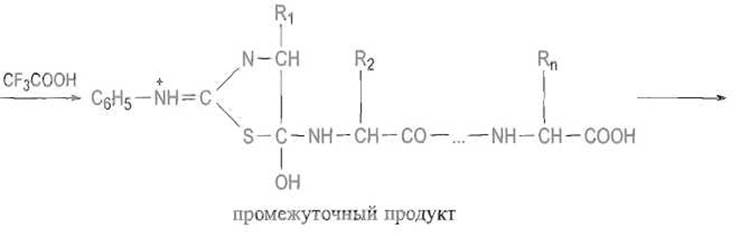
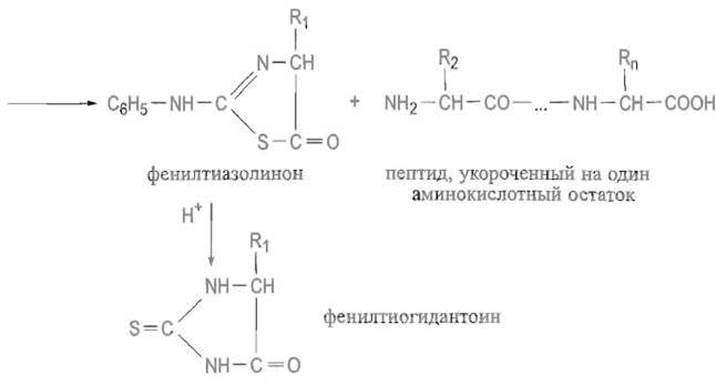
Результатом этой атаки является образование гипотетического промежуточного продукта, в котором атом углерода карбонила N-концевого остатка приобрел тетраэдрическую конфигурацию. Далее происходит разрыв связи С—N в этом соединении, причем образуются циклический фенилтиазолинон (производное аминоконцевого остатка) и пептид, укороченный на одну аминокислоту.
Фенилтиазолиноны недостаточно устойчивы, поэтому их подвергают, предварительно отделив от остаточного пептида, более жесткой кислотной обработке при нагревании и переводят в стабильные фенилтиогидантоины. Последние идентифицируют тонкослойной хроматографией на полиамидных пленках, газожидкостной или высокоэффективной жидкостной хроматографией.
Образовавшийся после отщепления N-концевого остатка остаточный пептид вновь обрабатывают фенилизотиоцианатом и подвергают далее такому же циклу превращений, отщепляя на этом шаге вторую аминокислоту, считая с аминного конца. Повторение циклов приводит к ступенчатому отщеплению последующих аминокислотных остатков.
Используется также вариант метода Эдмана, при котором идентифицируют не фенилгидантоин или другое производное аминокислоты, отщепленной в данном цикле, а следующий за ней остаток, прибегая для этого к определению N-концевой аминокислоты в небольшой доле (аликвоте) остаточного пептида методом дансилирования. Остальную, главную, часть остаточного пептида вводят в новый цикл деградации по Эдману, затем вновь определяют N-концевую аминокислоту в остаточном пептиде, укороченном уже на два остатка, и т.д. Такой способ позволяет обычно определить последовательность 10-15 аминокислот.
Гораздо большие возможности открыла автоматизация метода Эдмана: разработаны специальные приборы — автоматические секвенаторы белков и пептидов, основанные на его использовании. В одном из видов секвенатора пленку белка или пептида наносят на внутреннюю стенку быстро вращающегося стеклянного стаканчика, который затем используется как реактор. В него последовательно вводят фенилизотиоцианат, гептафтормасляную кислоту (высококипящий аналог трифторуксусной кислоты) и проводят циклизацию. Затем внутрь стаканчика подают ток 1-хлорбутана, который, распределяясь под действием центробежной силы по его внутренней стенке, экстрагирует отщепившийся фенилтиазолинон. Экстракт отводят из стаканчика и в отдельной операции превращают фенилтиазолин в фенилтиогидантоин. Укороченный белок или пептид остается в виде пленки на стенке стаканчика и далее подвергается следующему циклу отщепления по Эдману и т.д.
Все операции, включая подачу реагентов и промывание осадка белка или пептида, программированы. Прибор позволяет за сутки проделать 15 циклов отщепления. Выход фенилтиазолинона на цикле обычно близок к 95-99%, что позволяет определить за один опыт последовательность в 20-50, а иногда и больше аминокислотных остатков, используя весьма малые, порядка сотен наномоль, количества белка или пептида.
Метод ограничивают побочные реакции, например образование пироглутаминовой кислоты из N-концевого глутамина, a-ß-пepeгруппировка остатков аспарагиновой кислоты и в особенности неспецифическое расщепление пептидных связей при кислотной обработке. Неполное протекание реакции с фенилизотиоцианатом или циклизации влечет за собой постепенное «отставание» части пептидных цепей от общего хода отщепления аминокислот, вследствие чего на каждом шаге в анализируемой смеси появляются наряду с фенилтиогидантоином соответствующей аминокислоты более или менее значительные примеси фенилтиогидантоинов от предыдущих циклов отщепления.
Ввиду этого при анализе протяженных последовательностей чрезвычайно важно, чтобы каждый цикл протекал с выходом, близким количественному. Существенным ограничением являются потери остаточного белка или пептида, в особенности короткого за счет его растворения в используемых реагентах. Радикальный способ борьбы с такими потерями состоит в ковалентном присоединении к инертной матрице, например к макропористому стеклу, содержащему аминные группы. К такому носителю удается присоединить пептиды, полученные при расщеплении бромцианом за счет реакции лактона гомосерина с аминогруппами:
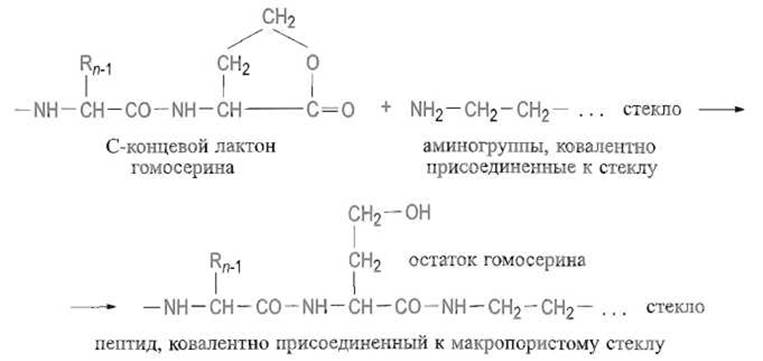
Пептиды, содержащие остатки лизина, присоединяют к аминогруппам на поверхности стекла при помощи реакции с бифункциональным сшивающим реагентом, например р-фенилендиизоцианатом:
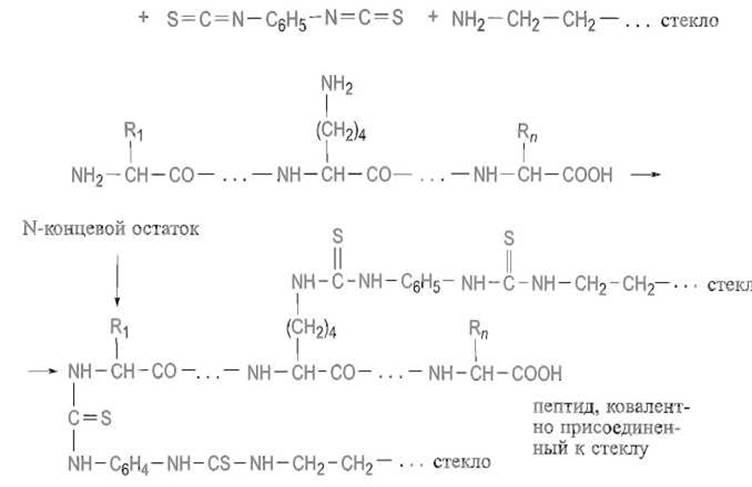
Этот реагент образует мостики между носителем и остатками лизина в пептиде, но одновременно блокирует и а-аминогруппу первого аминокислотного остатка. Однако после кислотной обработки N-концевой остаток отщепляется от пептида, хотя и остается связанным со стеклом При этом открывается аминогруппа второго аминокислотного остатка и становится возможным ступенчатое отщепление последующих аминокислот, хотя остатки лизина, прочно связанные с носителем, ускользают от анализа и «пропускаются». Идентификацию первого аминокислотного остатка проводят в отдельном опыте дансильным методом. Такие «твердофазные» секвенаторы применяют при анализе пептидов и небольших белков.
В еще одном типе секвенаторов — газофазном — принципиально те же реакции проводят с белком, сорбированным на пористой подложке, обрабатывая его парами реагентов и прибегая к жидкостной экстракции лишь для отделения фенилтиазолинонов. Это еще более снижает потери образца и дает возможность определять весьма протяженные последовательности, используя сотни пикомоль белков и крупных пептидов. Удается даже определять N-концевые последовательности в тех небольших количествах белков, которые содержатся в зонах, вырезанных из геля после электрофоретического разделения.
Методом Эдмана установлено подавляющее большинство последовательностей аминокислот при анализе первичной структуры белков.