Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Третичная структура белка
Домены в белках
Свойственный белкам способ организации пространственной структуры — формирование гидрофобного ядра и мозаичной поверхности, содержащей как гидрофильные, так и гидрофобные элементы, — на первый взгляд, ограничивает размеры глобулы, поскольку с увеличением ее объема строго гидрофобное ядро будет составлять все меньшую долю. В какой-то мере это так, но ограничение затрагивает лишь размеры данным способом организованной структуры, а не молекулы в целом. Действительно, начиная примерно с молекулярной массы 14-16 кДа прослеживается тенденция к формированию белковой молекулы из двух (и более) в той или иной степени независимо образованных глобул, каждая из которых имеет свое гидрофобное ядро. Такие глобулы — домены — формируются различными отрезками одной и той же полипептидной цепи.
Доменами в белках называют области в третичной структуре, которым свойственна определенная автономия структурной организации. Автономия эта подчас столь значительна, что домены могут независимо от других частей белковой молекулы поддерживать и даже формировать пространственную структуру. Во многих случаях удается разделить домены, подвергнув белок ограниченному протеолизу.
В рамках биологической функции данного белка домены нередко, хотя и не всегда, выполняют собственные задачи, и тогда структурная автономия домена дополняется функциональной. Например, нуклеотидсвязывающий домен дегидрогеназ, имеющий независимо от конкретной функции того или иного фермента одинаковый способ укладки полипептидной цепи, ответствен за взаимодействие с одним из субстратов реакции — коферментом NAD или NADH. Аминоконцевые домены (кринглы) ферментов системы свертывания крови обеспечивают связывание с липидами мембраны и другими белками (рис. 6.4), аминоконцевые домены иммуноглобулинов формируют центр связывания антигена.
Однако в ряде случаев для доменов нельзя указать отдельную функциональную роль. Например, в структуре протеолитического фермента папаина хорошо различимы два домена, каждый из которых имеет гидрофобное ядро. В N-концевом домене оно содержит два остатка валина, два — изолеицина, один — лейцина, в С-концевом — два остатка валина, два — лейцина, пять — фенилаланина. Между доменами, соединенными непрерывной пептидной цепью, устанавливается ряд гидрофобных контактов. Во впадине, разделяющей домены, расположен каталитический центр, причем образующие его функциональные группы размещены в обоих доменах. Быть может, на ранних этапах эволюции папаина домены и имели какую-то функциональную автономию, но в современном ферменте она полностью утрачена (рис. 6.5).
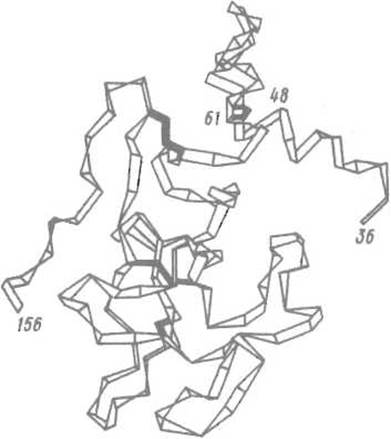
Рис. 6.4. Третичная структура одного из доменов протромбина.
При активации этот домен — первый «крингл» (остатки 66-144) — обеспечивает связывание протромбина с фосфолипидом. Изломы «ленты» соответствуют а-углеродным атомам аминокислотных остатков; зачернены дисульфидные связи. По-видимому, такова же третичная структура других «кринглов» — функционально специализированных доменов в ферментах системы гемостаза (в тромбине их два, в плазминогене — пять)
Чаще всего домены формируются автономным свертыванием последовательно расположенных участков полипептидной цепи, хотя известны случаи, когда пространственная структура домена образована двумя далеко отстоящими друг от друга отрезками первичной структуры белка.
Наличие доменов, видимо, создает структурные предпосылки для большей, чем в рамках единой пространственной структуры, внутренней гибкости, динамики белковых молекул, достигаемой смещением доменов относительно друг друга. Зоны, прилегающие к междоменному контакту, представляют собой в первом приближении впадину, опоясывающую белок. Это облегчает размещение участков специфического связывания белком различных лигандов, дегидратацию последних.
Предполагают, что домены соответствуют раннему этапу эволюции пространственной структуры многих белков, образовавшихся из глобул существенно меньшего размера. Например, необычно маленькая протеиназа вируса иммунодефицита человека (ВИЧ), пептидная цепь которой состоит всего лишь из 99 аминокислотных остатков, по способу свертывания похожа на домены пепсина — протеиназы, действующей по сходному механизму. Поскольку протеиназа ВИЧ активна только как димер, можно думать, что она эволюционно родственна какому-то древнему предшественнику доменов пепсина. Интересно, что границы доменов часто соответствуют границам экзонов. Это опять-таки позволяет предполагать, что они могли выступать как своеобразные блоки в процессе эволюции белков.
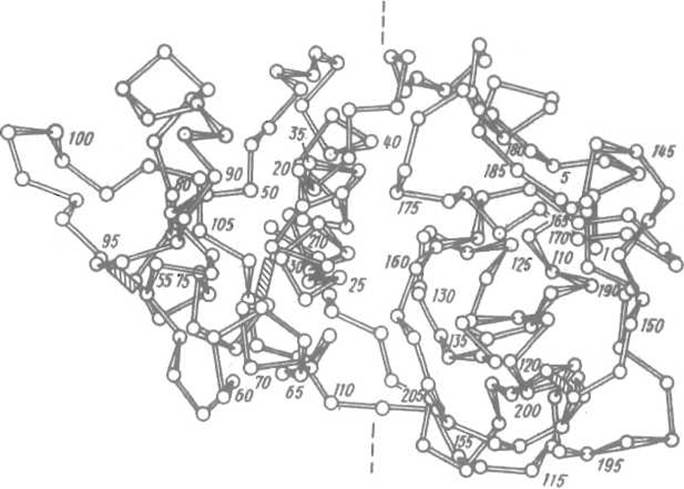
Рис. 6.5. Домены в структуре протеолитического фермента папайи — папаина. Прерывистыми линиями намечено направление впадины между двумя доменами, в которой связывается субстрат и размещен каталитический центр. Пептидная цепь завершает построение N-концевого домена к 110-му остатку и начинает формирование С-концевого со 111-го. Взаимодействие между доменами усиливается тем, что участок 1-16 N-концевого домена контактирует с С-концевым доменом, а С-концевой фрагмент последнего (остатки 208-212) — с N-концевым доменом. В каталитический центр входят остаток Cys-25 (в N-концевом домене), His-159 и Asn-175 (оба — в С-концевом домене). Заштрихованными прямоугольниками обозначены дисульфидные связи
Домены составляют подуровень структурной организации белка на пути от вторичной к третичной структуре, и свертывание достаточно крупных белковых глобул при биосинтезе белка проходит, вероятно, через стадию формирования доменов.