Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Четвертичная структура белка
Стехиометрия и геометрия четвертичной структуры
Субъединицы, образующие четвертичную структуру белка, могут быть совершенно различными как по строению, так и по функциональным свойствам. Такие белки относят к гетеромерным. Они встречаются довольно часто, позволяя объединить в одной структуре несколько взаимосвязанных функций, создать полифункциональную молекулу. К гетеромерам относится, например, протеинкиназа, в которой одна из субъединиц (С — каталитическая) ответственна за собственно ферментную активность и катализирует перенос фосфата АТФ на белок, а другая является регуляторной (R). В отсутствие циклического АМФ последняя связана с С-субъединицей в комплекс R—С и ингибирует ее. При образовании комплекса с цАМФ четвертичная структура распадается и С-субъединица оказывается способной фосфорилировать белковые субстраты. Ярким примером гетеромерного белка может служить РНК-полимераза.
В гомомерных белках субъединицы одинаковы. С ними сходны и такие, строго говоря, гетеромерные белки, субъединицы которых не одинаковы, но достаточно сходны как по способу свертывания полипептидной цепи, так и функционально.
Частоты, с которыми встречаются белки, построенные из двух, трех, четыре; и т.д. субъединиц, весьма различны. Так, для более или менее случайной выборки из примерно 200 белков с мол. массой не более 300 кДа оказалось: димеров — 102, тетрамеров — 53, гексамеров — 23, тогда как тримеров только 9, пентамеров ни одного, октамеров 3. Таким образом, подавляющая часть белков, имеющих четвертичную структуру, приходится на димеры, тетрамеры и гексамеры, причем последние встречаются у белков с мол массой больше 100 кДа.
Геометрия симметричных димеров очевидна. То же относится и к тримерам, которые весьма редки, однако встречаются. В частности, они могут играть существенную роль при образовании трансмембранных каналов, поскольку своего рода пучок из трех субъединиц сам по себе образует внутренний канал. В тетрамерных белках субъединицы могут размещаться в вершинах квадрата, что встречается редко, или же занимать вершины тетраэдра (рис. 7.2). Последний тип четвертичной структуры, в котором каждая субъединица взаимодействует с тремя остальными с различной силой, а молекула в целом оказывается весьма компактной, наблюдается особенно часто. Для гексамерных белков характерна
октаэдрическая упаковка, гораздо реже встречаются плоские гексагональные структуры.
Субъединицы, образующие симметричную четвертичную структуру, бывают идентичными, но могут и отличаться, будучи в то же время однотипными, эволюционно родственными белками, которые обладают одинаковым способом свертывания пептидной цепи в пространстве. В этих случаях формирование четвертичной структуры имеет характерные особенности. Если, например, тетрамерный белок образован структурно гомологичными однотипными субъединицами а и ß, то в зависимости от степени их отличия возможны две ситуации. В первом случае, когда контакты а—а, ß—а и ß—ß отличаются существенно, образуется четвертичная структура типа а2/ß2, другие же наборы субъединиц нестабильны и практически не обнаруживаются. Так, в частности, построены молекулы гемоглобинов. Если же межсубъединичные контакты практически равноценны, оказывается возможным образование набора всех возможных четвертичных структур, т.е. а4, а3 / ß1, а2 / ß2 > а1 / ß3 и ß4, причем доля каждой из этих множественных форм (заметим, что это далеко не единственная причина появления множественных форм белков) определяется относительным содержанием субъединиц а и ß.
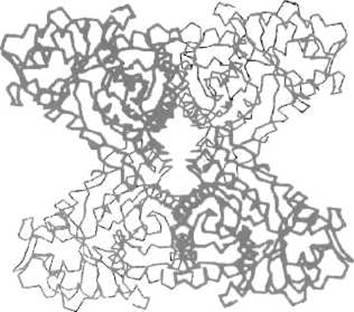
Рис. 7.2. Четвертичная структура альдолази скелетных мышц кролика.
Фермент состоит из четырех одинаковых субъединиц, расположенных в вершинах тетраэдра (две, выделенные жирными линиями, расположены ближе к читателю). Межсубъединичные взаимодействия в этом случае обеспечиваются гидрофобными контактами между боковыми радикалами аминокислот, образующих а-спирали
Типичным примером является лактатдегидрогеназа человека, построенная из четырех субъединиц. Последние могут быть двух типов: М- (от англ. muscle — мышечная) субъединица, преобладающая в гладких мышцах, и Н- (от англ. heart — сердечная) субъединица, преимущественно синтезируемая в сердечной мышце. Для лактатдегидрогеназы возможен следующий набор множественных форм: М4, М3Н1, М2Н2, М1Н3, Н4. Заметим, что множественные формы, различия между которыми обусловлены генетически, а не вызваны посттрансляционными модификациями или повреждением белка, принято называть изоформами. Разница в первичной структуре субъединиц отражается на соотношении катионных и анионных групп, что приводит к различиям в заряде изоформ и позволяет легко разделить их методом электрофореза. Такой анализ изоферментного состава лактатдегидрогеназы крови позволяет следить за поступлением в кровь лактатдегидрогеназы некоторых органов, в частности сердца, при развитии соответствующей патологии, например при некрозе сердечной мышцы. В последнем случае возрастет содержание изоформ, обогащенных Н-субъединицей. Этот подход нашел применение в медицинской диагностике и биохимической генетике.