Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Четвертичная структура белка
Четвертичной структурой называют размещение в пространстве взаимодействующих между собой субъединиц, образованных отдельными полипептидными цепями белка.
В формировании четвертичной структуры участвуют не пептидные цепи сами по себе, а глобулы, образованные каждой из этих цепей в отдельности. Таким образом, понятие четвертичной структуры относится к ансамблю глобул. Взаимодействие между последними достаточно сильно, так что ансамбль выступает как единая молекула, в то же время каждая из объединившихся глобул — субъединиц — сохраняет значительную автономию, как правило, выраженную гораздо ярче, чем автономия домена в рамках третичной структуры.
Известны, однако, случаи, когда два или несколько полипептидов составляют единую глобулу. Как правило, это является следствием ограниченного протеолиза — локального расщепления на отдельные отрезки первоначально целостной полипептидной цепи, образовавшей глобулу по обычным правилам формирования третичной структуры. Такие белки, естественно, не следует относить к числу имеющих четвертичную структуру.
Примером может служить инсулин. Его мономер построен из двух пептидных цепей А и В, содержащих соответственно 21 и 30 аминокислотных остатков. Однако эти цепи образуют единую структуру, получающуюся после «вырезания» соединяющего их пептида С из молекулы проинсулина, поэтому нет оснований считать их субъединицами. Другой пример — конканавалин А (мол. масса 26 кДа). Этот растительный белок относится к лектинам и специфически связывается с углеводными компонентами на поверхности клеток. Очищенный конканавалин представляет собой смесь целых и поврежденных протеолизом молекул, причем в последних пептидная цепь расщеплена на два фрагмента с молекулярными массами 20 и 6 кДа. Понятно, что такие поврежденные молекулы по структурной организации не отличаются принципиально от неповрежденных и нет оснований приписывать им четвертичную структуру, несмотря на наличие двух пептидных цепей.
Следует еще раз подчеркнуть, что речь идет о белках, формирующих единую глобулу. В некоторых белках полипептидная цепь образует при свертывании несколько глобул (доменов), между которыми устанавливается система нековалентных взаимодействий. Последующее протеолитическое разрезание участков цепи, соединяющих домены между собой, делает их вполне автономными, переводит в ранг субъединиц, формирующих четвертичную структуру.
Иногда в литературе используют термин «агрегат» как синоним понятия «четвертичная структура», с чем трудно согласиться, поскольку последнее подразумевает весьма высокий уровень организации — объединение субъединиц в молекулу, стабилизированную системой нековалентных взаимодействий. Точно так же нет оснований классифицировать как четвертичную структуру надмолекулярные (например, мультиферментные) комплексы или протяженные структуры, такие, например, как оболочки фагов (рис. 7.1) или белковые кристаллические тела включения в некоторых бациллах, хотя в механизме их образования немало общего с формированием четвертичной структуры.
Четвертичная структура — последний уровень в организации белковой молекулы, к тому же необязательный: до половины известных белков ее не имеют. Граница между белками, имеющими четвертичную структуру и лишенными ее, не всегда вполне определенна. Некоторые белки сравнительно легко диссоциируют на субъединицы уже в обычных условиях. В то же время известно возникновение более или менее стабильных димеров в растворах некоторых белков, которые не классифицируются как обладающие четвертичной структурой: такова, например, панкреатическая рибонуклеаза. Заметим, что поверхности белков, насыщенные функциональными группами и весьма неровные, склонны к образованию хотя бы слабой системы взаимодействий, на чем основана, в частности, кристаллизация белков. Такне взаимодействия следует, по-видимому, рассматривать как своеобразный зародыш, способный послужить в эволюции белка исходной точкой для развития достаточно совершенной четвертичной структуры.
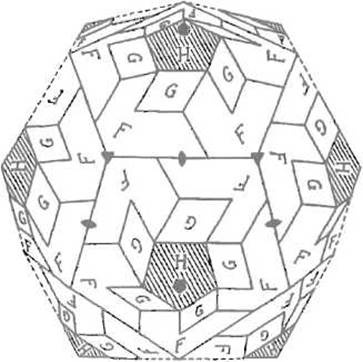
Рис. 7.1. Расположение белков (F, G, Н), образующих оболочку капсида фага — х 174.
Зачерненные пятиугольники соответствуют осям симметрии пятого порядка, треугольники — третьего порядка, «линзы» — второго порядка