Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Аминокислоты
Химические реакции а-аминокислот
Эти реакции разделяют на характерные для а-аминогрупп, а-карбоксильных групп и протекающие с совместным участием обеих функций.
1.2.1. Реакции аминогрупп
В целом эти реакции аналогичны реакциям алифатических аминов. Ацилирование активированными производными кислот в присутствии основания, связывающего выделяющуюся кислоту, протекает достаточно легко. К таким реакциям, например, относят:
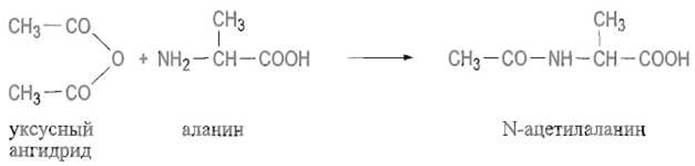
✵ ацилирование аминокислот уксусным ангидридом:
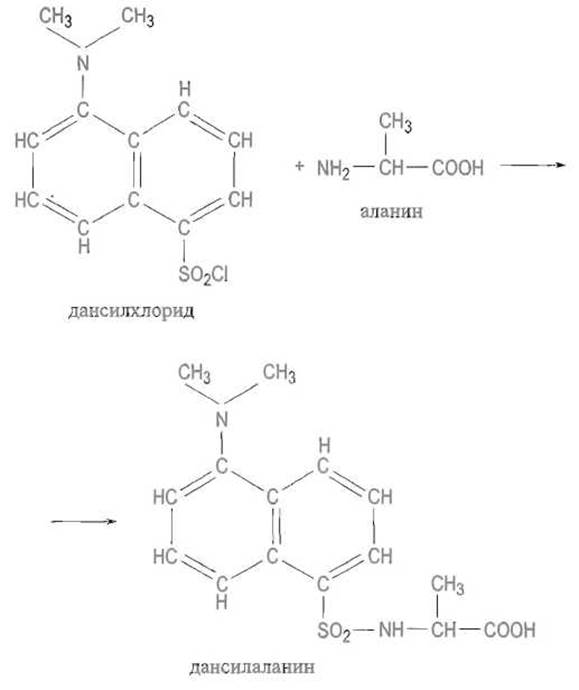
✵ реакцию с хлорангидридом 5-диметиламинонафталинсулъфокислоты (дансилхлоридом) — дансилирование, позволяющую превратить аминокислоту во флуоресцирующее соединение:
Сходно протекает армирование весьма активным 1-фтор-2,4-динитробензолом — реакция динитрофенилирования, сыгравшая большую роль в определении структуры пептидов.

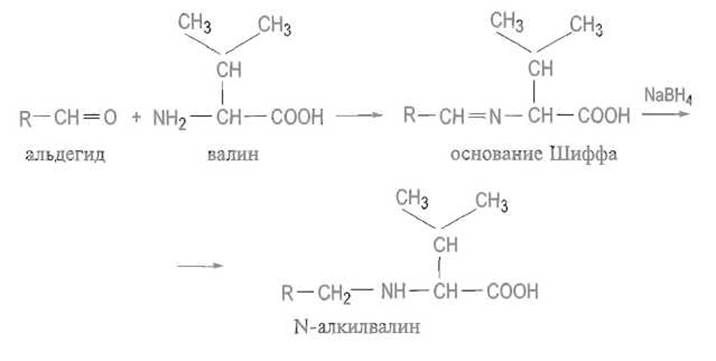
Реакция аминогруппы с альдегидами приводит к образованию непредельного соединения — так называемого основания Шиффа, в котором основность азота существенно понижена. Эта реакция обратима, и в кислой среде альдегид отщепляется с регенерацией аминокислоты. Для основания Шиффа характерна близость двойной связи к асимметрическому центру, что может способствовать рацемизации аминокислоты за счет миграции двойной связи к а-атому углерода. Гидрирование двойной связи в основании Шиффа, например, боргидридом натрия стабилизирует связь С—N:
К аналитически важным реакциям с карбонильными соединениями относят взаимодействие аминокислот с трикетогидринден-гидратом (нингидрином):
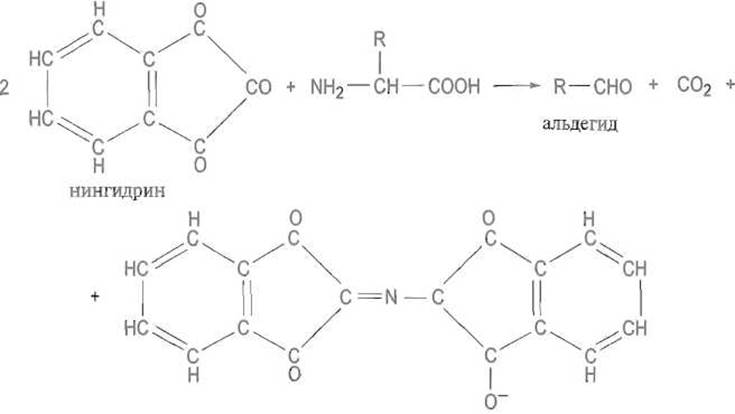
фиолетовый Руеманна (λmax = 570 нм)
На этой реакции основано как качественное, так и количественное определение аминокислот (в том числе в автоматических анализаторах). Флуоресцирующие производные образуются при реакции а-аминокислот с о-фталевым альдегидом в присутствии меркаптоэтанола. Эта реакция позволяет определять очень малые, порядка пикомолей, количества аминокислот:
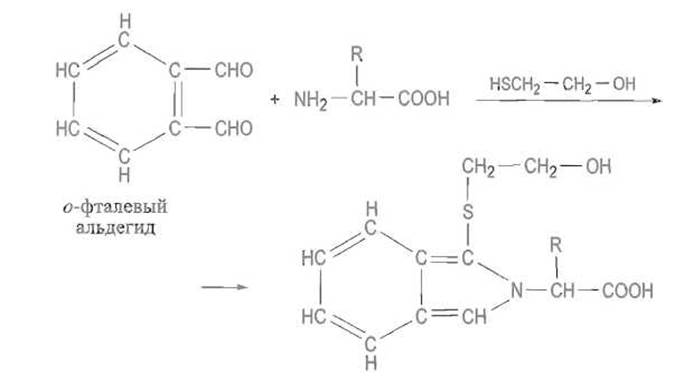
Продукт реакции, производное изоиндола; интенсивно флуоресцирует, λmах = 455 нм (λmах возбуждения равна 360 нм)
1.2.2. Реакции карбоксильных групп
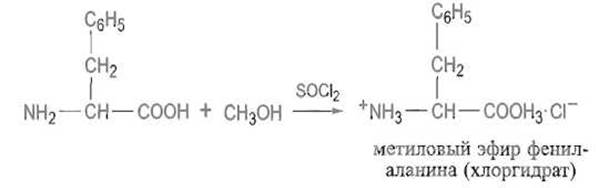
Эти реакции аминокислот в определенной мере соответствуют реакциям алифатических карбоновых кислот. Этерификация протекает в безводных спиртах в присутствии кислотных катализаторов. Так, фенилаланин этерифицируется почти количественно в безводном метаноле в присутствии соляной кислоты или (лучше) тионилхлорида;
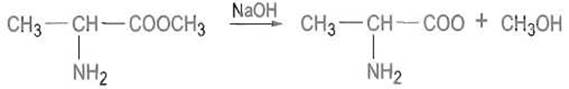
Эфиры аминокислот — важные исходные вещества для пептидного синтеза — могут гидролизоваться, в особенности в щелочной среде (реакция омыления):
Обработка эфиров аминокислот безводным аммиаком превращает их в амиды.

Для временной защиты а-карбоксильных групп, необходимой при пептидном синтезе, их превращают в трет-бутиловые эфиры путем реакции с изобутиленом в присутствии серной кислоты:
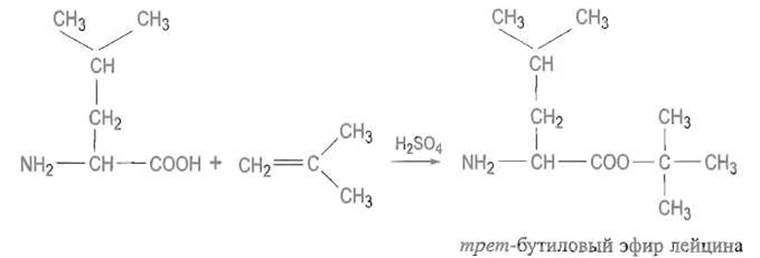
Такие эфиры устойчивы в слабощелочных средах, но избирательно расщепляются кислотами с регенерацией свободной карбоксильной группы.
1.2.3. Реакции с совместным участием а-аминной и а -карбоксильной групп
Соли аминокислот с некоторыми ионами металлов, в частности с ионами двухвалентной меди, никеля, кобальта, образуются при участии как карбоксилат-иона (ионная связь), так и аминогруппы (координационная связь), причем возникают весьма устойчивые бициклические (клешнеобразные, или хелатные) структуры, в которых ион металла координирован с двумя молекулами аминокислоты, например
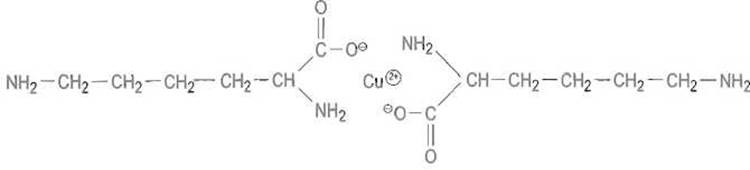
Медная соль лизина, в образовании которой участвуют карбоксильная и аминная группа при а-углеродном атоме. s-Аминогруппа в комплекс не входит и остается свободной, что может быть использовано для проведения реакций, специфически затрагивающих только удаленную аминогруппу.
Такие комплексы интенсивно окрашены, например комплексы меди с аминокислотами — в фиолетово-голубой цвет.
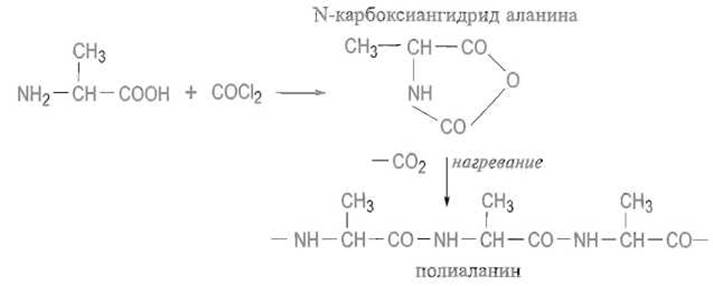
Известны реакции, переводящие аминокислоты с участием как аминной, так и карбоксильной групп в циклические структуры. Так, фосген превращает а-аминокислоты в так называемые N-карбоксиангидриды, легко полимеризующиеся с отщеплением СO2 и образованием полиаминокислот:
Очень важна реакция аминокислот с фенилизотиоцианатом, которая сначала приводит к производному по а-аминогруппе — фенилтиокарбамил-аминокислоте:
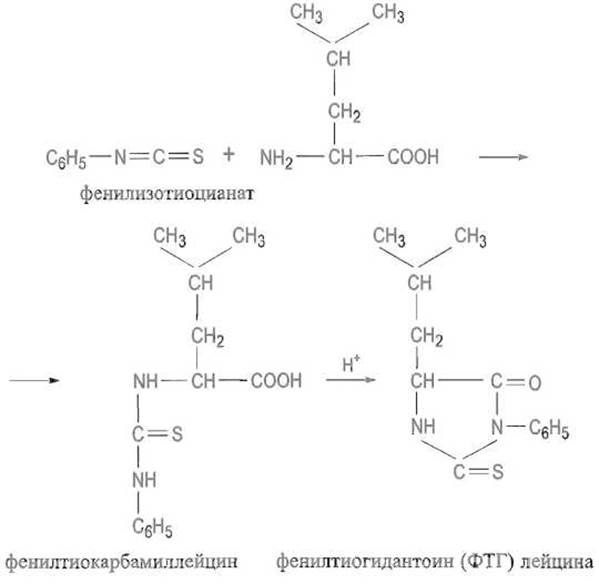
Фенилтиокарбамил-аминокислоты и некоторые их аналоги интенсивно поглощают в ультрафиолетовом свете, что используют при количественном определении аминокислот методом высокоэффективной жидкостной хроматографии. Обработка кислотами приводит к внутримолекулярной циклизации фенилтиокарбамил-аминокислоты с образованием фенилтиогидантоина.
Эти производные аминокислот играют важную роль в анализе первичной структуры белка.