Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Аминокислоты
Кислотно-основные свойства аминокислот
Кислотно-основные свойства аминокислот определяются одновременным присутствием в их структуре аминной и карбоксильной групп, которые, будучи предельно сближены, глубоко влияют друг на друга.
В нейтральной среде, в довольно широком диапазоне pH, а-аминокислоты существуют как биполярные ионы, поэтому обычная запись формулы аминокислот, например глицина — NH2—СН2—СООН, условна. Правильнее было бы писать для нейтральных растворов NH+3—СН3—СОO. Именно в такой форме биполярных ионов — цвиттер-ионов (устаревшее название — «бетаиноподобная структура») — аминокислоты существуют в нейтральных растворах и кристаллах. Влияние положительно заряженной аммонийной группы в a-положении делает а-карбоксильную группу значительно более сильной по сравнению с карбоксилом алифатических кислот. Так, если рКа уксусной кислоты (pH — при котором диссоциация проходит наполовину) составляет 4,7, то у глицина рКа карбоксила равен 2,34. Примерно такие же величины рКа свойственны карбоксильным группам других а-аминокислот (табл. 1.1).
Разумеется, карбоксильные группы, удаленные от а-аммонийной, например ß-карбоксил аспарагиновой или у-карбоксил глутаминовой кислот, не испытывают столь значительного влияния положительного заряда и по своим кислотным свойствам, по способности отдавать и принимать протон приближаются к обычным жирным кислотам.
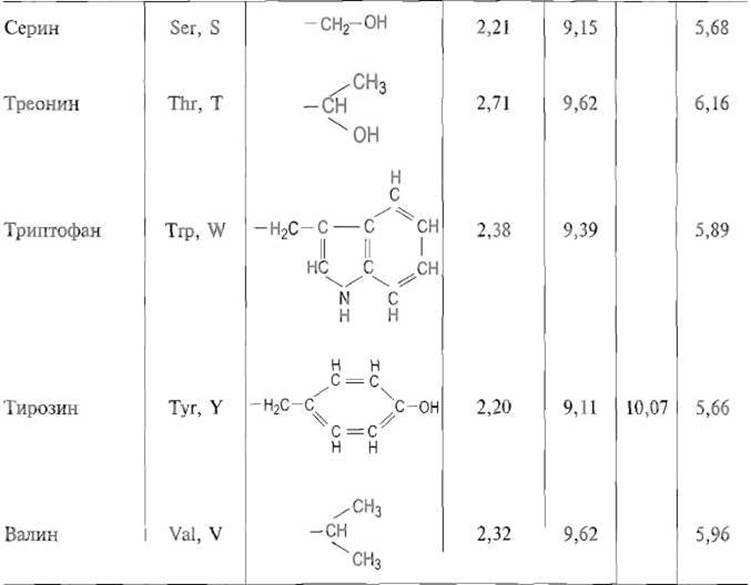
Таблица 1.1 Аминокислоты, включающиеся в белки при трансляции (белковые аминокислоты)

* Структура пролина приведена полностью.
Точно так же а-аминогруппа в а-аминокислотах испытывает влияние карбоксилат-аниона, присоединенного к тому же углеродному атому, и становится значительно менее основной, чем аминогруппа первичных алифатических аминов: ее рКа равен 9,6-9,7 в отличие от 10,7 для этиламина. Влияние карбоксильной группы на свойства аминогруппы, в частности на ее основность, падает по мере возрастания расстояния между ними, поэтому с-аминогруппа лизина практически не отличима по химическим характеристикам от алифатических аминов, ее рКа равен 10,5.
Если к нейтральному раствору а-аминокислоты, содержащему биполярные ионы, прибавлять кислоту, увеличивая концентрацию ионов водорода, последние будут присоединяться к карбоксилатным группам, превращая их в незаряженные карбоксильные группы. При этом аминокислота, в которой заряды первоначально были скомпенсированы, приобретет суммарный положительный заряд, в частности, в электрическом поле она будет перемещаться к катоду. Напротив, если понижать концентрацию ионов водорода, добавляя щелочь, гидроксильные ионы будут реагировать с а-аммонийными группами, отщепляя протон и переводя их в незаряженные аминогруппы. В результате аминокислота приобретет суммарный отрицательный заряд и в электрическом поле будет перемещаться к аноду:

Значение pH, при котором как аминная, так и карбоксильная группы аминокислоты полностью заряжены и заряды скомпенсированы, называют изоэлектрической точкой (pi). Для a-аминокислот, которые не имеют ионогенных групп в боковой цепи, величина pI равна полусумме рКа a-аминной и а-карбоксильной групп. Если аминокислота содержит дополнительные ионогенные группы, при расчете pI следует учитывать их вклад.
Например, pI аспарагиновой кислоты не может быть близкой к 6, как у моноаминомонокарбоновых кислот, так как при этом pH будет практически полностью диссоциирована ее ß-карбоксильная группа и аспарагиновая кислота, следовательно, будет нести суммарный единичный отрицательный заряд. Для его подавления необходимо значительно понизить pH — до 2,77, чтобы протонировать ß-карбоксил примерно на 90%, что оставит на этой группе около 0,1 отрицательного заряда. При столь низком pH начнется и протонирование а-карбоксильной группы, которая сохранит около 0,9 отрицательного заряда. В сумме эти заряды скомпенсируют единичный положительный заряд аминогруппы, что и обеспечит изоэлектрическое состояние аспарагиновой кислоты. Легко видеть, что pI в этом случае близка к среднему арифметическому из рКа а- и ß-карбоксидьных групп. То же справедливо и для расчета pI глутаминовой кислоты, равной 3,24. Аналогично, рассчитывая изоэлектрическую точку лизина (pI = 9,82), используют среднее из рКа а- и ε-аминогрупп.