Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Химическое ;модифицирование белков
Области применения метода химического модифицирования
Необходимо еще раз подчеркнуть, что приведенные выше данные о реакциях функциональных групп белка ориентировочны. За исключением, возможно, образования меркаптидов, эти реакции не могут рассматриваться как строго специфичные. Ввиду этого истолкование результатов химического модифицирования предоставляет большие возможности. Как правило, необходимо разделение продуктов модификации, за которым должна следовать локализация модифицированных аминокислотных остатков путем фрагментации белка и выделения пептидов, содержащих остаток реагента. Экстраполяция результатов, полученных при действии тех или иных реагентов на функциональные группы в модельных структурах — аминокислотах, пептидах и даже белках, весьма опасна, особенно если речь идет о компонентах активных центров, поскольку химические свойства таких групп могут быть сильно видоизменены вследствие их участия в системе нековалентных взаимодействий.
9.3.1. Химическое модифицирование как способ выявления роли функциональных групп белка
Как отмечалось, в исследовании структуры и функциональных свойств белка данный метод в значительной мере вытесняется сайт-специфическим мутагенезом (белковой инженерией). Тем не менее при изучении механизма действия многих белков начальные сведения о функционально значимых аминокислотных остатках были получены именно методом химического модифицирования. Так, участие карбоксильных групп двух остатков аспарагиновой кислоты в аспартильных протеиназах было впервые продемонстрировано при помощи специфических реакций с производными диазоацетамида и диазокетонами, при изучении сериновых протеиназ огромную роль сыграло выявление особой роли остатка серина, специфически реагирующего с диизопропилфтор-фосфатом и т.д. Эти результаты в дальнейшем подтвердились рентгеноструктурными исследованиями и сайт-специфическим мутагенезом. Нет сомнения, что метод химической модификации будет и в дальнейшем играть ответственную роль, в особенности при поиске функционально важных структур в новых семействах белков.
Это обусловлено тем, что функционально активные центры, как правило, содержат ансамбли групп, функциональные группы в необычном окружении, что изменяет, делает нестандартными их химические свойства. Именно поэтому поиск аминокислотных остатков, обладающих аномальной реакционной способностью, составляет важный этап исследования белка.
В то же время следует учитывать еще одну трудность, внутренне присущую трактовке результатов, полученных любым методом модифицирования. Получив данные о том, что присоединение к некоей группе белка заместителя R вызывает характерное изменение его функциональных свойств, например утрату активности, нелегко определить, произошло ли это вследствие блокирования данной функциональной группы или же в результате введения остатка R в данную точку белка, где его присутствие недопустимо (например, из-за вызываемых этим заместителем стерических осложнений). Расчет на то, что применение реагентов с очень небольшими радикалами R снимет проблему, вряд ли оправдан, так как помехи вовсе не обязательно связаны с размерами. Это делает результаты химического модифицирования не всегда однозначными. Заметим, что и метод сайт-специфического мутагенеза сопряжен с такой же неопределенностью. Впрочем, это осложнение может быть снято, если удается использовать не один, а серию реагентов с принципиально различными R.
9.3.2. Аффинные реагенты
Как бы ни был построен реагент, используемый при химической модификации, его взаимодействие с той или иной функциональной группой всегда начинается с того, что он связывается в ее окрестности. Таким образом, специфичность, избирательность реакции определяется не только химическими особенностями, внутренне присущими данной функциональной группе в белковой структуре, но и наличием вблизи нее благоприятных (или, наоборот, неблагоприятных) условий для связывания модифицирующего реагента. Для изучения функциональных групп в активном центре белка выгодно использовать такие соединения, в которых собственно химически активная группа присоединена к структуре, «узнающей» активный центр, точнее, ту его часть, которая ответственна за связывание специфического лиганда (например, субстрата или эффектора). Такие адресованные реагенты с большой вероятностью сорбируются в активном центре и затем образуют ковалентную связь с теми или иными функциональными группами, локализованными в нем. Протеканию реакции благоприятствует сближение химически активной группы реагента и модифицируемого аминокислотного остатка, поэтому собственная реакционная способность первой может и не быть высокой.
В качестве примера можно указать на целый ряд пептидил-бромметилкетонов, построенных следующим образом:

Пептидная (адресующая) часть такой молекулы специфически присоединяется к протеиназе за счет образования системы водородных связей между пептидными группировками аналога субстрата и фермента, а также взаимодействия боковых радикалов R1, R2 и R3 с зоной связывания, В результате реакционноспособная группировка СОСН2Вr оказывается пространственно сближенной с активным центром. В сериновых протеиназах она избирательно реагирует с имидазольной группой гистидина, принадлежащего активному центру:

9.3.3. Химическое модифицирование в изучении межмолекулярных комплексов и синтезе конъюгатов белков
Важной областью применения химической модификации является соединение, «сшивка» белковой молекулы с другими молекулами, сближенными с ней в биологических структурах. Это открывает возможность изучения геометрии подчас весьма сложных межмолекулярных комплексов. Так, бифункциональный реагент диметил-3,3'-дитиобиспропиоимидат
![]()
способен модифицировать, подобно монофункциональному имидоэфиру, ε-аминогруппы лизина, отстоящие друг от друга примерно на 12 А. Это позволяет «сшивать» соседние белит в субъединице рибосом, F-актин и фрагмент миозина, белки в мембранах эритроцитов и т.д. Существенно, что «сшивка» содержит в этом случае дисульфидную связь, которая может быть в дальнейшем расщеплена мягким восстановлением. Это приводит к разделению белков, образовавших конъюгат, и облегчает их идентификацию. Образуемые при помощи таких же или аналогичных реагентов внутримолекулярные сшивки иногда используют для оценки расстояний между функциональными группами на поверхности белковой глобулы.
Разумеется, бифункциональные сшивающие реагенты могут содержать и неодинаковые реакционноспособные группы. Это особенно удобно при получении конъюгатов, объединяющих белки с разными функциональными свойствами, например иммуноглобулины и ферменты (обычно пероксидазу или фосфатазу), что необходимо для иммуноферментного анализа Одним из таких реагентов является N-оксисукцинильный эфир м-малеимидобензойной кислоты:
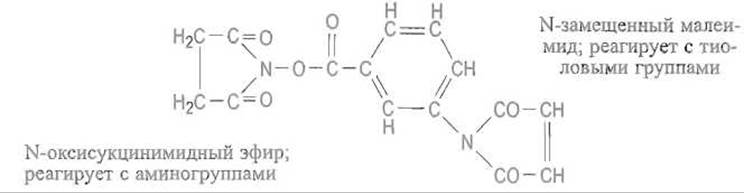
Его малеимидная группа способна присоединять сульфгидрильные группы цистеина, а N-оксисукцинильный эфир ацилирует ε-аминогруппы остатков лизина. Поскольку эти реакции протекают в различных условиях, можно избежать образования случайных пар белков.
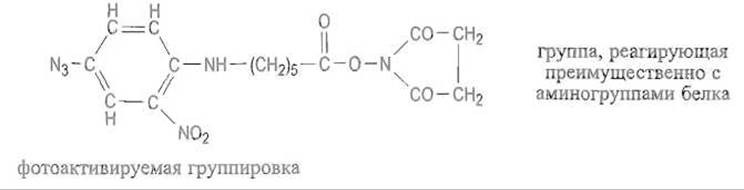
Получили распространение модифицирующие реагенты, содержащие фотоактивируемую фенилазидную группировку. При освещении замещенных фенилазидов УФ-светом с длиной волны 265—275 нм эти, в обычных условиях вполне устойчивые, вещества распадаются с образованием промежуточных аренов — соединений с высокой реакционной способностью. Последние, будучи пространственно сближенными, могут реагировать с различными функциональными группами белка, включая и такие, которые принято считать инертными. В принципе возможна даже реакция нитрена с С—Н-группами, однако чаще затрагиваются функциональные группы Н—X:
![]()
Встраивание фенилазидных группировок в структуру реагента, имеющего еще одну химически активную группу, позволяет сначала модифицировать белок за счет последней. После этого фотоактивация создает в уже модифицированном белке новый высокоактивный центр (арен), способный образовывать ковалентные связи как с соседними молекулами белка (полисахаридами, липидами и т.д.), так и с пространственно близкими группировками внутри той же молекулы. Например, показанный ниже бифункциональный реагент дает возможность присоединить фотоактивируемую группу к аминогруппам белка:
9.3.4. Другие области применения химического модифицирования белков
Реакции химического модифицирования позволяют образовывать ковалентные связи между белками и нерастворимой матрицей, например полисахаридами (агароза и ее производные, в том числе «сефарозы», целлюлоза), органическими полимерами (полиакриламид, поливиниловый спирт «тойоперл»), неорганическими материалами (макропористое стекло и силикагель). Для этой цели используют целый ряд реагентов. Так, при иммобилизации на полисахаридах применяют предварительную активацию матрицы бромцианом, после чего получившийся эфир циановой кислоты образует амидин с ε-аминогруппойбелка. Эту реакцию используют и как способ присоединения лигандов к матрице при синтезе аффинных сорбентов (см. гл. 3).
Часто иммобилизацию белков проводят, используя диальдегид (обычно глутаровый) для сшивания свободной ε-аминогруппы белка с аминогруппой носителя:
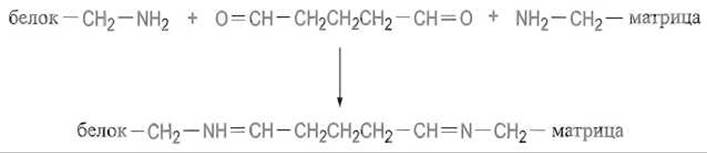
Для большей стабильности иммобилизации малоустойчивые связи —CH=N— гидрируют боргидридом натрия NaBHp переводя их в очень прочные связи — CH—NH—.
Модификация позволяет изменить растворимость белка. Например, присоединение к химотрипсину нескольких гидрофобных полимерных цепочек —СН2СН2О—СН2СН2О—СН2СН2—О— делает этот фермент растворимым в органических растворителях, что открывает возможность его использования как катализатора в органическом синтезе.