Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Ферменты
Триозофосфатизомераза
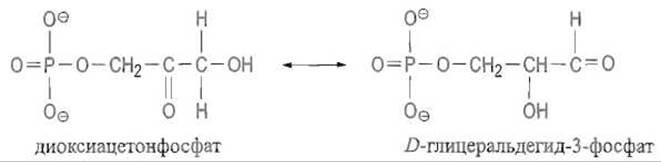
Триозофосфатизомераза — фермент, относящийся к классу изомерат, катализирует взаимопревращения диоксиацетонфосфата D -глицеральдегид-3-фосфата:
Фермент относится к числу наиболее эффективных: скорость превращения субстрата определяется скоростью его диффузии. Хорошо изучено строение триозофосфатизомеразы трипаносом, которой структурно близок фермент животных. Триозофосфатизомераза — димер, образованный идентичными субъединицами.
Каждая из них представляет собой полипептидную цепь из 250 аминокислотных остатков, третичная структура которой относится к a/ß-типу и содержит правильно чередующиеся восемь а-спиралей и восемь отрезков β-структуры. ß-Структурные участки образуют внутренний цилиндр, защищенный от воды а-спиралями (рис. 10.12). В формировании каждого из двух активных центров участвуют обе субъединицы, поэтому мономер не активен. В то же время между активными центрами нет кооперативности, иными словами, функционирование любого из них не зависит от того, действует ли другой центр, хотя присутствие второй субъединицы обязательно.
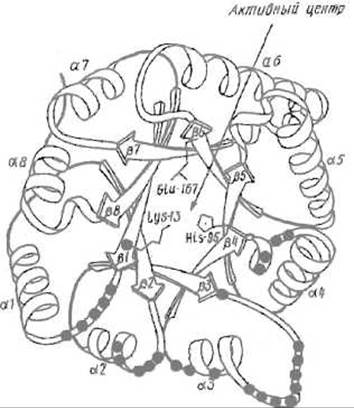
Рис. 10.12. Размещение каталитического центра в пространственной структуре триозофосфатизомеразы. Функциональные группы каталитического центра размещены во впадине, которая закрывается при связывании субстрата за счет перемещения петли, расположенной между отрезком ß3 и спиралью а3
В связывании субстрата важнейшая роль принадлежит фосфатной группе, которая образует с ферментом семь водородных связей, дополняемых ионным взаимюдействием с аммонийной группой Lys-13, Образование фермент-субстратного комплекса вызывает довольно значительное — на 3-5 Å — перемещение подвижной петли, содержащей остатки 167-178. Главным результатом этого изменения конформации фермента является исключение воды из активного центра, что благоприятствует протеканию изомеризации.
В связанном субстрате (в качестве которого далее рассматривается диоксиацетонфосфат) один из атомов водорода метиленовой группы оказывается в поле отрицательно заряженного карбоксилат-иона остатка Glu-167. Этот водород отщепляется от субстрата как протон и переходит к карбоксилу Glu-167. Освободившаяся электронная пара, которая обслуживала связь С—Н, мигрирует к соседней связи С—С, делая ее двойной. Это влечет за собой поляризацию двойной связи С=0 с появлением на ее атоме кислорода отрицательного заряда, стабилизируемого электростатическим взаимодействием с катионной аммонийной группой остатка Lys-13:
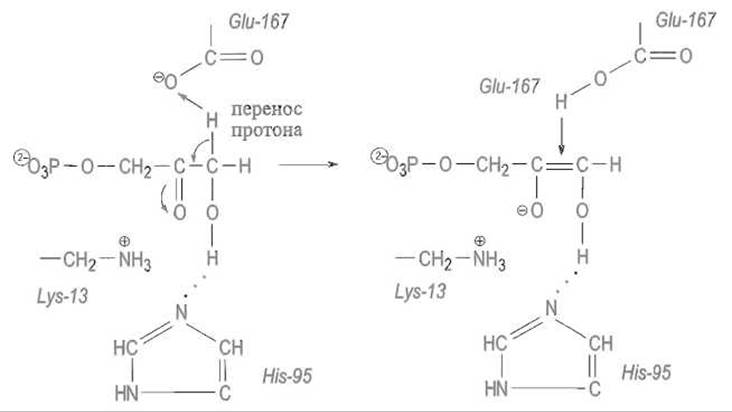
Вся эта цепь превращений переводит субстрат в анионную форму неустойчивого ендиола:

Далее протон переходит от карбоксильной группы Glu-167 ко второму углеродному атому субстрата, присоединяясь к двойной связи С = С.
Одновременно между С-1 и атомом кислорода устанавливается двойная связь за счет отщепления протона от гидроксильной группы при С-1 и его миграции сначала к азоту имидазольной группы His-95, а затем к отрицательно заряженному кислороду при С-2 субстрата. Путь этой миграции предопределен, как и в механизме действия сериновых протеиназ, присутствием в активном центре имидазольной группы гистидина:

Замена глутаминовой кислоты в положении 167 на аспарагиновую, проведенная методом белковой инженерии, отодвигает критически важную для катализа карбоксильную группу от субстрата примерно на 1 Å, в результате чего скорость реакции снижается почти в 103 раз. То, что модифицированный таким образом фермент все же сохраняет активность, можно объяснить колебаниями в структуре фермент-субстратного комплекса, которые могут, хотя и с малой вероятностью, сближать карбоксильную труппу аспарагиновой кислоты с углеродными атомами субстрата.
Таким образом, и в механизме действия триозофосфатизомеразы проявляются характерные черты ферментативного катализа - перенос реакции из водной фазы внутрь фермента, что обусловлено перемещением одного из участков структуры в ответ на связывание субстрата; координированное действие ансамбля функциональных групп, включенных вместе с прочно связанным субстратом в единую интегрированную систему.