Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Ферменты
Каталитические антитела («абзимы»)
Проверкой правильности понимания принципов ферментативного катализа, в особенности представлений о важнейшей роли, которая в этом процессе принадлежит стабилизации переходного комплекса путем его избирательного связывания в каталитическом центре, явилось создание искусственных ферментов, так называемых абзимов. Абзимы (от англ. AntiBody + enZYME) представляют собой антитела, специфически связывающие структуры, которые химически близки переходному состоянию, образующемуся в процессе катализа. Метод создания абзимов основан на том, что среди огромного множества возможных структур иммуноглобулинов (см. гл. 13) всегда могут быть найдены такие, которые содержат соответствующим образом ориентированные группы и способны избирательно связывать стабильные химические соединения, структурно близкие переходному состоянию той или иной реакции.
При образовании комплекса с таким иммуноглобулином возникнут благоприятные условия для того, чтобы строение субстрата приблизилось к структуре переходного состояния. Иными словами, будет понижена энергия активации субстрата, т.е. энергия, которую необходимо затратить на его перевод из основного состояния в переходное. Соответственно должны возрасти вероятность его превращения в продукт, а значит, и скорость реакции. Разумеется, пока речь идет не о создании катализаторов, эквивалентных по эффективности ферментам, а о получении их упрощенных моделей, хотя некоторые из них, возможно, и окажутся практически пригодными.
Первый подход к созданию абзимов состоял в получении антител, специфически связывающих и стабилизирующих аналоги переходных состояний, свойственных гидролитическим реакциям. Очевидно, что антитело к соединению (гаптену), напоминающему конфигурацию переходного состояния, будет стабилизировать эту структуру и тем самым понижать свободную энергию активации. Хорошо известно (см. разд. 10.5), что гидролиз амидов и сложных эфиров (например, щелочью) проходит через стадию образования тетраэдрического промежуточного продукта:
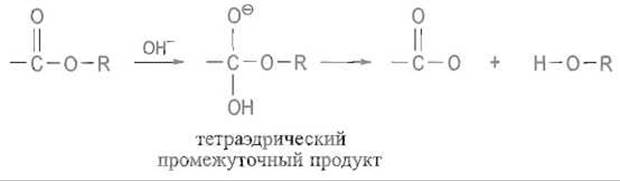
Анализ механизма действия: гидролитических ферментов, в частности сериновых протеиназ (см. разд. 10.5), показывает, что его существенной чертой действительно является стабилизация переходного состояния, структурно близкого такому тетраэдрическому промежуточному продукту. Соответствующее соединение, которое имитировало бы такую структуру и содержало бы у одного углеродного атома три атома кислорода (или два атома кислорода и один азота при моделировании протеиназ), синтезировать не удается — оно слишком неустойчиво. Однако возможно получение достаточно стабильных тетраэдрических структур, стереохимически близких ему, в которых центральное положение вместо атома углерода занимает атом фосфора. Присоединение такого рода соединений к белку-носителю в качестве гаптенов и иммунизация этими производными животных позволяет получить антитела, специфически связывающие молекулы, близкие по структуре и конформации к переходному состоянию, через которое происходит гидролиз сложных эфиров или амидов карбоновых кислот.
Так, при создании абзимов, рассчитанных на ускорение гидролиза сложного эфира угольной кислоты — n - нитрофенил - N, N, N - триметиламмонийэтилкарбоната

— были получены иммуноглобулины, специфически взаимодействующие с тетраэдрическими заряженными фосфонатными и фосфатными аналогами переходного состояния реакций гидролиза этого соединения, которое выглядит следующим образом:
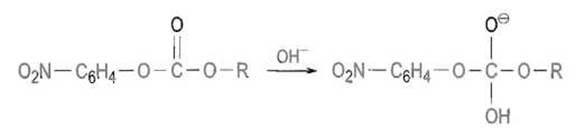
Здесь
![]()
Его модель — фосфонатный аналог —
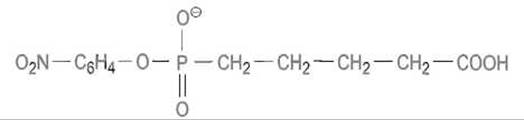
имеет структуру, стереохимически близкую, хотя и отличающуюся рядом деталей, в частности непосредственным присоединением углерода боковой цепи к центральному атому фосфора, длиной этой цепи, плотностью отрицательных зарядов на атомах кислорода и т.п. Фосфонатный аналог был присоединен через карбоксильную группу к белку-носителю. К этой конструкции получены моноклональные антитела, которые, как оказалось, катализировали гидролиз субстрата — эфира угольной кислоты:

Кинетика этой, как и обычных ферментативных реакций, подчиняется уравнению Михаэлиса-Ментен. Гидролиз ингибируется соединениями — аналогами переходного состояния, причем Кі оказывались значительно ниже субстратной Кm. Следовательно, в соответствии с ожиданием антитело связывает аналог переходного состояния (это отражает Кi) прочнее, чем субстрат (что характеризует Кm). Это подтверждает важность стабилизации переходного
состояния для катализа. Скорость реакции зависит от первой степени концентрации гидроксильного иона и превышает некаталитическую в 103-104 раз. Разумеется, ферментативная реакция дала бы на несколько порядков большее ускорение, однако необходимо учитывать, что при конструировании абзима моделировалась только одна, хотя и весьма важная, черта энзиматического кататиза — стабилизация переходного состояния. К тому же, как указывалось, связывание фосфонатного аналога лишь приближенно, а не совершенно точно воспроизводит систему стабилизирующих взаимодействий. Существен принципиальный результат — создание фермента, пусть пока недостаточно эффективного, на основе имеющихся представлений об основных чертах каталитического процесса.
Для реакции характерна субстратная специфичность: антитело против аналога катализирует гидролиз только указанного выше соединения, но не родственного ему метил-n-нитрофеннткарбоната
![]()
Рентгеноструктурный анализ антитела, связывающего фосфорилхолин и, вероятно, имеющего что-то общее с рассматриваемым каталитическим антителом, показывает, что гуанидогруппа остатка Arg-52 и гидроксил Туr-33 тяжелой цепи могут взаимодействовать с кислородом фосфатной группы. По-видимому, и в каталитическом антителе аналогичным образом стабилизируется переходное состояние и эти же аминокислотные остатки связываются с атомами кислорода в его структуре. В то же время остаток Glu-35, также находящийся в тяжелой цепи, образует ионную связь с аммонийной группой субстрата, чем, в частности, обеспечивается специфичность абзима.
Иной путь моделирования принципов энзиматического катализа состоит в использовании антител для надлвжающего сближения реагирующих компонентов или участков претерпевающей превращение молекулы в активном центре. Так, антитело, специфически связывающее бициклический ингибитор хоризматмутазы, избирательно ускоряет превращение хоризмовой кислоты в префеновую в 104 раз (kкат = 2,7 мин-1, Кm = 260 мкМ).
Антитело к фосфатному аналогу 5-лактона, формула которого приведена ниже, ускоряет в 167 раз циклизацию фенилового эфира соответствующей δ-оксикислоты в лактон:
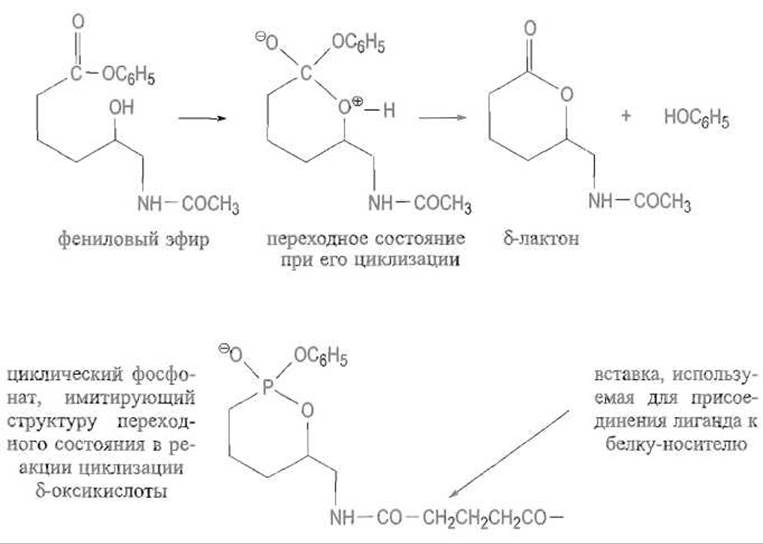
Интересные возможности открывает и введение в каталитические антитела дополнительных функциональных групп. Таким образом, получение абзимов не только подтверждает правильность современных представлений о природе ферментативного катализа, но и открывает принципиальную возможность создания биологических катализаторов нового типа, в том числе и для реакций, не существующих в природе.