Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Посттрансляционная модификация белка
Гликозилирование белков. Гликопротеины
Гликопротеинами называют белки, содержащие ковалентно связанный углеводный компонент. Основываясь на структурной роли углеводного компонента, гликопротеины можно разделить на два класса. К одному из них принадлежат так называемые протеогликаны, их пептидная цепь настолько плотно унизана олигосахаридными цепочками, что молекула в целом выступает подобно разветвленному полисахариду, ее полипептидный скелет постоянно скрыт. Протеогликаны играют немалую роль в формировании межклеточного матрикса в тканях животных. Ко второму классу относятся такие гликопротеины, в которых полипептидная цепь формирует пространственную структуру по обычным правилам, свойственным белкам, а углеводные компоненты присоединены к белковой глобуле. Далее речь будет идти именно о таких гликопротеинах.
Известны два основных способа ковалентного присоединения олигосахаридных цепочек к белкам.
11.4.1. N-Гликопротеины
В этих гликопротеинах углеводный компонент присоединяется N-гликозидной связью (отсюда и название) к амидному азоту остатка аспарагина, включенного в пептидную цепь. Первым моносахаридным звеном, образующим N-гликозидную связь с аспарагином в гликопротеинах этой группы, всегда оказывается N-ацетилглюкозамин, так что «узел» присоединения имеет следующую структуру:
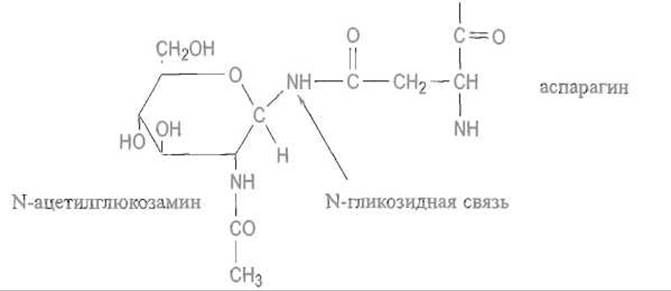
N-Гликозидная связь легко расщепляется в кислой среде, поэтому N-гликопротеины кислотолабильны. В гликопротеинах этого типа к остатку аспарагина присоединен олигосахарид, в котором к «узловому» остатку N-ацетилглюкозамина присоединен 1-4-связью еще один остаток N-ацетилглюкозамина, далее следуют несколько остатков маннозы, могут встречаться остатки N-ацетилглюкозамина, галактозы, нейраминовой кислоты, фукозы и некоторые другие моносахаридные звенья.
Биосинтез N-гликопротеинов происходит в шероховатом ретикулуме, причем на амидную группу аспарагина переносится под действием специализированного фермента за один шаг олигосахарид весьма сложной структуры Glc3Man9GlcNAc2, где Glc — остаток глюкозы, Man — маннозы; GlcNAc — N-ацетилглюкозамина. Далее он подвергается более или менее сложному процессингу — отщеплению концевых моносахаридных звеньев, в частности полному отщеплению остатков глюкозы при помощи специфических глюкозидаз, частичному — маннозы маннозидазами. В результате этого остается так называемое «ядро», к которому присоединяются другие моносахариды:
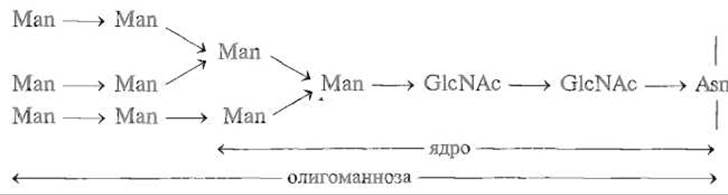
За этим следует последовательное включение отдельных моносахаридных звеньев, в результате чего к «маннозному ядру» присоединяются трисахаридные структуры NeuNAc → Gal → GlcNAc →, где NeuNAc — ацетилнейраминовая кислота, Gal — галактоза, иногда и другие моносахариды, например фукоза — Fuc. Эти реакции специфичны, поэтому образующаяся в результате завершенная структура олигосахарида различна у разных белков. Ниже показана типичная разветвленная структура углеводных компонентов некоторых N-гликопротеинов:
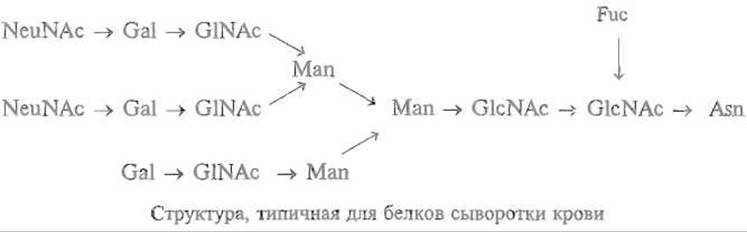

N-Гликозилированию подвергаются лишь немногие из остатков аспарагина, имеющихся в белках. Например, в панкреатической рибонуклеазе из 34 остатков аспарагина гликозилируется только один, находящийся в последовательности Asn-Leu-Thx, что приводит к образованию так называемой рибонуклеазы В. Реакция протекает, как это нередко случается при посттрансляционной модификации, неполно, и значительная часть молекул фермента остается негликозилированной (рибонуклеаза А).
Исследование множества N-гликопротеинов показало, что присутствие оксиаминокислоты — треонина или серина через один остаток от аспарагина — служит сигналом для специфического фермента — олигосахаридтрансферазы, гликозилирующей аспарагин в последовательности Asn-Xaa-Ser(Thr), где Хаа — любая аминокислота. Это позволяет предсказать возможные точки N-гликозилирования по первичной структуре белка. Фермент, катализирующий N-гликозилирование, — олигосахаридтрансфeраза — «узнает» амидную группу аспарагина, отделенного одним аминокислотным остатком от серина или треонина, если полипептидная цепь развернута. По-видимому, свертывание соответствующего участка в пространственную структуру препятствует гликозилированию. Этим объясняется отсутствие гликозилирования одного из двух остатков аспарагина в овальбумине in vivo, хотя in vitro удается присоединить олигосахариды к обоим остаткам, входящим в указанную выше характерную для N-гликозилирования последовательность.
Антибиотик туникамицин блокирует N-гликозилирование белков. Фермент гликопептидаза F избирательно отщепляет олигосахариды от N-гликопротеинов.
N-Гликозилирование характерно для секреторных белков, попадающих в эндоплазматический ретикулум, хотя оно не является непременной предпосылкой секреции.
11.4.2. О-Гликопротеины
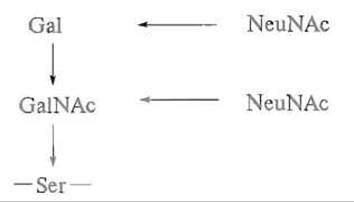
В гликопротеинах этого типа углеводный компонент присоединяется О-гликозидной, связью к оксигруппе остатка серина или треонина, причем «узловое» положение всегда занимает остаток N ацетилгалактозамина:

В отличие от N-гликозилирования биосинтез О-гликопротеинов происходит ступенчато. Вслед за присоединением «узлового» N-ацетилгалактозамина последовательно действующие гликозилтрансферазы присоединяют другие моносахаридные звенья, образуя, например, следующую структуру:
Однозначного «сигнала» в первичной структуре О-гликопротеинов, который определял бы подлежащий модификации остаток серина или треонина, не обнаружено. Имеются, однако, указания на то, что гликозилируется гидроксильная группа остатка серина или треонина, который следует за остатком пролина и входит в ß-изгиб. Это указывает на то, что гликозилирование происходит уже после формирования пространственной структуры белка.
О-Гликозидная связь расщепляется в щелочной среде, причем углеводный компонент отделяется от белкового вместе с водородом, принадлежащим а-углеродному атому серина, оставляя в полипептидной цепи дегидроаланин:
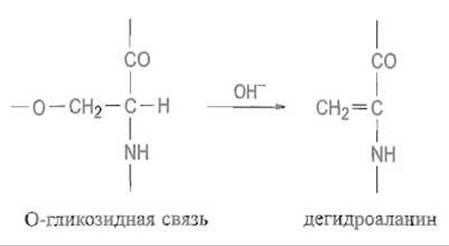
О-Гликозилирование встречается не столь часто в глобулярных белках, оно более свойственно муцинам (веществам, определяющим группу крови) — гликопротеинам, относящимся к классу протеогликанов. Однако в иммуноглобулинах, например, одновременно встречаются оба типа гликозилирования.
Весьма сложен вопрос о функциональной роли углеводных компонентов в гликопротеинах. В некоторых, правда немногих, случаях удалось определить пространственную структуру гликопротеинов. Оказалось, что олигосахаридные цепочки не образуют сколько-нибудь протяженных контактов с белковой глобулой, за исключением немногих водородных связей вблизи точки присоединения к белку, а направлены в сторону от глобулы и погружены в окружающую гликопротеин воду. Лишь для одного из иммуноглобулинов G оказалось, что углеводный компонент, содержащий шесть моносахаридных звеньев, как бы лежит на поверхности раздела двух доменов СH2 и играет, по-видимому, роль своеобразной гидрофильной прокладки площадью около 500 Å2, не позволяя слипнуться гидрофобным поверхностям этих доменов (рис. 11.1). В других изученных случаях трудно говорить о структурообразующей роли углеводных компонентов.
Углеводный компонент практически никогда не участвует в главной функции белка, т.е. не входит в состав каталитического центра или зоны связывания ферментов, активные участки регуляторных белков и т.п. Активность, измеренная для пар гликозилированных и негликозилированных ферментов, неизменно оказывается одинаковой. Сказанное не относится, впрочем, к случаям, когда функция белка состоит в передаче сигнала — в таких белках, например в некоторых гормонах, углеводный компонент нередко критически важен для активности.
Как уже говорилось, гликозилирование сопровождает секрецию белков у животных, однако секреция может происходить и без гликозилирования; следовательно, включение углеводных компонентов есть результат, а не предпосылка секреции. Это хорошо иллюстрируют данные о доле гликопротеинов среди белков, содержащихся в секрете поджелудочной железы — 4,7%, коровьем молоке — 58%, синтезируемых в печени белках сыворотки крови — 59,7%. Однако в курином яйце гликозилировано около 97% суммы белков.

Рис. 11.1. Размещение углеводных цепей, присоединенных к остаткам аспарагина Asn-297 (выделены жирными линиями) между доменами СH2 иммуноглобулина G кролика.
Углеводные структуры образуют гидрофильную прокладку между поверхностями доменов
По-видимому, гликозилирование важно не для структуры или функции белка как такового, а для его взаимоотношений с другими компонентами клетки или организма, для его «поведения» в этих чрезвычайно сложных системах. Действительно, известно, что фосфорилирование одного из остатков маннозы в олигосахаридных структурах цитоплазматических ферментов, например внутриклеточной аспартильной протеиназы — катепсина D, «адресует» их в лизосомы. Присутствие другого моносахарида — сиаловой кислоты — в гликопротеинах крови способствует их удержанию в кровотоке; белки, подвергшиеся отщеплению концевых остатков сиаловой кислоты, быстро удаляются печенью. Например, церулоплазмин, циркулирующий в крови в среднем около 50 ч, после отщепления концевой сиаловой кислоты удаляется за несколько минут.
Несомненна физиологическая роль углеводных компонентов в гликопротеинах мембран. Они неизменно располагаются в той части молекулы, которая направлена в окружающую среду, но почти всегда отсутствуют в цитоплазматических доменах этих белков. Углеводные компоненты участвуют в процессах межклеточного «узнавания», дифференциации, трансформации клеток, фагоцитозе, процессах оплодотворения, во взаимодействии клеток с вирусами, связывании гормонов с рецепторными белками.
Интересны гликопротеины антарктических рыб, понижающие точку замерзания жидкостей, — их функциональная роль вполне очевидна. В полипептидной цепи одного из них содержатся многочисленные повторы Ala—Ala—Thr, причем к гидроксильным группам треонина присоединены дисахаридные звенья галактозил-N-ацетилгалактозамина.