Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Посттрансляционная модификация белка
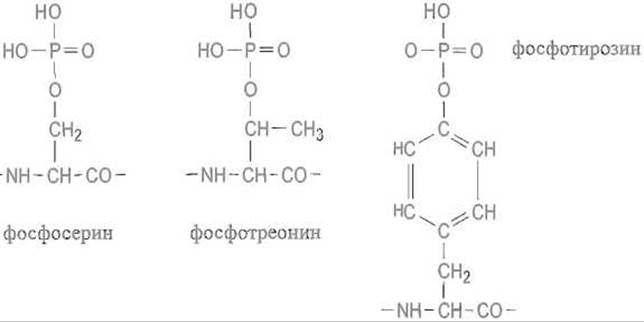
Фосфорилирование белков. Фосфопротеины
Белки фосфорилируют специфические ферменты — протеинкиназы, которые катализируют перенос концевого фосфата АТФ на гидроксильные группы остатков серина или треонина. Значительно реже наблюдается фосфорилирование гидроксила тирозина, так что содержание фосфотирозина составляет около 0,1% суммы фосфосерина и фосфoтреонина, однако физиологическая роль этой модификации весьма велика.
Фосфоэфирные связи фосфопротеинов могут гидролизоваться специализированными ферментами — фосфопротеинфосфатазами. Таким образом, фосфорилирование — обратимый процесс. Белок за время своего существования может многократно переходить то в фосфорилированную, то в дефосфорилированную форму. Эта чрезвычайно важная особенность фосфорилирования — возможность обращения модификации — обусловила роль этой реакции как механизма, позволяющего регулировать активность белка и даже целых групп белков в ответ на изменяющиеся внутри- и внеклеточные стимулы.
Хорошо изучена роль фосфорилирования в регуляции фосфорилазы — фермента, катализирующего фосфоролиз запасного полисахарида гликогена с образованием глюкозо-1-фосфата, далее используемого в энергетическом обмене. Противоположную реакцию — включение остатка глюкозы из глюкозо-1-фосфата в гликоген — катализирует гликогенсинтетаза. Совместное действие этих двух ферментов позволяет проводить цикл превращений, показанный ниже:
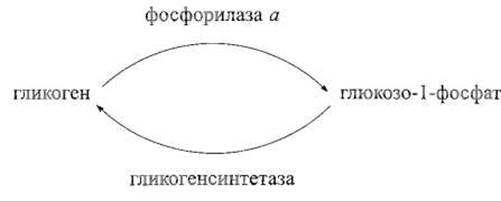
Такой цикл требует управления, попеременного включения фосфорилазной или синтетазной активности с выключением противоположно направленной. Если бы такого управления не было, цикл превратился бы в бессмысленный. И действительно, активность гликогенфосфорилазы контролируется целым рядом факторов, один из которых — фосфорилирование и дефосфорилирование этого фермента. Нефосфорилированная фосфорилаза b практически неактивна, но превращается в активную форму — фосфорилазу а — при фосфорилировании соответствующей протеинкиназой только одного остатка серина — Ser-14. Чем может быть объяснена активация фермента, субъединица которого состоит примерно из 400 аминокислотных остатков, в результате, казалось бы, небольшого изменения ковалентной структуры?
Подвергающийся фосфорилированию остаток серина расположен на границе контакта двух субъединиц фосфорилазы, т.е. в районе относительно слабых взаимодействий, который особенно легко поддается перестройке уже при малых изменениях ковалентной структуры. Присоединение фосфата к Ser-14 влечет за собой установление электростатического взаимодействия и появление сразу двух водородных связей между фосфоэфирной группой фосфосерина и гуанидогруппой остатка Arg-69, принадлежащего другой субъединице фермента и также локализованного на поверхности контакта:
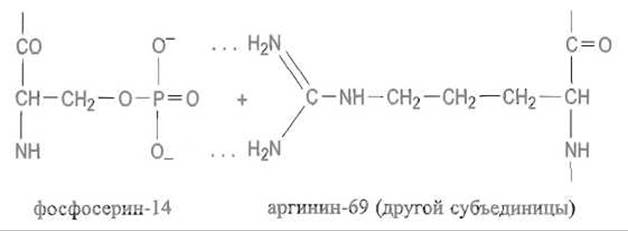
Это изменяет систему нековалентных связей на поверхности контакта двух субъединиц, эффект передается в активный центр фермента. В результате пептидная петля, экранирующая активный центр в фосфорилазе b, отгибается и освобождает доступ субстрата к нему, активируя тем самым фермент.
Отщепление фосфата фосфопротеинфосфатазой вновь переводит фосфосерин-14 в серин и восстанавливает свойственную неактивной фосфорилазе b систему нековалентных связей на границе между субъединицами, пептидная петля возвращается на прежнее место, блокируя каталитический центр.
Таким образом, столь значительные функциональные последствия фосфорилирования (и дефосфорилирования) обусловлены тем, что эти реакции происходят в относительно лабильной зоне белковой структуры — в области контакта субъединиц (как в рассмотренном случае) или доменов. Интересно, что регуляторное действие АМФ на фосфорилазу основано на похожем принципе - аденозинмонофосфат образует прочный и нековалентный комплекс с фосфорилазой b, связываясь на поверхности контакта субъединиц. Его фосфатная группа взаимодействует с двумя гуанидогруппами остатков архинина и вызывает, как и в случае фосфорилирования Ser-14, цепь перестроек в структурно лабильной зоне фермента, опять-таки открывая каталитический центр. Результатом является активация фосфорилазы b — фермента, практически неактивного в отсутствие АМФ. Разница в том, что фосфорилирование активирует фермент, переводя его в фосфорилазу а, независимо от концентрации эффектора (в данном случае АМФ) внутри клетки и, следовательно, в определенной мере независимо от биохимического статуса клетки.
Как уже отмечалось, перенос фосфата АТФ на фермент катализируется протеинкиназой. Активность этого фермента, в свою очередь, контролируется и зависит от содержания в клетке так называемого «вторичного мессенджера» — цАМФ. цАМФ-зависимая протеинкиназа состоит из неодинаковых субъединиц: регуляторной R-субъединицы, способной связывать эффектор, т.е. цАМФ, и каталитической С-субъединицы. Регуляторная субъединица выступает как ингибитор протеинкиназы, в комплексе с ней каталитическая субъединица лишена активности. При связывании регуляторной субъединицей цАМФ, которое происходит за счет нековалентных взаимодействий, она утрачивает способность образовывать четвертичную структуру. В результате каталитическая субъединица высвобождается и оказывается способной фосфорилировать белки.
Снижение концентрации свободного цАМФ в клетке приводит к тому, что синтезируемая в избытке регуляторная субъединица вновь связывается с каталитической субъединицей, вызывая ингибирование фермента. Так реализуется динамическое равновесие:
![]()
Таким образом, концентрация цАМФ управляет активностью протеинкиназы, а через нее — активностью гликогенфосфорилазы, в конечном счете — мобилизацией энергии, запасенной клеткой в форме гликогена. В свою очередь уровень цАМФ определяется соотношением активностей аденилатциклазы — фермента, превращающего АТФ в цАМФ, и фосфодиэстеразы, гидролизующей цАМФ до АМФ. Активность аденилатциклазы зависит от ряда внешних факторов, среди которых особенно важен гормональный контроль. Итак, фосфорилирование фосфорилазы b и ее превращение в активный фермент фосфорилазу а есть результат целого каскада ферментативных реакций, управляемого весьма тонко. Как уже упоминалось, фосфорилирование — не единственный путь воздействия на активность фосфорилазы.
Активация фосфорилазы, как видно из рассмотренного выше цикла, должна сопровождаться снижением активности гликогенсинтетазы. Этот фермент также существует в двух формах, однако в этом случае активная форма не фосфорилирована. При фосфорилировании соответствующей протеинкиназой она превращается в неактивную гликогенсинтетазу.
Следовательно, изображенный выше цикл синтеза и фосфоролиза гликогена следует дополнить довольно сложной схемой взаимопревращений активных и неактивных форм ферментов, катализирующих эти процессы:
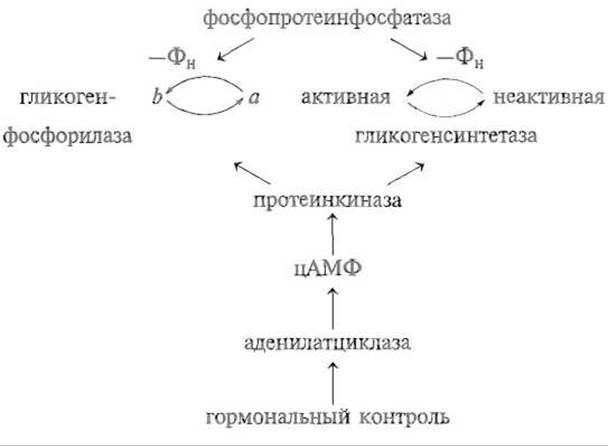
Необходимо иметь в виду, что и эта схема сильно упрощена. Выяснилось, что активность протеинкиназы может регулироваться кальмодулином — белком, связывающим ионы кальция, и, следовательно, зависит от концентрации в клетке и этого вторичного мессенджера.
Аналогично, фосфорилированием и дефосфорилированием контролируется активность целого ряда других метаболических ферментов, в частности синтетазы жирных кислот — пируватдегидрогеназы. Важно подчеркнуть, что реакции фосфорилирования и дефосфорилирования коренным образом отличаются от аллостерической регуляции ферментов, поскольку они не находятся в прямой зависимости от биохимического статуса клетки и, следовательно, могут использоваться для изменения активности под воздействием внеклеточных сигналов, они удобны для регуляции на уровне организма. Известны и другие протеинкиназы, фосфорилирующие остатки серина или треонина в белках, в том числе независимые от цДМФ или контролируемые цГМФ, диацилглицерином.
Выбор остатка серина, подвергаемого фосфорилированию, может зависеть от последовательности аминокислот, которые его окружают. Так, цАМФ-зависимая протеинкиназа быка фосфорилирует гидроксильную группу серина в последовательности
Arg—Arg—Ala—Ser—Val (Leu),
причем соседствующие остатки аргинина, видимо, направляют фермент.
Фосфорилирование по остаткам тирозина, которое катализируется специфическими протеинкиназами (тирозиикиназами), встречается значительно реже, чем фосфорилирование остатков серина и треонина, — на долю фосфотирозина приходится около 0,1% всего связанного с белком фосфата. Однако биологическая роль этой реакции очень велика, так как она активно используется для передачи сигналов в биологических системах.
Так, инсулин, связываясь с рецептором — трансмембранным белком, вызывает активацию его домена, направленного в цитоплазму и являющегося тирозинкиназой. Тирозинкиназную активность индуцирует ряд факторов роста — белков, запускающих деление клеток по механизму, аналогичному описанному для инсулина Рецепторы этих факторов — крупные трансмембранные белки — связывают их на наружной поверхности мембраны. Образование комплекса фактор — рецептор передает сигнал через трансмембранную часть рецептора на его цитоплазматический домен, являющийся тирозинкиназой. Активированная таким образом тирозинкиназа модифицирует внутриклеточные белки, передавая сигнал далее.
Тирозинкиназы фосфорилируют остатки тирозина в некоторых внутриклеточных белках, вовлеченных в сложную систему регуляции клеточного деления, в которой также участвует и фосфорилирование белков по остаткам серина и треонина. Нарушение этой весьма сложной регуляторной сети может привести к неконтролируемому делению клеток, опухолевому росту. Характерно, что онкобелки, структурно близкие нормальным белкам животной клетки, но вызывающие ее трансформацию, превращение в опухолевую, нередко оказываются тирозиикиназами.