Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
G-белки
Белок c-H-ras
Обширному классу ГТФ-связывающих, или G-белков, принадлежит особо важная роль в передаче сигналов в клетку и внутри клетки. Их функциональное состояние, иначе говоря, способность к передаче сигнала другим белкам определяется тем, содержат ли они связанную молекулу гуанозинтрифосфата (ГТФ) или продукт ее гидролиза — гуанозиндифосфат (ГДФ). Сами эти белки обладают собственной ГТФазной активностью, поэтому G-белок, активированный нековалентным присоединением ГТФ, постепенно гидролизует этот эффектор до ГДФ, возвращаясь при этом в неактивную форму:
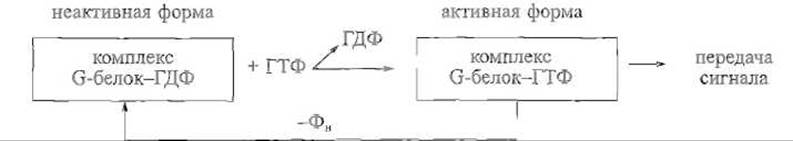
Таким образом, важнейшей особенностью G-белков является способность удерживать активную конформацию и участвовать в передаче сигнала в течение определенного времени, что зависит от их ГТФазной активности, а также от действия белковых факторов, которые либо способствуют обмену ГДФ на ГТФ и, следовательно, переводу белка в активное состояние, либо, напротив, усиливают ГТФазную активность G-белка и, значит, ускоряют его переход в неактивный комплекс с ГДФ. Структурно-функциональные особенности G-белков иллюстрируются следующими примерами.
К G-белкам принадлежат некоторые онкобелки, в частности c-H-ras-онкобелок человека. G-белки, кодируемые мутантными генами семейства ras, нередко обнаруживаются в опухолях. Нормальный ген c-H-ras кодирует так называемый белок р21 с молекулярной массой 21 кДа. локализованный в цитоплазматической мембране и являющийся потенциальным предшественником онкобелка — протоонкобелком Его функция в нормальной клетке состоит, по-видимому, в том, что он воспринимает извне стимулирующие клеточный рост сигналы и передает их на белки-мишени внутри клетки, инициируя ее рост и деление.
К комплексу белка р21 с ГТФ присоединяется белок GAP (GTPase Activating Protein), который усиливает присущую этому комплексу ГТФазную активность. Именно тройной комплекс р21—ГТФ—GAP и является передатчиком сигнала. В то же время в нем происходит гидролиз ГТФ до ГДФ, катализируемый белком р21. Последний сам по себе является очень медленно действующей ГТФазой (ускорение гидролиза гуанозинтрифосфата примерно в 1000 раз, время полужизни комплекса р21—ГТФ — около 1 ч). ГТФазная активность резко (по некоторым оценкам, в 100 000 раз) возрастает при образовании тройного комплекса с активирующим белком GAP. Существенно, что в результате гидролиза ГТФ до ГДФ комплекс с GAP распадается и передача сигнала прекращается.
Таким образом, от эффективности гидролиза ГТФ зависит продолжительность действия сигнала; G-белок как бы содержит внутренний датчик времени, регулируемый за счет взаимодействия с GAP. Понятно, что применительно к отдельно взятой молекуле можно говорить лишь о большей или меньшей вероятности расщепления ГТФ за определенный промежуток времени. Однако, поскольку в передаче сигнала в конкретной биологической системе участвует множество таких молекул, гидролиз ГТФ как бы задает время действия G-белка, т е продолжительность сигнала.
Белок р21 содержит 189 аминокислотных остатков в одной пептидной цепи. Последняя образует шесть ß-структурных отрезков и четыре а-спирали (рис. 12.1), причем для С-концевой половины белка характерна чередующаяся укладка элементов вторичной структуры ß—a-ß-a—ß, напоминающая структурный мотив нуклеотидсвязывающего домена дегидрогеназ. Из десяти петель, соединяющих а-спиральные и ß-структурные участки, пять (L1, L2, L4, L9 и L10) образуют карман, в котором связываются ГДФ и ГТФ, причем с белком взаимодействуют и основание — гуанин, и рибоза, и фосфатные группы.
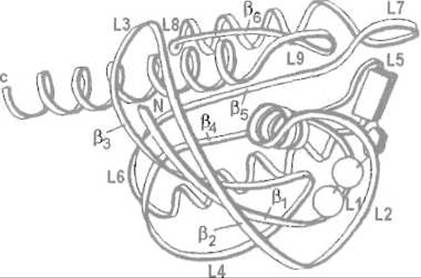
Рис. 12.1. Строение c-H-ras белка р21 человека (остатки 1—171) Видны четыре а-спирали, ß-структурные участки ß1-ß6 и петли L1-L8. Прямоугольником, пятиугольником и двумя кружками показано положение связанного ГДФ
Петля L1, соединяющая N-концевой ß-структурный отрезок и первую а-спираль, содержит последовательность:
![]()
Она как бы «оседлывает» фосфоэфирную связь между (β и а-фосфатными группами субстрата, составляя, очевидно, часть ГТФазного каталитического центра. В вирусных белках, принадлежащих к тому же семейству и построенных таким же образом, концевой (у) фосфат ГТФ внутримолекулярно переносится на гидроксил остатка Thr-59, а не на воду (так называемое аутофосфорилирование). Следует подчеркнуть, что е каталитическим центром сближен участок связывания активирующего белка — GAP.
В гидролизе гуанозинтрифосфата участвует молекула воды, которая образует водородную связь с карбонильной группой Thr-35 и активируется за счет взаимодействия с другими функциональными группами каталитического центра. Однако в свободном G-белке эти участки активного центра существуют в виде нескольких конформеров, из которых способен активировать указанную молекулу воды лишь один, чем и объясняется весьма низкая эффективность катализа. По-видимому, в комплексе ras-белка с активирующим белком (GAP) закрепляется именно эта конформация, что и влечет за собой резкое ускорение гидролиза ГТФ.
Гидролиз ГТФ, связанного в активном центре G-белка, приводит к локальным изменениям структуры в районе контакта с ß- и у-фосфатными группами ГТФ (рис. 12 2) Видимо, за отщеплением у-фосфатной группы ГТФ следует приближение подвижных элементов белковой структуры к (3-фосфату ГДФ, как бы заполнение образовавшегося «зазора». Заметно изменяется, в частности, укладка петель L2 (остатки 26-36) и L4 (остатки 59—65), а также способ связывания иона магния, взаимодействующего с активным центром белка р21 и ГТФ или ГДФ. Поскольку эти лее петли обеспечивают взаимодействие с активирующим белком GAP, такой конформационный переход нарушает контакт р21—GAP, прерывая тем самым передачу сигнала.
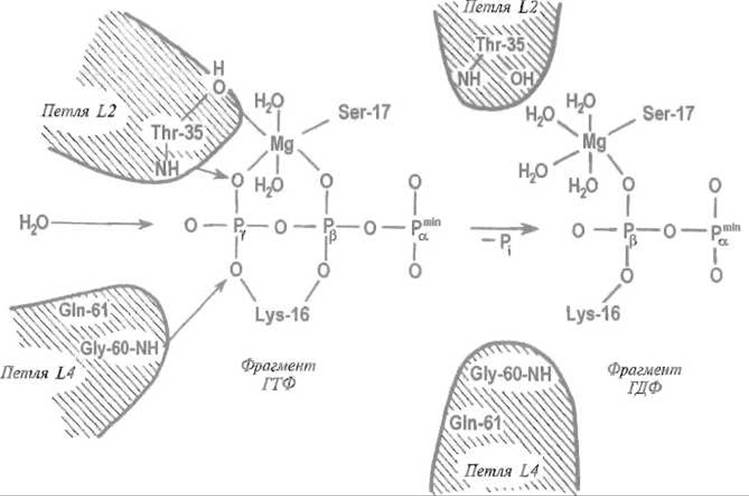
Рис. 12.2. Изменения во взаимодействии между нуклеотидом и G-белком, сопровождающие гидролиз ГТФ до ГДФ.
Показаны только три- и дифосфатные фрагменты нуклеотидов. Молекула воды, которую активируют взаимодействия с остатками глутамина Gln-61 и его окружением, атакует связанную белком молекулу ГТФ, концевой у-фосфатный остаток которой связан с NH-группами остатков треонина Thr-35 в петле L2 и глицина Gly-60 в петле L4. Отщепление концевого у-фосфатиого остатка приводит к образованию ГДФ. В результате Thr-35 и Gly-60, а следовательно петли L2 и L4, утрачивают непосредственный контакт с лигандом — молекулой ГДФ. Это вызывает изменение конформации петель, неблагоприятное для взаимодействия G-белка с белком, который участвует в передаче сигнала
С-концевой фрагмент с-Н-rаs-белка, взаимодействующий, как предполагают, с рецептором, находящимся в мембране, соединен с описанным выше «каталитическим» доменом длинной а-спиралью, которая, видимо, участвует в передаче сигнала. У всеx белков семейства ras на карбоксильном конце содержится характерная последовательность СААХ (где С - цистеин, А — алифатическая аминокислота), которая является сигналом для пренилирования тиоловой группы Cys-186 с последующим отщеплением С-концевого трипептида. Такая посттрансляционная гидрофобизация С-конца rаs-белка (см. гл. 11) необходима для его присоединения к цитоплазматической стороне клеточной мембраны. ras-Белки, лишенные этой структуры, трансформирующим действием на клетки не обладают, хотя и сохраняют способность связывать и гидролизовать ГТФ.
Белки, обеспечивающие ввод и вывод сигнала, передаваемого белком р21, пока строго не идентифицированы, хотя есть основания полагать, что одним из них является белок GAP, который в свою очередь взаимодействует с рецептором факторов роста. Видимо, другой белок катализирует обмен ГДФ на ГТФ — процесс, весьма медленно протекающий в комплексе р21 — ГДФ.
Таким образом, сравнительно небольшой c-H-ras-белок вовлечен в сложную систему межмолекулярных взаимодействий, реализация которых решающим образом зависит от присутствия связанной им молекулы ГТФ и скорости ее гидролиза. Нетрудно понять, что столь сложная функция белка может легко нарушаться мутациями, затрагивающими отдельные аминокислотные остатки в нормальном белке — протоонкогене. Вследствие такого нарушения функциональных свойств мутантный белок может становиться собственно онкогеном.
Так, замещение остатка Gly-12 в петле, входящей в каталитический центр, любой аминокислотой, кроме пролина, резко снижает ГТФазную активность, причем она перестает усиливаться за счет взаимодействия с GAP-белком. Как показал рентгеноструктурный анализ с применением метода, позволяющего наблюдать за гидролизом ГТФ в динамике, мутация не вызывает крупных изменений в конформации зоны связывания ГТФ. Например, при замене Gly-12 → Val затрагиваются лишь позиции остатков
Gly-60, Thr-38 и Gln-61, окружающих у-фосфат ГТФ. В результате, однако, мутантный белок крайне медленно гидролизует ГТФ и как бы перестает «выключаться», продолжая посылать в клетку стимулирующие сигналы даже тогда, когда они не нужны, в отсутствие внешнего сигнала. Таким образом, белок c-H-ras становится способным трансформировать нормальные клетки в опухолевые, т.е. приобретает трансформирующую активность.
Трансформирующую активность и, следовательно, превращение протоонкогена в онкоген вызывают и замены аминокислотных остатков 116 и 119, участвующих в связывании гуанинового фрагмента ГТФ, а также остатков 59, 61 и 63, которые могут влиять на конформацию петли, включающей остаток глицина Gly-12, снижая этим ГТФазную активность.
В то же время аминокислотные замены на участке 35—40 снижают способность активированного c-H-ras-белка к трансформации клеток, хотя и не изменяют ГТФазной активности или связывания ГТФ или ГДФ. По-видимому, этот участок вовлечен во взаимодействие с белком-мишенью, на который передается сигнал. Нарушение такого взаимодействия лишает смысла активацию c-H-ras-бeлка при связывании ГТФ, прерывает передачу сигнала.
Основные черты строения и механизма действия ras 21-белка, по всей видимости, типичны для других G-белков, во всяком случае для их G-доменов. В частности, близкую структуру имеет G-домен фактора элонгации EF—Tu.