Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Фибриллярные белки
Ламинин
Ламинин — белок, участвующий в формировании внеклеточного матрикса и закреплении клеток. Образован очень длинными полипептидными цепями и по своей геометрии мог бы быть отнесен к фибриллярным белкам, однако довольно протяженные его участки представляют собой цепочки глобул небольшого размера, структурно сходных с одним из факторов роста. Таким образом, ламинин нельзя безоговорочно считать традиционным фибриллярным белком, хотя по контурам молекулы и функциональным свойствам между ними немало общего.
Этот гликопротеин с мол. массой около 900 кДа является главным компонентом базальной мембраны, на которой формируется соединительная ткань. Известно несколько ламининов, отличающихся деталями структуры и локализацией в той или иной ткани, так что речь идет о целом семействе структурообразующих полидоменных белков.
Ламинин связывается с коллагеном типа IV, характерным для базальной мембраны, гепарансульфатом, протеогликаном и другими макромолекулами, в частности главным белком базальной мембраны нидогеном, что приводит к формированию многокомпонентной сетчатой структуры — матрикса. Помимо того, ламинин обеспечивает связывание клеток эпителия с базальной мембраной Ламинин (рис. 14.5) построен из трех полипептидных цепей: A-цепи (мол. масса 440 кДа), В1-цепи (225 кДа) и В2-цепи (205 кДа). С-концевые районы всех трех цепей могут образовывать весьма протяженные а-спирали, построенные из множества гептадных повторов, характерных для суперспирализованных белков, например кератинов.
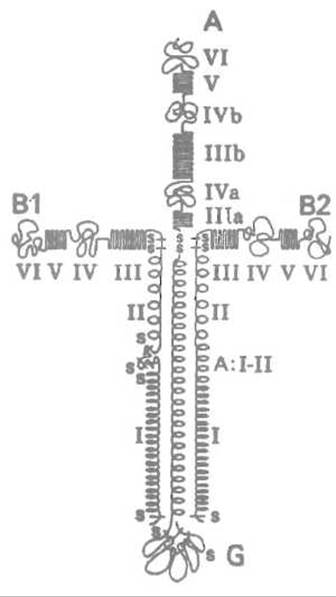
Рис. 14.5. Структурная организация ламинина.
А, В1 и В2 — полипептидные цепи, С-концы которых находятся в нижней части рисунка. Направленные параллельно спиральные районы, по-видимому, образуют единую суперспираль. Один из ее участков ответствен за рост нейритов и адгезию нервных клеток. G — крупная глобула, образованная С-концевым районом А-цепи.
Римскими цифрами обозначены домены в полипептидных цепях ламинина. Домен III цепи В ответствен за связывание с рецептором на поверхности клетки и содержит последовательность Туг—Не—Ser—Gly—Arg. N-концевые глобулярные домены цепей В1 и В2 связывают коллаген IV
По-видимому, С-концевые а-спиральные районы всех трех цепей сплетены в единую весьма жесткую палочкообразную структуру — суперспираль длиной около 700—800 А, которая завершается глобулой, построенной за счет выступающего С-концевого участка А-цепи. N-концевая часть A-цепи формирует, вероятно, несколько доменов, включая так называемые циcтеинбогатые участки, в которых примерно на 50 аминокислот приходится 8 остатков цистеина. Эти домены структурно аналогичны фактору роста эпителия (EGF), имеют жесткую палочковидную структуру и, что примечательно, нередко обнаруживаются в структуре белков животных.
N-концевые участки цепей В1 и В2 как бы откинуты в стороны от аналогичного участка цепи А, поэтому молекула ламинина приобретает форму креста, образованного тремя короткими отрезками и одним длинным, причем каждый из грех коротких лучей завершается двумя небольшими, а длинный — одной крупной глобулой. Центральная часть крестообразной структуры стабилизирована несколькими дисульфидными связями. N-концевые участки легких цепей В1 и В2 также образуют по два глобулярных домена и жесткие палочковидные структуры, построенные аналогично фактору роста эпителия EGF.
В одном из таких EGF доменов цепи В1 находится участок узнавания рецептора ламинина, расположенного на поверхности клеток. Этот участок ответствен за адгезию клеток и их направленное перемещение. Характерно, что сравнительно короткий пентапептид — фрагмент последовательности в этом домене ламинина, имеющий строение Туг—Ile—Gly— Ser—Arg, способен конкурировать с ламинином за взаимодействие с клеточным рецептором и препятствовать адгезии клеток, в том числе, например, клеток меланомы, базальной мембраной. Связывание коллагена IV, характерного компонента базальной мембраны, обеспечивается глобулами на коротких лучах креста, участок связывания нидогена (150 кДа) расположен в EGF-подобном домене цепи В2.