ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 2. Клетки, осуществляющие иммунный ответ
ПОЛИМОРФНОЯДЕРНЫЕ ГРАНУЛОЦИТЫ, ТУЧНЫЕ КЛЕТКИ И ТРОМБОЦИТЫ
Полиморфноядерные гранулоциты (часто называемые просто гранулоцитами) — это в основном нейтрофилы (ПМН), которые высвобождаются костным мозгом со скоростью примерно 7 млн/мин. По сравнению с моноцитами и макрофагами, которые могут сохраняться месяцы или годы, гранулоциты — короткоживущие (всего 2-3 сут) клетки. Они составляют 60—70% общего числа лейкоцитов крови и содержатся также в тканях. Подобно моноцитам, ПМН moot прилипать к эндотелиальным клеткам, выстилающим кровеносные сосуды («краевое стояние») и покидать кровоток, протискиваясь между эндотелиальными клетками (см. рис. 1.17). Этот процесс известен какдиапедез. Адгезию ПМН вызывают хемоаттрактанты (хемокины), такие как ИЛ-8 (см. гл. 5), и опосредуют гранулоцитарные рецепторы, взаимодействующие с лигандами на эндотелиальных клетках.
Гранулоциты не обладают какой-либо «врожденной» антигенной специфичностью, но им принадлежит важнейшая роль (обычно вместе с антителами и комплементом) в острой защитной воспалительной реакции на инфекцию. Главная функция этих клеток - фагоцитоз. Их значение становится очевидным на примере больных с пониженным содержанием гранулоиитов в крови или в случаях редко встречающегося наследственного иммунодефицита, при котором ПМН не способны мигрировать из сосудов в ответ на хемотаксический стимул: обе ситуации характеризуются повышенной восприимчивостью к инфекции.
Нейтрофилы
Эти лейкоциты составляют более 95% циркулирующих гранулоцитов; для них характерны многодольчатое (сегментированное) ядро и диаметр 10—20 мкм (рис. 2.32 и 2.33).
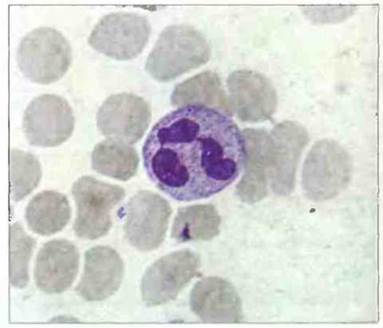
Рис. 2.32. Морфология нейтрофила. Зрелый нейтрофил с дольчатым (сегментированным) ядром в мазке крови. Четкое выявление в одной из таких клеток конденсированного хроматина в виде «барабанной палочки», представляющего собой инактивированную Х-хромосому, свидетельствует о принадлежности крови лицу женского пола. Окрашивание по Гимзе. х 1500 По Zucker-franklin D , Greaves M.F., Grossi С.Е. et al. 1988. Atlas of Blood Cells: Function and Pathology Voi. II. 2nd edn. Milan: E.E. Ermes, Philadelphia: Lea and Febiger.
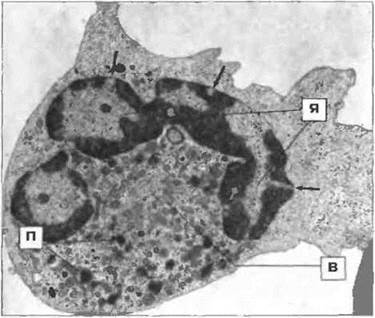
Рис. 2.33. Ультраструктура нейтрофила. Цитоплазма содержит первичные (П) и вторичные (В) гранулы. Первичные (более электроноплотных) гранул гораздо меньше. Ядро (Я) сегментированное, стрелками указаны поры в ядерной оболочке, х 17 500. По Zucker Franklin D., Greaves M.F., Grossi C.E. et al. 1988. Atlas of Blood Cells Function and Pathology. Vol II. 2nd edn Milan: E.E. Ermes, Philadelphia: Lea and Febiger.
Хемотаксис нейтрофилов вызывают фрагменты белков, образующиеся в результате активации комплемента (например, С5а), факторы фибринолитической и кининовой систем, а также продукты лейкоцитарного, тромбоцитарного и бактериального происхождения. Под действием хемотаксических стимулов происходят «краевое стояние» (прилипание к эндотелиальным клеткам) и диапедез нейтрофилов. Подробно этот процесс описан в гл. 5.
Нейтрофилы обладают большим набором антибиотических белков, которые хранятся в гранулах двух типов (рис. 2.33). Первичные (азурофильные) гранулы - это лизосомы, содержащие кислые гидролизы, миелопероксидазу и мурамидазу (лизоцим). Во вторичных (специфических) гранулах дополнительно к лизоциму обнаружен лактоферрин. Кроме ферментов и лактоферрина, в этих гранулах содержатся в высоких концентрациях антибиотические белки — дефензины, сепроцидины, кателицидины и белок, индуцирующий проницаемость бактериальных клеток. Фагоцитированные нейтрофилами микробы находятся в вакуолях (называемых фагосомами), которые сливаются с лизосомами, превращаясь в фаголизосомы (рис. 2.34).
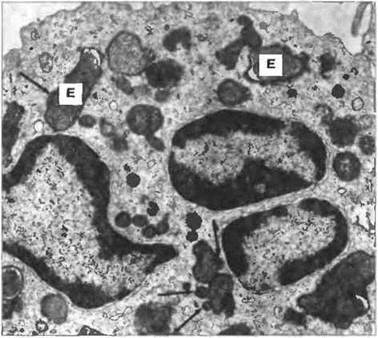
Рис. 2.34. Нейтрофил, фагоцитировавший клетки Escherichia соli (Е). В фаголизосомах видны многочисленные клетки этой бактерии. Нейтрофил почти полностью дегранулирован, и только отдельные лизосомы (указаны стрелками) еще находятся в процессе слияния с фагосомами. х 15 000. По Zucker-Franklin D., Greaves M.F., Grossi C.E. et al. 1988. Atlas of Blood Cells: Function and Pathology. Vol. II. 2nd edn. Milan: E.E. Ermes, Philadelphia: Lea and Febiger.
При активации иммунными комплексами, опосредованной Fcy-рецепторам и, нейтрофилы способны также высвобождать содержимое гранул и цитотоксические соединения во внеклеточное пространство. Вполне вероятно, что именно этот механизм лежит в основе патогенеза болезней иммунных комплексов (гиперчувствительность III типа; см. гл. 25).
Эозинофилы
Эозинофилы крови человека обычно содержат двухдольчатое ядро и множество цитоплазматических гранул, которые окрашиваются кислыми красителями, например эозином (рис. 2.35). Среди лейкоцитов крови здорового, не страдающего аллергией человека на эозинофилы приходится 2—5%. Они, по-видимому, способны фагоцитировать и уничтожать поглощенные микробные клетки, хотя это и не относится к их прямым функциям. Гранулы зрелых эозинофилов — это окруженные мембранами клеточные органеллы с «кристалловидной» сердцевиной, заметные на фоне окружающего матрикса благодаря их высокой электронной плотности (рис. 2.36).
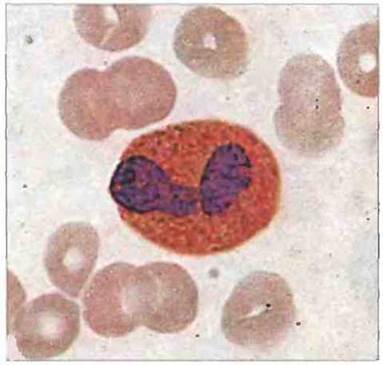
Рис. 2.35. Морфология эозинофила. Видны двухдольчатое ядро и эозинофильные гранулы в цитоплазме. Окраска по Гимзе. х 1000. По Zucker-Franklin D., Greaves M.F., Grossi С.Е. et al. 1988. Atlas of Blood Cells: Function and Pathology. Vol. II. 2nd edn. Milan: E.E. Ermes, Philadelphia: Lea arid Febiger.
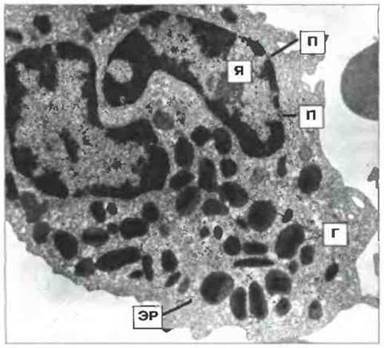
Рис. 2.36. Ультраструктура эозинофила человека. Зрелый эозинофил содержит в цитоплазме гранулы (Г) с кристалловидной сердцевиной. Я - ядро; ЭР - эндоплазматический ретикулум; П - ядерные поры, х 17 500. По Zucker-Franktin D., Greaves M.F., Grossi С.Е. et al. 1988. Atlas of Blood Cells: Function and Pathology. Vol. II. 2nd edn. Milan: EE Ermes, Philadelphia: Lea and Febiger.
Определенные стимулы вызывают дегрануляцию эозинофилов, т. е. слияние гранул с цитоплазматической мембраной и высвобождение их содержимого во внеклеточную среду. Реакция дегрануляции — это один из механизмов использования эозинофилами токсичного содержимого своих гранул для уничтожения крупных мишеней (например, шистосомул), которые не поддаются фагоцитозу (рис. 2.37). Другой механизм состоит в образовании токсичных реакционноспособных метаболитов кислорода Оба механизма, вероятно, составляют основу противогельминтозного иммунитета, в котором, как предполагается, эозинофилам принадлежит особая роль (см. гл. 18).

Рис. 2.37. Уничтожение шистосомулы эозинофилом. Эозинофил (ЭО) прикрепился к опсонизированной IgG молодой особи Schistosoma mansoni (Ш). В области контактов можно заметить электроноплотный материал (указан стрелками), содержащий главный основный белок и катионный белок эозинофилов. х 19 000. По Zucker-Franktin D., Greaves M.F., Grossi С.Е. et al. 1988. Atlas of Blood Cells: Function and Pathology. V/ol. II. 2nd edn. Milan: E.E. Ermes, Philadelphia: Lea and Febiger.
Привлечение эозинофилов к месту инвазии паразита происходит за счет высвобождения Т-клетками, тучными клетками и базофилами особых продуктов, таких как анафилактический фактор хемотаксиса эозинофилов (ФХЭ-А). В нашем примере они связываются с поверхностью шистосомул, опсонизированной специфичными антителами изотипа IgG или IgE, и в процессе дегрануляции выделяют токсин, названный главным основным белком. Этот токсин содержится в кристалловидной сердцевине эозинофильной гранулы; матрикс гранулы содержит другое токсическое вещество — катионный белок эозинофилов. Эозинофжлы выделяют также гистаминазу и арилсульфатазу, которые инактивируют продукты выделения тучных клеток — гистамин и фткторанафжлаксии, вызывающий замедленную реакцию (ФЗР-А). Таким образом, выделяемые эозинофилами продукты подавляют воспалительную реакцию и, в частности, миграцию гранулой итов в очаг инвазии.
Базофилы и тучные клетки
Базофилы присутствуют в циркулирующей крови в очень незначительном количестве, менее 0,2% общего числа лейкоцитов (рис. 2.38). Тучные клетки вовсе не встречаются в циркуляции и по ряду свойств отличаются от базофилов.
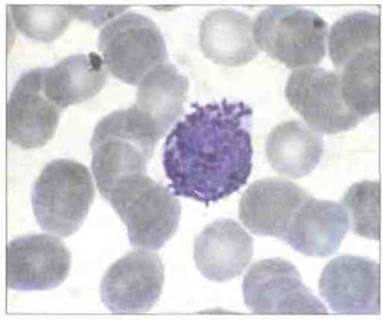
Рис. 2.38. Морфология базофила. В мазке крови, окрашенном по Райту, виден типичный базофильный гранулоцит с темно-лиловыми гранулами, х 1000.
Известны два вида тучных клеток - тучные клетки слизистых оболочек и тучные клетки соединительной ткани. Пролиферация первых, в отличие от вторых, зависит, по-видимому, от Т- клеток. Оба вида тучных клеток видны при световой микроскопии препаратов, окрашенных основными красителями (рис. 2.39). В цитоплазме зрелых базофилов крови присутствуют неравномерно распределенные и окруженные мембранами гранулы (рис. 2.40). Гранулы базофилов и тучных клеток содержат гепарин, ФЗР-А, гистамин и ФХЭ-А.
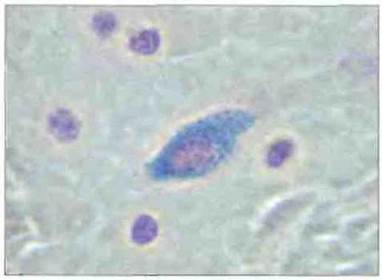
Рис. 2.39. Соединительнотканная тучная клетка человека на гистологическом срезе. Видна темно-голубая цитоплазма с лиловыми гранулами. Окрашивание альциановым синим и сафранином, х 600. (Фото любезно предоставлено д-ром T.S. Оrr.)
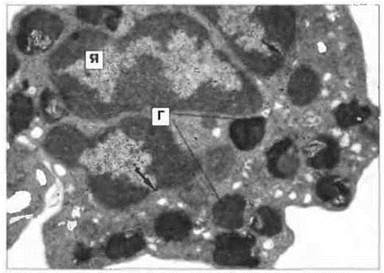
Рис. 2.40. Ультраструктура базофила. Видны сегментированое ядро (Я) и крупные цитоплазматические гранулы (Г), х 11 000. По Zucker-Franklin D., Greaves M.F., GrossiC.E. etal. 1988. Atlas of Blood Cells: Function and Pathology. Vol II. 2nd edn. Milan. E.E. Ermes, Philadelphia: Lea and Febiger.
Часто тот или иной аллерген (антиген, ставшим причиной аллергической реакции) служит стимулом дегрануляции тучных клеток или базофилов. Дли этого он должен перекрестно «сшить» соседние молекулы IgE, связанные с высокоаффинными рецепторами для IgE (FcεRI) на плазматической мембране тучной клетки или базофила. В результате дегрануляции происходит мгновенное высвобождение всего содержимого гранул. Сначала гранулы сливаются между собой внутри цитоплазмы, затем их содержимое выбрасывается из клетки (рис. 2.41). Секретируемые в результате дегрануляции медиаторы, например гистамин, вызывают патологические проявления аллергии, но, с другой стороны, играют положительную роль в антипаразитарном иммунитете, усиливая воспалительную реакцию. Функциональные маркеры гранулоцитов и тучных клеток приведены на рис. 2.42.
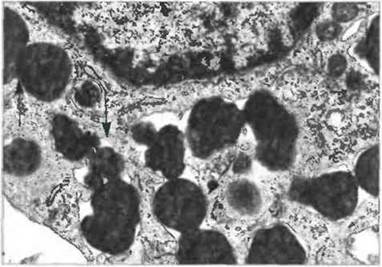
Рис. 2.41. Дегрануляция тучной клетки. Прежде чем произойдет выброс содержимого гранул, они сливаются одна с другой внутри цитоплазмы (указано стрелками), х 5000. По Zucker-Franklin D., Greaves M.F., Grossi C.E. et al. 1988 Atlas of Blood Cells: Function and Pathology. Vol. II. 2nd edn. Milan: E.E. Ermes, Philadelphia: Lea and Febiger.
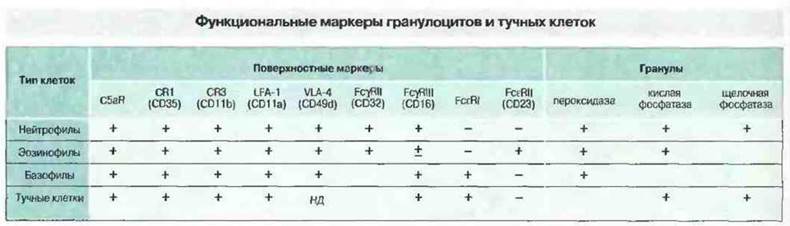
Рис. 2.42. Нейтрофилы, эозинофилы, базофилы и тучные клетки отвечают хемотаксисом на С5а и, следовательно, имеют к нему рецепторы. Все эти клетки обладают также рецепторами к С3 и экспрессируют молекулы межклеточной адгезии - LFA-1 (CD11а) и VLA-4 (CD49d). Кроме того, они экспрессируют FcγRII (CD32) и FcγRIII (CD16). Из этих клеток только базофилы и тучные клетки имеют высокоаффинный рецептор для IgE (FcεRI). На отдельных гранулоцитах выявляются некоторые другие гликопротеины, в том числе CD13 и CD14 (экспрессируемые слабо). Кроме того, все эти клетки несут гликолипидные молекулы, такие как гаптен группового антигена крови Льюис X (CD15) и лактозилцерамид (CD17). Гранулы клеток разных типов различаются по составу ферментов. НД - нет данных.
Тромбоциты (кровяные пластинки)
Тромбоциты, кроме свертывания крови, участвуют также в иммунном ответе, в частности воспалительных реакциях. Они образуются из костномозговых мегакариоцигов и содержат гранулы (рис. 2.43). У взрослого человека ежесуточно появляются 1011 новых тромбоцитов; в среднем 30% этих клеток депонируются в селезенке. Тромбоциты экспрессируют белки МНС класса 1, рецепторы дли IgG (FcγRII; CD32) и низкоаффинные рецепторы для IgE (FcεRII; CD23). Кроме того, мегакариоциты и тромбоциты несут рецепторы для фактора VIII свертывании крови и другие функционально важные молекулы, такие как комплекс GpIIb/IIIa (CD41) и комплекс GpIb/GpIx (CD42). Первый из них - это цитоадгезин, ответственный за связывание с фибриногеном, фибронектином и витронектином. Оба эти комплекса представляют собой еще и рецепторы для фактора Виллебранда. Имеется также дополнительный рецептор к витронектину, CD51. И рецепторы, и молекулы адгезии важны для активации тромбоцитов. В случае повреждения эндотелия они прилипают к субэпителиальной поверхности поврежденной сосудистой стенки, образуя агрегаты. При этом из тромбоцитарных гранул двух типов высвобождается их содержимое, в том числе серотонин и фибриноген, что приводит к повышению проницаемости капилляров, активации комплемента и, вследствие этого, к привлечению лейкоцитов.
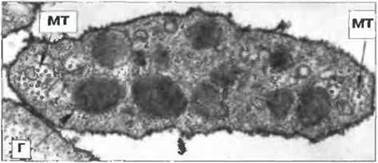
Рис. 2.43. Ультраструктура тромбоцита. На срезе кровяной пластинки видны два типа гранул (Г) и пучки микротрубочек (МТ) на полюсах, х 42 000. По Zucker- Franklin D., Greaves M.F., Grossi C.E. et al. 1988. Atlas of Blood Cells: Function and Pathology. Vol. II. 2nd edn. Milan: E.E. Ermes, Philadelphia: Lea and Febiger.
Вопросы для размышления
■ Какие существуют функциональные субпопуляции Т-лимфоцитов и чем они различаются?
■ Почему необходимо такое множество различных клеток, участвующих в иммунном ответе?
■ Какие молекулы используются лимфоцитами а) в качестве антигенсвязывающих рецепторов и б) для взаимодействия между собой и другими клетками? Как называются различные семейства этих молекул?
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Levy О. Antibiotic proteins of polymorphonuclear leukocytes. Eur. J. Haematol. 56: 263-77, 1996.
Moller G. (ed.). Accessory molecules in the immune response. Immunol. Rev. 153: 1996.
Peters J.H., Gieseler R., Thiele B., Steinbach F. Dendritic cells: from ontogenetic orphans to myelomonocytic descendants. Immunol. Today 17: 273-8, 1996.
Playfair J.H.L. Immunology at a glance, 6th edn. Oxford: Blackwell Scientific Publications 1996.
Razin E., Pecht I., Rivera J. Signal transduction in the activation of mast cells and basophils. Immunology Today 16: 370-3, 1995.
Reth M. The В-cell antigen receptor complex and coreceptors. Immunol. Today 16: 310-13, 1995.
Roitt I.M. Essential Immunology, 9th ednd. Oxford: Blackwell Scientific Publications, 1997.
Romagnani S. Lymphokine production by human T cells in disease states Annu. Rev. Immunol. 12: 227-57, 1994.
Wardlaw A.J., Moqbel R., Kay A.B. Eosinophils: biology and role in disease. Adv. Immunol. 60:151-266, 1995.