ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 15. Эволюция иммунной системы
ИММУНИТЕТ У ПОЗВОНОЧНЫХ
По сравнению с огромным разнообразием форм беспозвоночных организация позвоночных по общему плану довольно единообразна и все они принадлежат к одному типу хордовых. Хотя эволюционное древо позвоночных имеет многочисленные уровни и ветви, в том числе бесчелюстных, хрящевых рыб, костных рыб, амфибий, рептилий, птиц и млекопитающих, основные клеточные и молекулярные компоненты врожденного иммунитета у всех современных челюстноротых удивительно консервативны. Однако усложнению строения тела соответствует возрастание специализации лимфоидной ткани и функций лимфоцитов, а также увеличение разнообразия классов иммуноглобулинов. Самой сложной по структуре и функциям иммунной системой обладают млекопитающие.
Т-клетки и эволюция МНС
Цитотоксические и хелперпые Т-лимфоциты (Тц и Тх соответственно) млекопитающих, несущие αβ-Т-клеточные рецепторы (ТкР), распознают большинство чужеродных антигенов только в том случае, если они презентированы в нужной форме собственными полиморфными молекулами МНС. Поэтому филогенез некоторых Т-клеточных популяций [например, Тц и лимфоцитов, участвующих в реакции смешанной культуры лейкоцитов (СКЛ)] и эволюцию МНС следует рассмотреть вместе (рис. 15.14).
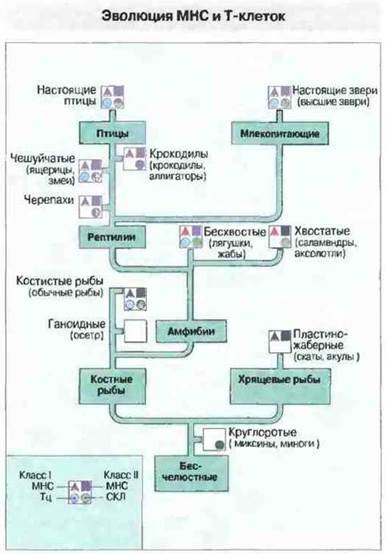
Рис. 15.14. Это филогенетическое древо позвоночных иллюстрирует некоторые стороны эволюции МНС и Т-клеток. Показаны два функциональных критерия существования МНС (наличие цитотоксических Т-лимфоцитов (Тц) и реакции смешанной культуры лейкоцитов (CKЛ), а также биохимические и молекулярно-биологические данные, свидетельствующие об экспрессии белков и генов МНС классов I и II. Пустой квадрат означает недостаточность имеющихся данных.
Функциональные критерии и/или молекулярные и генетические данные докалывают присутствие МНС у всех челюстноротых позвоночных, от хрящевых рыб и выше. [Функциональные критерии состоят в том, что СКЛ и быстрое отторжение аллотрансплантата регулируются одной полиморфной генной областью, и что такие феномены, как кооперация Т- и В-клеток, возникновение антигенспецифичных цитотоксических реакций (например, на аллогенные клетки), и «обучение» Т-клеток в тимусе, находятся под контролем МНС.]
МНС подробно изучен у пойкипотермных позвоночных Xenopus. Недавно проведенные исследования позволили обнаружить гены МНС у хрящевых рыб, чьи предки дивергировали от линии развития других позвоночных более 400 млн. лет назад. Однако наиболее полно гены и белки МНС изучены среди пойкилотермных у шпорцевой лягушки Xenopus laevis. На рис. 15.15 показано строение ее МНС (XLA) в сравнении с МНС птиц (В-локус) и мыши (локус Н-2).
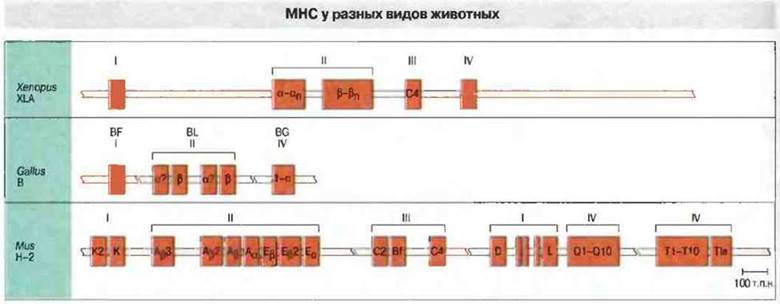
Рис. 15.15. МНС можно обнаружить у всех челюстноротых позвоночных. Показана предположительная организация локусов МНС у шпорцевой лягушки (Xenopus) и курицы (Gallus). Структура мышиного комплекса Н-2 (Mus) полностью установлена. Расстояния между генами у Xenopus и Callus показаны произвольно. (Схема любезно предоставлена д-ром L. Du Pasquier.)
Классические антигены МНС (Iа) у Xenopus. Белки класса Iа у Xenopus полиморфны и кодируются примерно 20 аллелями. Они присутствуют на поверхности всех зрелых клеток, но в наибольшей степени — на гемопоэтических клетках. α-Цепи этих белков имеют молекулярную массу 40-44 кДа; они образуют 3 домена и нековалентно связаны с β2-микроглобулнном. Белки МНС класса I у Xenopus необычны в том отношении, что кодируются одним генным локусом (в отличие от трех у человека и двух у мыши).
Неклассические антигены МНС (Ib) у Xenopus. Срели генов класса I у Xenopus первым было идентифицировано большое семейство мономорфных неклассических (класс I) МНС-подобных молекул Гены, кодирующие эти молекулы, и классические МНС-гены (Iа) расположены в разных хромосомах. Ген класса Ib, по-видимому, кодирует молекулу, гомологичную белок-связываюшим участкам белков теплового шока 70 (БТШ 70). Недавно предложена гипотеза, согласно которой пептид-связывающая область молекул МНС класса I сформировалась в процессе эволюции из предсуществовавших БТШ. (БТШ — это обнаруживаемые у всех организмов эволюционно консервативные молекулы, которые действуют как «шепероны» — компаньоны-помощники, участвуя в пространственной укладке и внутриклеточном транспорте белков.) Неклассические МНС-подобные белки, ассоциированные с эпителием, обнаружены у всех изученных позвоночных; предполагается, что они могут обладать различными функциями, например распознавать БТШ патогенных организмов или инфицированных/угнетенных собственных клеток и затем презентировать эти консервативные пептиды Т- клеткам с рестриктированными ТкР.
Антигены МНС класса II у Xenopus. Молекулы МНС класса II у Xenopus полиморфны (кодируются примерно 30 аллелями) и конститутивно экспрессированы лишь на некоторых зрелых клетках, в том числе на тимоцитах, В- и Т-лимфоцитах и различных АПК, таких как клетки, сходные с клетками Лангерганса кожного эпидермиса (рис. 15.16). Белки класса II состоят из кодируемых генами МНС о- и p-цепей; обе цепи представляют собой трансмембранные гликопротеины с молекулярной массой 30-35 кДа. Гены [3- цепей молекул МНС класса II у Xenopus кодируют полипептиды, имеющие почти 50 % гомологию с Р-цепями МНС класса II млекопитающих. При синтезе белки МНС класса II временно связаны с инвариантной цепью. У Xenopus (как и у человека) имеются три локуса β-генов МНС класса II.
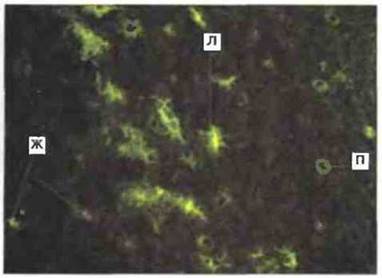
Рис. 15.16. Иммунофлуоресценция дендритных клеток Xenopus, несущих на поверхности молекулы МНС класса II. АПК, сходные с клетками Лангерганса (Л), часто встречаются в базальном эпидермальном слое кожи. Видны также положительные по классу II клетки протоков кожных желез, проходящих через эпидермис (П), и кожные железы, расположенные под эпидермисом (Ж), х 100.
Экспрессия МНС у Xenopus на каждой стадии жизненного цикла различна. Интересная особенность экспрессии МНС в онтогенезе у Xenopus заключается в том, что до стадии метаморфоза классические молекулы МНС класса I не экспрессируются на поверхности каких-либо клеток Напротив, молекулы класса II появляются уже на ранней стадии развития головастиков на В-клетках и некоторых эпителиальных клетках, непосредственно контактирующих с внешней средой. Это свидетельствует о том, что экспрессия классических молекул класса I не является необходимой для ранних стадий развития или для функционирования иммунной системы на стадии головастиков. Не исключено, однако, что важную роль в иммунитете головастиков играют неклассические белки класса I. На этой стадии онтогенеза основное значение, возможно, имеет клеточный иммунитет, рестриктированный по молекулам МНС класса II. Более широкое представительство молекул МНС класса II у головастиков по сравнению со зрелыми лягушками указывает на то, что на низших ступенях эволюции, в более примитивной иммунной системе, именно эти молекулы, возможно, несли функцию презентации антигенов.
МНС у других позвоночных. Белки МНС классов I и II и полиморфные гены класса II недавно обнаружены у хрящевых рыб. Среди костистых рыб генами МНС класса I и β2-микроглобулина обладает, как установлено, радужная форель и генами МНС класса II — карп.
Аксолотли, для которых характерны относительно слабые Т-клеточные реакции на аллоантигены, обладают α- и β-цепями молекул МНС класса II с ограниченным полиморфизмом. Эти земноводные экспрессируют также кодируемые МНС эритроцитарные антигены, сходные с α-цепями (44 кДа) класса I и с полиморфными молекулами класса IV, присутствующими на ядерных эритроцитах курицы. Они могут присутствовать также у Xenopus. α-Цепи класса I и гетеродимерные молекулы класса II найдены и у различных пресмыкающихся.
У различных позвоночных фенотипически и функционально идентифицированы Т-клетки. У птиц найдены αβ- и γδ-ТкР в комплексе с корецепторными молекулами CD3, CD4 и CD8. В настоящее время появляются данные о наличии некоторых из этих рецепторов или составляющих их цепей у рыб и амфибий. Например, гены из тимоцитов и сплепоцитов мексиканского аксолотля обнаруживают значительную гомологию с генами β-цепей ТкР птиц и млекопитающих. На поверхности тимоцитов и лимфоидных клеток опухоли тимуса у Xenopus присутствует белок 55 кДа, сходный по аминокислотной последовательности с δ-цепью ТкР. С помощью полученных в настоящее время моноклональных антител аити-Xenopus обнаруживаются маркеры, возможно соответствующие CD5 (71-88 кДа, экспрессия на всех Т-клетках) и CD8 (35 кДа, экспрессия на цитотоксических Т-клетках). У радужной форели недавно выявлены генные сегменты, кодирующие β-цепи ТкР, однако получить моноклональные антитела, специфичные по отношению к Т-клеткам рыб, пока не удалось. У хрящевых рыб найдены четыре различных типа генов Т-клеточных рецепторов. Клеточная и молекулярная основа реакции СКЛ, наблюдающейся у миксин, пока не расшифрована.
Важнейшее значение для иммунных реакций у пойкилотермных животных имеет температура. У сома низкая температура тормозит пролиферацию Т (но не В-) клеток. Эти эффекты обусловлены низким содержанием некоторых ненасыщенных жирных кислот (например, олеиновой) в Т-клетках рыб и связанной с этим текучестью мембран. Поэтому корм с высоким содержанием соответствующих жирных кислот может способствовать лучшей адаптации рыб к низкой температуре. Олеиновая кислота снимает также наблюдаемую при низких температурах супрессию реакций Т-клеток млекопитающих in vitro (природа термочувствительных процессов точно не установлена).
Эволюция В-клеток и иммуноглобулинов
Тяжелые и легкие цепи иммуноглобулинов имеются у различных позвоночных. Обнаруженные у миксин белки, ранее считавшиеся антителами, в настоящее время идентифицированы как белки комплемента С3-С5. Пока у круглоротых (миксин и миног) не удалось выявить молекул, принадлежащих к суперсемейству иммуноглобулинов.
Все челюстноротыe позвоночные вырабатывают антитела к широкому кругу антигенов. Однако антитела, вырабатываемые пойкилотермными позвоночными, характеризуются низкой аффинностью и слабой иммунологической памятью по сравнению с ан тителами у гомойотермных позвоночных. Структура антител эволюционно консервативна; у всех животных эти белки состоят из мультидоменных тяжелых и легких полипептидных иммуноглобулиновых цепей (см. гл. 6), которые могут экспрессироваться на поверхности В-клеток, играя роль рецепторов, или секретироваться активированными B-клетками в кровь.
У всех челюстноротых позвоночных присутствует полимерный IgM (рис. 15.17), а у рыб антитела принадлежат в основном к этому классу. Каждая тяжелая μ-цепь состоит из четырех константных и одного вариабельною доменов; тяжелые и легкие цепи связаны дисульфидными мостиками. Семейство μ-цепей обнаруживает в филогенезе значительное разнообразие; например, между μ-цепями сома и мыши имеется лишь 24 % гомология по аминокислотной последовательности.
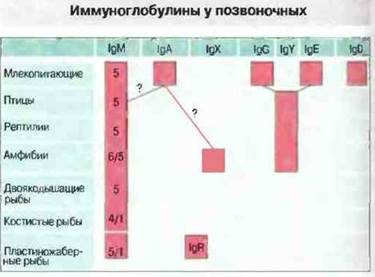
Рис. 15.17. Распределение и возможное родство иммуноглобулинов у позвоночных. Полимерный IgM найден у всех челюстноротых позвоночных, но, как показано на рисунке, с разным числом основных единиц (состоящих из 2 тяжелых + 2 легких цепей). Мономерный IgM присутствует также в крови хрящевых (пластиножаберных) и костистых рыб. У представителей разных групп обнаружены тяжелые цепи, не относящиеся к μ-изотипу, но роль иммуноглобулинов этих изотипов часто остается неизвестной. (Таблица любезно предоставлена д-ром G. Warr.)
У некоторых хрящевых рыб, таких как скаты и акулы, обнаружены низкомолекулярные антитела без μ-цепей (см. рис. 15.17), но эволюционная связь IgR с другими изотипами Н-цепей остается неясной. У амфибий, рептилий и птиц имеется состоящий из четырех константных доменов изо- тип тяжелых цепей, получивший обозначение IgY. Предположительно он является предшественником IgG и IgE млеко питающих, с которыми имеет структурное и функциональное сходство. У аксолотля IgY может быть и секреторным иммуноглобулином, так как в кишечнике он связан с молекулами, сходными с секреторными. Интересно, что несмотря на отсутствие у рыб IgE, костистые рыбы демонстрируют реакции гиперчувствительности I типа; возможно, у них имеются связанные с тканями гомоцитотропные антитела. У Xenopus изотип IgX, продукция которого в отличие от IgY является тимус-независимой, может быть эквивалентом секреторного IgAмлекопитающих, поскольку этот изотип присутствует в основном в кишечнике. Изотип IgA, возможно, впервые появляется у птиц.
Для многих пойкилотермных характерно и разнообразие легких цепей. Два антигенно различных типа легких цепей, один из которых сходен с k-цепью, обнаружены у Xenopus и два — у сома, черепахи и аллигатора. У акул имеются как k-, так и λ-цепи; это свидетельствует, что дивергенция предковых легких цепей произошла до этапа хрящевых рыб.
Усатая акула-нянька, как недавно установлено, обладает ранее неизвестной молекулой иммуноглобулинового суперсeмейства, которая, возможно, эволюционно предшествовала появлению иммуноглобулинов и ТкР. Эта молекула (получившая название нового антигенного рецептора. НАР, англ. — NAR) состоит из одного вариабельного и пяти константных доменов и присутствует в сыворотке в виде димера. Кодирует НАР генный локус, который подвергается перестройке и соматическому мутированию. В настоящее время у хрящевых рыб выявлен новый класс химерных антител; это позволяет усомниться в том, что первичным изотипом Ig является IgM.
У низших позвоночных обнаружены четыре типа организации генов иммуноглобулинов. Активные исследования локуса иммуноглобулиновых генов у пойкилотермных позвоночных с помощью технологии рекомбинантной ДНК позволили в последние годы обнаружить четыре типа его организации.
Амфибии и костистые рыбы. У этих животных локус IgH организован по тому же типу, что и у млекопитающих («транслокон»). У Xenopus, например, имеется 80-100 сегментов Vн, 15 — Dн и 9 - Jн (рис. 15.18). Обнаружены как структурные области, так и области, определяющие комплементарность. Константные области каждой цепи (IgM, IgX, IgY) у Xenopus кодируются четырьмя экзонами Сн. Легкие цепи кодируются двумя разными хромосомами, каждая с сегментами Vl, Jl и Cl. У костистых рыб гены легких цепей иммуноглобулинов обнаруживают «мультикластeрную» организацию, типичным примером которой служит их организация у акул (см. ниже).
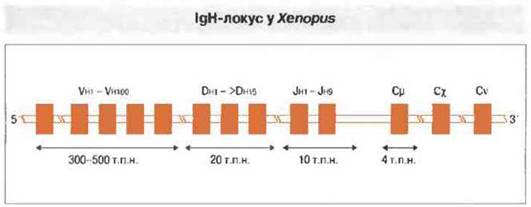
Рис. 15.18. Строение локуса IgH у Xenopus сходно с его строением у костистых рыб и отчасти млекопитающих. Ко всем генным сегментам примыкают рекомбинационные сигнальные последовательности. Вначале D-сегменты соединяются с Jh, затем к D-J присоединяются гены Vh. Наконец, перестроенные гены V-D-J соединяются с геном константной области, образуя гены IgM, IgX или IgY. (По данным д-ра L. DuPasquier.)
В процессе созревания В-клеток у Xenopus, как и у млекопитающих, происходят множественные перестройки иммуноглобулиновых генов; существует и аллельное исключение, приводящее к появлению моноспецифичных В-лимфоцитов. У Xenopus найдены активированные рекомбиназой гены (участвующие в перестройке иммуноглобулиновых генов), но разнообразие антител (V-области) при этом весьма незначительно; у взрослых особей имеется всего примерно 5 · 105 различных молекул антител. Ограниченное созревание аффинности после активации В-клеток у Xenopus (и других пойкилотермных), по-видимому, не связано с отсутствием соматического мутирования иммуноглобулиновых генов. Скорее это можно связать с неэффективной селекцией мутантов из-за отсутствия в лимфоидных органах холоднокровных соответствующих центров размножения. Лимфоузлы с центрами размножения найдены лишь у птиц и млекопитающих. Хотя у головастиков Xenopus имеются те же три изотипа Ig, какие присутствуют у зрелых особей, репертуар антител у тех и других различен. На репертуар Ig у зрелых особей влияют генные перестройки, происходящие при новой волне созревания В-клеток после метаморфоза. Третья гипервариабельная область у зрелых особей приобретает дополнительное разнообразие вследствие случайного добавления N-концевых остатков, тогда как у головастиков этого не происходит.
Возникновение разнообразия антител у птиц. В данном случае оно связано с иным типом организации иммуноглобулиновых генов и происходит в характерном только для птиц месте - в расположенной у клоаки фабрициевой сумке (рис. 15.19). В локусе легких цепей у курицы имеется один V-ген, который вначале перестраивается и соединяется с одним комплексом J-С (рис. 15.20). Локус IgH содержит также область множественных D-генов. Перестройка происходит в течение лишь ограниченного периода раннего развития, когда стволовые клетки колонизируют фабрициеву сумку; в отличие от этого у мыши и человека перестройка иммуноглобулиновых генов в пре-В-клетках происходит в течение всей жизни организма. Затем сегменты (длиной 10-120 п.н.) перестроенных иммуноглобулиновых генов замешаются у курицы нуклеотидными последовательностями из псевдогенов, примыкающих к единственному V-гену. Генные конверсии происходят с высокой частотой (как и у кролика) в течение всего срока пролиферации В-клеток в сумке.
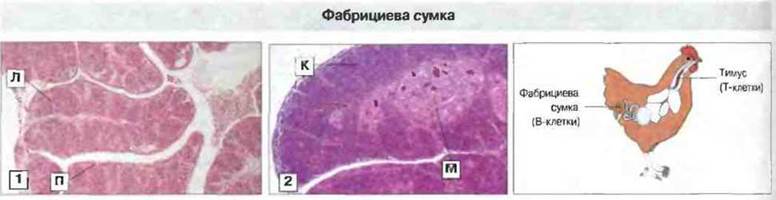
Рис. 15.19. Два основных органа иммунной системы у птиц - это тимус (2) и фабрициева сумка (1). Лимфоциты, развивающиеся в тимусе, называются Т-клетками, а те, которые развиваются в фабрициевой сумке, B-клетками. В сумке отмечены лимфоидные фолликулы (Л) и просвет протока (П), а в тимусе - корковая (К) и мозговая (М) зоны. Окраска гематоксилином-эозином. х 20.
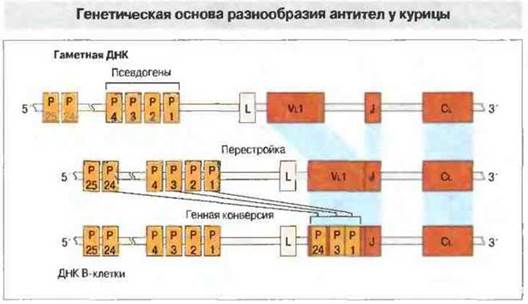
Рис. 15.20. Гаметный локус легких цепей иммуноглобулинов у курицы имеет длину менее 30 т.п.н. ДНК. Единственный функциональный V-ген (Vl) расположен на 2 т.п.н. выше от единственного элемента J-C; к нему примыкает кластер из 25 псевдогенов (Р) длиной 19 т.п.н. Перестройка происходит в течение короткого срока на ранней стадии развития В-клеток. Разнообразие антител обеспечивается генной конверсией между Р и перестроенной последовательностью. Показанная перестройка (Р1, Р2 и Р24) лишь иллюстрирует процесс; в преобразованном V-генном сегменте псевдогены необязательно располагаются именно в таком порядке.
Третий тип организации генных локусов Ig обнаружен у хрящевых рыб. В этом случае тяжелая (μ) и легкие (λ- и k-подобные) цепи иммуноглобулинов кодируются многочисленными мелкими отдельными кластерами (кассетами) (рис. 15.21), включающими все V- (D-), J- и С-гены. Каждый кластер иммуноглобулиновых генов по последовательности ДНК отличается от других. Эти последовательности имеют гаметную конфигурацию (гены зародышевой линии). Антитела акул обладают, по-видимому, чрезвычайно разнообразным (многомиллионным) репертуаром связывающих специфичностей, но, поскольку разнообразие закодировано в гаметной ДНК, а не обусловлено соматическими механизмами, между особями различия в иммуноглобулинах отсутствуют. Таким образом, формирование разнообразия иммуноглобулинов за счет перестройки соматических генов (какое имеет место у костистых рыб, амфибий, птиц и млекопитающих) характерно не дня всех позвоночных. У хрящевых рыб присутствует большое количество врожденных антител против разнообразных антигенов: эти антитела аналогичны полиспецифичным (часто аутореактивным) IgM-антителам млекопитающих, которые в онтогенезе секретируются В-клетками CD5+. Неизвестно, может ли имеющаяся у акул кластерная организация субъединиц иммуноглобулиновых генов обусловливать клональную рестрикцию В-клеток. Однако уровень специфических антител у них может возрастать и без общего повышения содержания Ig в сыворотке, что указывает на существование клональной селекции.
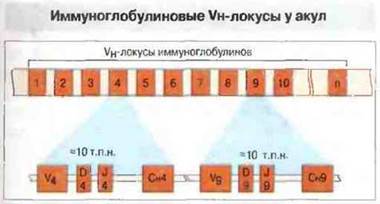
Рис. 15.21. У акул имеется примерно 200 кластеров генов тяжелых цепей, каждый из которых содержит по одному генному сегменту V. D, J и С. Четвертый и девятый кластеры показаны в развернутом виде. Сегменты Vн, Dн и Jн тесно связаны и занимают участок длиной примерно 1,3 т.п.н. Вместе с сегментом Сн они занимают участок всего около 10-15 т.п.н. Расположение генов в кластере соответствует, по-видимому, гаметному и не зависит от механизмов соматической перестройки, чем может объясняться отсутствие у этого вида различий в иммунных реакциях между особями. (По данным д-ров J. Marchalonisn G. Litman.)
Предварительные данные говорят о том, что у целокантов — эволюционных «реликтов», найденных в живом состоянии в Индийском океане, может присутствовать новый локус IgH (кластеры V—D-генов, распределенные подлине хромосомы).
Клетки системы врожденного иммунитета
У большинства позвоночных присутствуют нормальные клетки-киллеры (НК). У млекопитающих НК представлены популяцией больших гранулярных лимфоцитов, отличающихся от Т- и В-клеток. В отличие от Тц они способны спонтанно лизировать трансформированные клетки, не экспрессирующие антигены МНС. НК-подобные лимфоидные клетки обнаружены и у некоторых низших позвоночных, включая птиц, рептилий, амфибий и костистых рыб. Более того, неспецифические цитотоксические клетки недавно выявлены даже у протохордовых; они оказались способными уничтожать опухолевые клетки млекопитающих. Установлено, что макрофаги как хрящевых, так и костных рыб обладают спонтанной цитотоксичностью, и доказано существование у акул антителозависимых клеточных цитотоксических (АЗКЦ) реакций.
Моноклональные антитела против НK-подобных клеток сома модулируют цитотоксическое действие НК рыб и человека в отношении линий трансформированных клеток человека. Это свидетельствует об эволюционной консервативности соответствующих рецепторов к антигенам. У курицы обнаружены клетки, цитотоксический эффект которых не рестриктирован по МНС; возможно, они представляют собой НК. Эти клетки сходны с НК млекопитающих тем, что содержат в цитоплазме CD3. не имеют на поверхности комплекса ТкР—CD3 и часто экспрессируют CD8. Такие особенности указывают на близкое родство НК- и Т-клеток. Однако и у млекопитающих и у птиц НК имеют внетимусное происхождение.
Фагоцитарная активность у рыб. Проблема устойчивости рыб к болезням имеет особое значение для рыбного хозяйства. В связи с этим подробно изучаются факторы, способные усиливать фагоцитарную активность у рыб. Для их поиска важна разработка методов длительного культивирования лейкоцитов рыб, например сома и карпа, in vitro. Повышения активности фагоцитов рыб по отношению к бактериальным антигенам (возможно, вследствие высвобождения факторов, активирующих макрофаги) можно легко добиться путем введения убитых клеток патогенных микробов и их продуктов. Для повышения связанного с фагоцитами иммунитета у рыб применяются и β-глюканы (полисахариды клеточной оболочки дрожжей и других грибов); они оказались хорошими адъювантами для вакцин, хотя механизм их действия еще не выяснен. Цитокины, например продуцируемый Т-клетками рыб «гамма-интерферон» и ФНОα человека, синергично усиливают дыхательную активность макрофагов радужной форели, приводя к продукции токсичных для бактерий метаболитов кислорода (супероксид-аниона и пероксида водорода). Активацию макрофагов рыб может блокировать ТФРβ млекопитающих. У рыб обнаружены хемокин-подобные факторы, способные влиять на подвижность макрофагов. Поскольку при искусственном разведении рыб может возникать проблема иммуносупрессии, вызванной стрессом, представляет интерес недавно описанная способность иммуноактивного пептида FK-565 блокировать такую супрессию.
В различных воспалительных процессах у млекопитающих, как правило, принимают участие лейкотриены и другие липидные медиаторы (носящие общее название эйкозаноидов). К настоящему времени установлено, что эйкозаноиды синтезируются и у рыб (а также у амфибий) и выполняют у них важную функцию в воспалительных реакциях. Например, лейкотриен В4усиливает миграцию лейкоцитов радужной форели; эйкозаноиды влияют и на пролиферацию Т-клеток этих рыб. На синтез эйкозаноидов у рыб может влиять содержание липидов в корме, и важно оптимально подбирать его при разработке методик вакцинации; этот вопрос активно изучается в настоящее время.
Не специфичные к антигенам молекулы
У позвоночных хорошо развиты классический и альтернативный пути активации комплемента. Бесчелюстные обладают антителонезависимыми комплемент-подобными белками. У миксин они гомологичны компонентам С3, С4 и С5 комплемента млекопитающих и действуют как опсонины; на фагоцитарных лейкоцитах обнаружен специфичный к ним рецептор (105 кДа). У представителей всех других классов позвоночных имеются как классический, так и альтернативный механизмы активации комплемента (у хрящевых рыб существование альтернативного пути не доказано).
У карпа обнаружены компоненты комплемента С1-С9, а также факторы В и D. Установлена значительная гомология генов С3 у Xenopus и млекопитающих. У бесхвостых амфибий охарактеризованы также компоненты комплемента C1q, С4, С5, лизирующий мембрану комплекс и фактор В. Компоненты комплемента рыб и амфибий обладают теми же основными свойствами (термолабильность и необходимость ионов Са2+ и Mg2+ дли активации), что и соответствующие белки млекопитающих. Разумеется, температурный диапазон для активности комплемента у пойкилотермных животных значительно шире; она сохраняется и при 4 °С. В то же время и тепловая инактивация может происходить при более низкой температуре. У Xenopus, например, активность комплемента полностью исчезает через 40 мин инкубации при 45 °С. Для определения антител зрелых амфибий по гемолизу in vitro можно использовать комплемент морской свинки. Для большинства же рыб, а также головастиков подходит комплемент только от тех же или от близких видов.
У низших позвоночных имеются цитокины, функционально сходные с цитокинами млекопитающих. Изучение цитокинов и особенно их рецепторов у низших позвоночных существенно отстает от успешных молекулярных исследований в области эволюции иммуноглобулинов, ТкР и МНС. Однако биологическими методами установлено, что определенные группы цитокинов присутствуют у многих классов позвоночных. К таким цитокинам относятся интерлейкины, интерфероны, фактор некроза опухолей, колониестимулирующие факторы и хемокины.
Например, из супернатантов культур стимулированных Т-лимфоцитов костных рыб, хвостатых и бесхвостых амфибий, змей и курицы выделены факторы роста Т-клеток (ФРТк), стимулирующие пролиферацию Т-лимфобластов in vitro (рис. 15.22). Очищенный ФРТк Xenopus представляет собой белок с молекулярной массой 16 кДа, обладающий биохимическим и функциональным сходством с ИЛ-2 млекопитающих. Ген этого «ИЛ-2» и его рецепторы пока неизвестны.
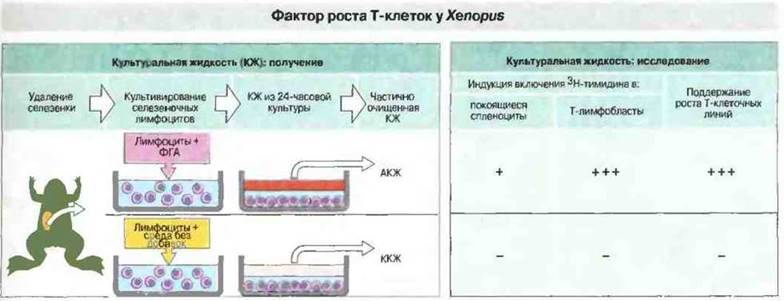
Рис. 15.22. Обладающую активностью культуральную жидкость (АКЖ) из культуры стимулированных ФГА спленоцитов Xenopus сравнивали с культуральной жидкостью контрольных культур (ККЖ) (Оба препарата предварительно подвергали частичной очистке.) АКЖ, очевидно, содержит цитокины, поскольку явно стимулирует пролиферацию Т-лимфобластов (но оказывает меньшее стимулирующее влияние на покоящиеся спленоциты) и способствует росту аллореактивных Т-клеточных линий; ККЖ таких эффектов не оказывает. Аналогичной, хотя и меньшей активностью обладает культуральная жидкость из смешанной культуры лейкоцитов. Активностью фактора роста Т-клеток у Xenopus обладает белок 16 кДа, который, судя по биохимическим и функциональным свойствам, вполне может представлять собой ИЛ-2 амфибий. (Рисунок любезно предоставлен д-ром N. Cohen.)
«ИЛ-2-подобная» активность обнаружена в макрофагах костных рыб, амфибий и птиц. У пойкилотермных позвоночных (например, у искусственно разводимых рыб, популяции которых могут быть полностью уничтожены вирусом) найдены и «интерферон-подобные» факторы, активирующие макрофаги и обладающие антивирусной активностью. Недавно был секвенирован интерферон камбалы, который, однако, мало напоминает какие-либо другие интерфероны. Отсутствие гомологии и может быть причиной того, что с помощью олигонуклеотидных зондов (консервативных последовательностей генов, котирующих цитокины млекопитающих) не всегда удается идентифицировать гены цитокинов у пойкилотермных животных. Это, однако, удалось в отношении фактора роста фибробластов амфибий, TGFβ (TGFβ5 Xenopus, у которых он может ингибировать пролиферацию Т клеток, и TGFβ4 курицы) и ИЛ-2 камбалы. Имеющиеся данные о том, что активацию макрофагов радужной форели под действием ФНОβ человека блокирует их преинкубация с антителами к рецептору ФНО (р55) человека, указывают на эволюционный консерватизм рецепторов к ФНО.
Антимикробные пептиды. Важную функцию в иммунной системе позвоночных выполняют антимикробные пептиды, структурно сходные с описанными выше антимикробными пептидами беспозвоночных. Так, в кишечнике свиней обнаружены цекропины, а в фагоцитах и некоторых клетках кишечника млекопитающих - дефензины, влияющие на рост микробов. Гранулярные железы кожи и кишечника Xenopus секретируют пептиды другого семейства, получившие название магайнинов. Они обладают биоцидной активностью широкого спектра — против грам отрицательных и грамположительных бактерий, грибов и простейших. Кроме того, они оказывают цитотоксическое действие и на клетки различных злокачественных опухолей человека. В настоящее время уже полущены искусственно синтезированные магайнины и рассматривается возможность их использования в качестве лекарственных средств. Еще одним кандидатом на применение в качестве лечебного средства является скваламин — стероид из акул, обладающий обшей антибиотической активностью.