ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 15. Эволюция иммунной системы
ЛИМФОМИЕЛОИДНЫЕ ТКАНИ У НИЗШИХ ПОЗВОНОЧНЫХ
Анатомической основой для взаимодействия иммуноиитов с антигеном служит лимфомиелоидная система, где происходит образование и где хранятся лимфоциты, гранулоциты и другие клетки крови.
Лимфомиелоидные ткани рыб
Миксины лишены как тимуса, так и селезенки. Лимфоциты у этих представителей круглоротых развиваются в лимфоидной ткани в области жаберных щелей или в кишечнике. У других круглоротых, миног, имеется примитивная селезенка и ткань, подобная костному мозгу.
У челюстноротых рыб отсутствуют лимфоидный ряддифференцировки клеток костного мозга, лимфоузлы и лимфоидная ткань, ассоциированная с кишечником ЛТК (рис. 15.23). Однако у них хорошо развит тимус и селезенка, диффузная ЛТК и лимфомиелоидная ткань в почках и печени (рис. 15.24). Важная особенность лимфомиелоидной ткани рыб заключается в том, что в печени «примитивных» форм (а у костистых рыб еще и в селезенке и почках) присутствует множество мелано-макрофагальных центров (рис. 15.25). В этих центрах аккумулируются пигменты, такие как гемосидерин, цероид, меланин и в особо большом количестве липофусцин. Накопление пигментов в «макрофагальных агрегатах» рыб отчасти может быть связано с высоким содержанием у рыб ненасыщенных жирных кислот, благодаря которому сохраняется текучесть мембран при низкой температуре: такие липиды особенно подвержены процессам перекисного окисления и образования липофусцина.
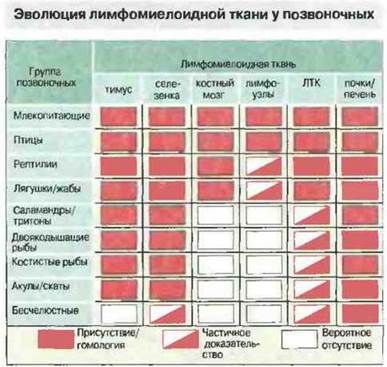
Рис. 15.23. У рыб и амфибий лимфоидная и миелоидная ткани не разделены.
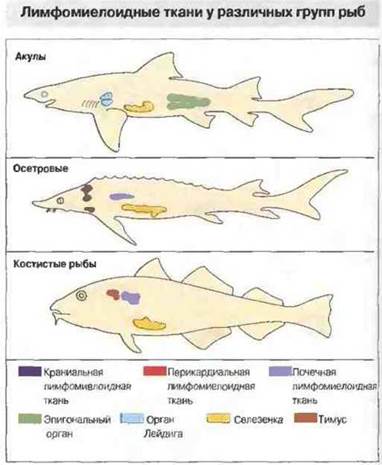
Рис. 15.24. Обратите внимание, что кишечник у акул и осетров также богат лимфомиелоидной тканью. (Рисунок любезно предоставлен д-ром R. Fange.)
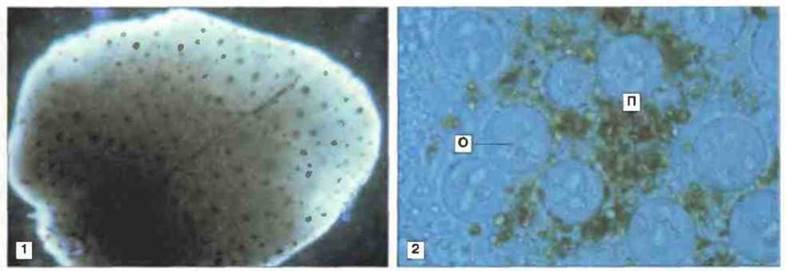
Рис. 15.25. Мелано-макрофагальные центры (ММЦ) в печени рыб. Макро- и микрофотографии печени рыбы (Rivulus marmoratus), зараженной в эксперименте паразитом Calyptospora funduli. Через 60 сут после заражения отчетливо видны ММЦ (1, х 60). В препарате под покровным стеклом (2, х 100) видно, что ММЦ состоят из дегенерирующих ооцитов (О) паразита и прилегающих к ним пигментных частиц (П) хозяина. Основную роль в образовании ММЦ играют моноядерные фагоциты. (Фото любезно предоставлены д-ром W. Vogelbem.)
Лимфомиелоидные ткани амфибий
Тимус. У взрослых особей Xenopus тимус расположен сзади среднего уха, непосредственно под кожей. Как и у большинства других позвоночных, за исключением костистых рыб, он отделяется от глоточного эпителия уже на очень ранних стадиях развития. Тимус дифференцируется на наружную, корковую и внутреннюю (бледнее окрашивающуюся), мозговую зону. Быстро пролиферирующие лимфоциты корковой зоны особенно чувствительны к радиационному воздействию (рис. 15.26). Обработка тимуса Xenopus in vitro глюкокортикоидами ускоряет апоптоз его клеток. У Rаna повышение уровня кортикостероидов in vivo может вызывать атрофию тимуса.
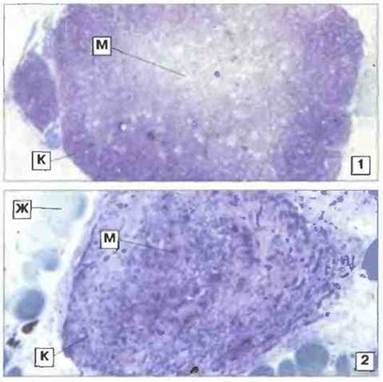
Рис. 15.26. Тимус взрослой особи Xenopus: эффект облучения. В нормальном (1, х 35) тимусе корковая зона (К) содержит множество лимфоидных элементов; бледнее окрашивающаяся мозговая зона (М) заселена лимфоцитами в меньшей степени. Показан результат гамма-облучения тимуса (9 сут после облучения в дозе 300 рад) (2, х 90). Обратите внимание на резкое уменьшение количества лимфоцитов в корковой зоне (К) при сохранении некоторых клеток в мозговой зоне (М). Облученный тимус уменьшается в размерах. Тимус окружен жировой тканью (Ж). Окраска толуидиновым синим.
Убедительно доказано, что у пойкилотермных животных, как и у гомойотермных, тимус продуцирует лимфоциты, обладающие функциями Т-клеток. На рис. 15.27 показана ультраструктура лимфоцитов и соседних эпителиальных клеток тимуса. В тимусе амфибий присутствуют также стромальные клетки других типов, включая крупные дендритные (интердигитатные) клетки, макрофаги, пузырчатые, дегенерирующие клетки и гранулярные клетки. В тимусе рептилий и млекопитающих обнаружены и миоидные клетки (см. рис. 15.27), которые могут способствовать циркуляции тканевой жидкости, а также служить источником факторов, стимулирующих макрофаги. Эпителиальные клетки тимуса, на ранних стадиях развития экспрессирующие антигены МНС класса II, по-видимому, участвуют в «обучении» Т-клеток (см. ниже). В тимусе лягушек присутствуют комплексы из стромальных клеток и заключенных в них тимоцитов, напоминающие клетки-«няни». Эти комплексы могут представлять собой места «обучения» Т-клеток. В тимусе позвоночных различных видов, в том числе амфибий, найдены и В-клетки, хотя этот орган не служит местом их образования. В тимусе лягушек бона обнаружены венулы с высоким эндотелием, которые могут способствовать иммиграции клеток.
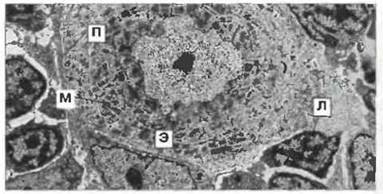
Рис. 15.27. Электронная микрофотография мозговой зоны тимуса головастика Xenopus. Ядро миоидной клетки окружено концентрическими кольцами исчерченных миофибрилл (М) (сходство со скелетными мышцами). Ядерный хроматин мелких лимфоцитов (Л) образует отдельные электроноплотные зоны; цитоплазма бедна органеллами. В ядре эпителиальной клетки (Э) хроматин распределен равномерно и видны ядрышки; цитоплазма обильная и её выросты подобно пальцам (П) проникают между лимфоцитами и клетками других типов, формируя поддерживающую сеть, х 700. (Фото любезно предоставлено д-ром J. Rimmer.)
Селезенка. У всех челюстноротых позвоночных селезенка служит главным периферическим лимфоидным органом. Вместе с «лимфоузлами» и почками она захватывает антиген, удерживает пролиферирующие после стимуляции антигеном лимфоциты, а также высвобождает эти клетки и их продукты в кровь. В селезенке Xenopus имеются тимус-зависимые и независимые лимфоидные зоны (рис 15.28). Фолликулы белой пульпы содержат множество В-клеток (рис. 15.29), что обнаруживается при окрашивании этой области моноклональными антителами к иммуноглобулинам. Селезеночные Т-клетки, присутствующие главным образом в краевой зоне, лишены поверхностных иммуноглобулинов, но связывают анти-Т-клеточные моноклональные антитела (см. рис. 15.29).
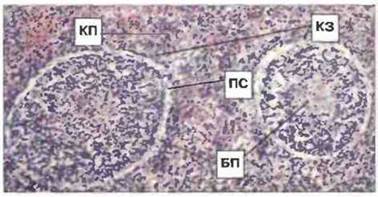
Рис. 15.28. Срез селезенки взрослой особи Xenopus. Видны тимус-зависимые [перифолликулярная красная пульпа, или краевая зона (КЗ)] и тимус-независимые (белая пульпа) области. У Xenopus (в отличие от многих других пойкилотермных животных) белая пульпа (БП) четко отделяется от окружающей красной пульпы (КП) почти не окрашивающимся пограничным слоем клеток (ПС). В красной пульпе также видны скопления лимфоцитов. Окраска гематоксилином-эозином, х 80.

Рис. 15.29. Селезенка взрослой особи Хеnоpus; видны зоны, богатые В- и Т-клетками.
1. Фолликул белой пульпы (БП), содержащий множество В-клеток; эти клетки присутствуют также в краевой зоне (КЗ) и красной пульпе (КП), в основном в виде сильно прокрашивающихся плазматических клеток. Окраска анти-В-клеточными (анти-IgM) мАт, х 100.
2. В краевой зоне, граничащей с фолликулом белой пульпы (БП) видны скопления Т-клеток Их особенно много в перифолликулярной (краевой) зоне (КЗ) и они лишены поверхностных иммуноглобулинов. Окраска антителами анти-Т, х 200.
Кровь поступает в селезенку через центральную артериолу белой пульпы, тесно контактирующую с норадренергическими волокнами симпатической нервной системы. Эти волокна иннервируют селезенку и оказывают иммуномодулирующие эффекты. Капилляры центральной артериолы проникают в краевую зону, окружающую красную пульпу. Их стенки вносят вклад в формирование пограничного слоя. Эксперименты с применением окраски тушью и флуоресцентных антигенов показали, что материал из крови вначале попадает именно в красную пульпу. Позднее циркулирующие антигены захватываются фолликулами белой пульпы и, таким образом, вступают в тесный контакт с потенциальными антителопродуцирующими клетками (рис. 15.30). Антигены удерживаются на поверхности крупных дендритных клеток, отростки которых тянутся в виде псевдоподий через пограничный слой в богатую Т-клетками краевую зону. По общему строению селезенка амфибий подобна селезенке млекопитающих, однако не содержит центров размножения. Селезенка выполняет у амфибий важную роль в созревании В-клеток, как на стадии головастиков (наряду с печенью), так и на стадии зрелых особей, у которых она служит основным местом дифференцировки В-клеток. Удивительно, что В-лимфоциты Xenopusконститутивно не экспрессируют CD5 — маркер, который присутствует на «примитивных», продуцирующих так называемые нормальные антитела В-I-клетках у млекопитающих.

Рис. 15.30. Иммунофлуоресценция селезенки взрослой особи Xenopus, демонстрирующая захват антигена. Лягушке вводили IgG человека. Через 3 нед готовили замороженные срезы селезенки и инкубировали их с меченными флуоресцеином антителами к IgG человека. Яркое зеленое свечение показывает присутствие антигена в фолликулах белой пульпы (БП). Антиген захватывают дендритные клетки, сходные с аналогичными клетками у млекопитающих и птиц, и он появляется на поверхности ретикулярных клеток, х 35.
Лимфомиелоидные узлы. Лимфомиелондные узлы, предположительно сходные по функциям с лимфатическими узлами гомойотермных животных, в эволюции позвоночных впервые появляются у «высокоорганизованных» амфибий, таких как лягушки Rаnа и жабы Bufo, но отсутствуют у хвостатых амфибий и Xenopus. Лимфомиелоидные узлы бесхвостых амфибий отличаются от своих аналогов у млекопитающих тем, что служат в основном фильтрующими кровь органами, хотя могут захватывать материал и из окружающей лимфы. Будучи основным местом локализации антителопродуцирующих клеток, лимфомиелоидные узлы бесхвостых амфибий не имеют четкой структуры, свойственной лимфатическим узлам млекопитающих, и в них отсутствуют центры размножения. У взрослой лягушки «лимфоузлы» расположены на шее и в подмышечной области; лимфатические железы головастиков имеют аналогичное строение (рис. 15.31).
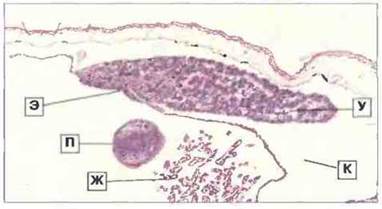
Рис. 15.31. Срез лимфатической железы головастика Rana. Удлиненный (парный) лимфомиелоидный узел (У) с вентральной стороны прикреплен к эпителию (Э) жаберной камеры и выступает в просвет крупного лимфатического канала (К). В середине видны жабры (Ж) и палец (П) передней конечности, лежащий в жаберной камере; сверху - кожа головастика. Лимфатическая железа состоит из лимфоидной паренхимы с фагоцитами и пронизывающими ее синусоидами (бледноокрашенные участки). Она является в основном кровофильтрующим органом. Окраска гематоксилином-эозином, х 25.
Лимфоидная ткань, ассоциированная с кишечником. По всей длине тонкой кишки у амфибий выявляются узлы ассоциированной с кишечником лимфоидной ткани, аналогичной этой системе у млекопитающих. У Xenopus ЛТК содержит плазматические клетки, секретируюшие IgM и IgX. Иммуногистохимический анализ с окраской анти-Т-клеточными моноклональными антителами обнаруживает как узловые скопления Т-клеток (собственная пластинка слизистой), так и внутриэпителиальные Т-клетки в кишечнике Xenopus (рис. 15.32).

Рис. 15.32. Криостатный срез тонкой кишки Xenopus, окрашенный с использованием моноклональных антител анти-СР5 (общий маркер всех Т-клеток) (иммунопероксидазный метод). Видны внутриэпителиальные Т-клетки (Т) и узловое скопление Т-клеток (У) в собственной пластинке слизистой, а также просвет кишки (К). У особей, тимэктомированных на ранней стадии развития, Т-клетки в обоих этих местах отсутствуют, х 300.
Почки и печень. У амфибий, как и у рыб, основным лимфомиелоидным органом служат почки (рис. 15.33), но у рептилий, птиц и млекопитающих они теряют эту функцию. У бесхвостых амфибий созревание В-клеток в онтогенезе начинается в почках и/или печени. Эти органы непосредственно участвуют в процессах ранней дифференцировки эритроидных, лимфоидных и миелоидных клеток у разных позвоночных.
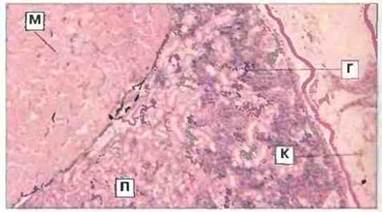
Рис. 15.33. Срез почки головастика Rаnа с участком гемопоэтической ткани. Гемопоэтическая ткань (Г) заполняет межканальцевые пространства и содержит лимфоциты, гранулоциты и другие созревающие клетки крови. С мезонефросом соседствуют миотомальная мышца (М) и петля кишечника (К). Окраска гематоксилином-эозином, х 25. (П - почечный каналец.)
Костный мозг. У амфибий имеется костный мозг, но его иммунологическая роль остается неясной. У взрослой особи леопардовой лягушки Rana pipiens легко обнаруживается костномозговая лимфомпелоидная ткань (рис. 15.34), которая служит важным источником антитело-продуцирующих клеток. Вместе с тем у Xenopus костный мозг, по-видимому, более рудиментарен и главным образом служит местом дифференцировки нейтрофильных гранулоцитов (рис. 15.34).
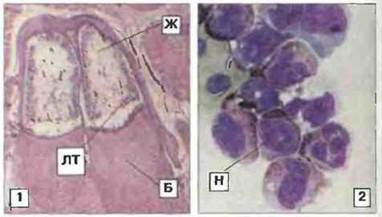
Рис. 15.34. Костный мозг. 1. Лимфомиелоидная ткань (ЛТ), важный источник антителопродуцирующих клеток, в костном мозге Rana. Видны также бедренная кость (Б) и жировая ткань (Ж). Окраска гематоксилином-эозином, х 20. 2. Препарат костного мозга Xenopus после центрифугирования; видны содержащие пероксидазу нейтрофильные гранулоциты (Н), х 700. (Препарат любезно предоставлен д-ром I. Hadji-Azimi.)