ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 15. Эволюция иммунной системы
АМФИБИИ КАК МОДЕЛЬ ДЛЯ ИЗУЧЕНИЯ ОНТОГЕНЕЗА ИММУНИТЕТА
В последние голы для иммунологических исследований было получено несколько изогенных и инбредных клонов Xenopus. Различные клоны Xenopus, либо совместимые по МНС, либо обладающие одним или двумя различиями по гаплотипу, оказались чрезвычайно ценными для изучения онтогенеза иммунной системы.
Развитие тимуса
Развитие тимуса и эксперименты по тимэктомии. Шпорцевая лягушка X. laevis идеально подходит для изучения роли тимуса в развитии иммунной системы, так как у свободноживущих головастиков можно производить тимэктомию на очень ранних стадиях развития, когда тимус еще не созрел (рис. 15.35 и 15.36). Парный тимус развивается у Xenopus из дорсального эпителия второго глоточного кармана. Эксперименты показывают, что предшественники лимфоидных клеток впервые проникают в эпителиальную закладку тимуса на 3-4 сутки развития. К седьмым суткам на лимфоидных клетках тимуса начинает появляться дифференцировочный антиген Т-клеток — маркер XNLA-I (120 кДа), распознаваемый антитимусными мышиными моноклональными антителами ХТ-I. Большинство тимоцитов экспрессирует Т-клеточные поверхностные антигены на 10 сутки развития, когда клетки-предшественники Т-лимфоцитов впервые удается идентифицировать на периферии. В ходе метаморфоза происходит новая волна колонизации стволовыми клетками, а затем инволюция тимуса. После метаморфоза количество тимоцитов вновь возрастает, достигая максимума к 15-16 месяцу развития. Эксперименты с проведением ранней тимэктомии Xenopus (на 4—5 сутки развития) отчетливо демонстрируют существование Т-зависимого (Тз) и Т-независимого (Тн) компонентов иммунитета (рис. 15.37). После такой ранней тимэктомии Т-клетки XT-I+ (а также Т-клетки CD4+и CD8+) уже не обнаруживаются в лимфоидных органах головастиков и взрослых особей, тогда как В-клетки с поверхностными IgM присутствуют в них в изобилии (рис. 15.38). Поэтому у животных данного уровня эволюции тимус, по-видимому, абсолютно необходим для созревания Т-клеток. Следует отметить, однако, что утимэкгомированных на ранней стадии развития Xenopus иногда происходит хроническое отторжение МНС-несовместимых кожных трансплантатов. После отторжения спленоциты этих особей при испытании в смешанной культуре лимфоцитов реагируют даже на клетки-стимуляторы, молекулы МНС которых отличаются от антигенов МНС исходного донора, но не отвечают на стимуляцию Т-клеточным митогеном ФГА. Природа таких аллореактивных клеток остается неизвестной.
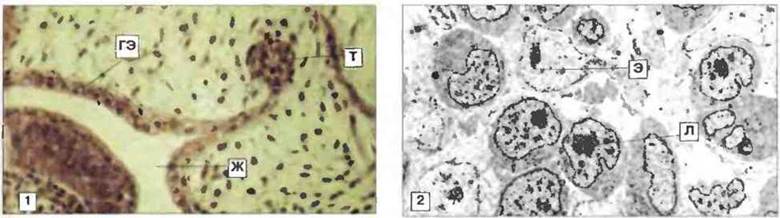
Рис. 15.35. Тимус Xenopus 3- и 7-суточного возраста. 1. На 3 сут развивающийся тимус (Т) все еще прикреплен к глоточному эпителию (ГЭ) и состоит в основном из эпителиальных клеток. Виден также жаберный карман (Ж). Окраска гематоксилином-эозином, х 100. 2. На 7 сут тимус содержит менее тысячи клеток двух основных типов: эпителиальные клетки (Э) с четко видимым ядрышком, дисперсным хроматином и бледноокрашивающейся цитоплазмой, а также лимфоидные клетки (Л) с большим количеством хорошо прокрашивающейся цитоплазмы и множеством свободных рибосом и митохондрий. К 7 суткам развития на лимфоидных клетках тимуса появляется маркер XT-1, а эпителиальные клетки начинают экспрессировать белки МНС класса II. Электронная микрофотография, х 500.

Рис. 15.36. Тимус Xenopus на 38 сут развития особи. Пигментированный парный тимус расположен позади глаз (вверху); у тимэктомированного на 7 сутки сибса отчетливо заметно его отсутствие (внизу).
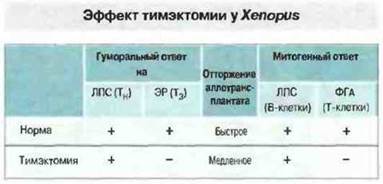
Рис. 15.37. У особей Xenopus, тимэктомированных на 4-6 сутки развития, исследовали гуморальный иммунный ответ, клеточный ответ на кожный аллотрансплантат и митогенный ответ in vitro. (ЛПС - липополисахарид; ЭР - эритроциты барана; ФГА - фитогемагглютинин; Тн - Т-независимый; Т3 - Т-зависимый.)
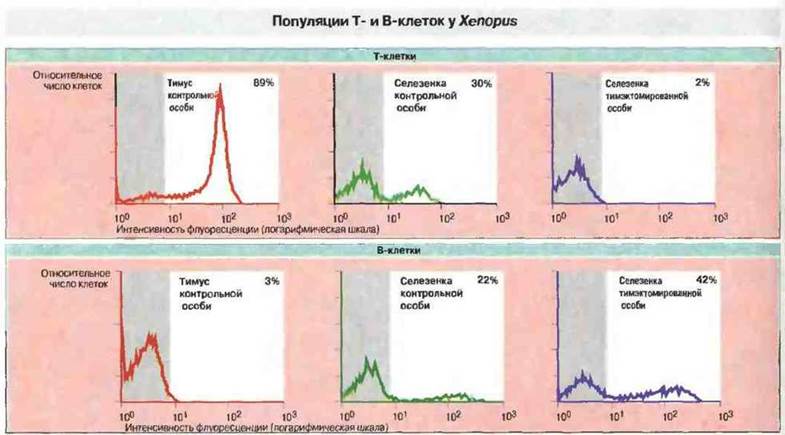
Рис. 15.38. Клетки тимуса и селезенки контрольной особи Xenopus (4-месячного возраста) и селезенки сибса, тимэктомированного в 7-суточном возрасте, сначала окрашивали либо мышиными анти-Т-клеточными (ХТ-1) моноклональными антителами (мАт), либо мышиными анти-В-клеточными (анти-IgM) мАт. Вторыми антителами служили меченные флуоресцеин-изотиоцианатом антитела к мышиному иммуноглобулину. Затем Т- и В-клетки выявляли при помощи флуоресцентного клеточного сортера. У головастика, тимэктомированнного на ранней стадии развития, исчезла Т-клеточная популяция ХТ-1+; ее заменило соответствующее количество В-клеток. Число, %, на каждом графике означает долю положительных клеток, т. е. представленных справа от свечения маркера (серая полоса) (исключение 98% фоновой флуоресценции).
Опыты с тимэктомией головастиков свидетельствуют о том, что для появления на периферии Т-клеток с разными функциями необходимо присутствие тимуса R разные сроки развития (рис. 15.39). Исследования на интактных особях показали, что реакция на аллогенные ткани (in vivo и in vitro) вместе со способностью спленоцитов реагировать на Т-клеточные митогены появляются на ранней стадии развития головастика, тогда как отчетливый IgY-ответ возможен только у взросло»! особи, с появлением хелперной функции Т-клеток.
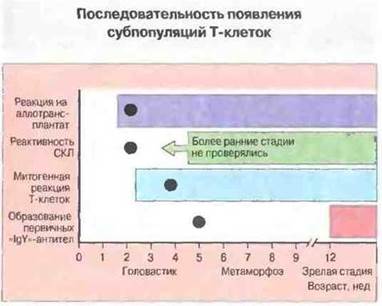
Рис. 15.39. Онтогенез иммунореактивности у Xenopus и эффект тимэктомии на разных стадиях развития. Реакция на аллотрансплантат, реакция в смешанной культуре лимфоцитов и митогенные реакции Т-клеток наблюдаются уже на ранних стадиях развития. Значительно позже появляются Тх-клетки, в частности обеспечивающие первичный «IgY»-ответ. (Кружками указан возраст, после которого тимэктомия уже не нарушает данную функцию.)
«Обучение» в тимусе включает у Xenopus положительную и ограниченную отрицательную селекцию. Чужеродный тимус, пересаженный лягушке после тимэктомии на ранней стадии развития, обеспечивает возможность дифференцировки клеток-предшественников реципиента по Т-клеточной линии (рас. 15.40). Соединяя переднюю часть 24-часового эмбриона, содержащую эпителиальную закладку тимуса, с задней частью МНС-несовместимого эмбриона, r которой образуются гемопоэтические стволовые клетки, в том числе лимфоциты, легко получить in vivoтимусы с эпителиальными и лимфоидными компонентами, экспрессирующими разные МНС-маркеры (рис. 15.41).

Рис. 15.40. Имплантация тимуса тимэктимированной особи Xenopus 1. Шпорцевую лягушку (X. laevis) тимэктомировали на 7 сутки развития и подкожно имплантировали ей тимус от головастика донора (X borealis), находящегося на поздней стадии развития. После метаморфоза обнаруживался прекрасный рост имплантата (И), лежащего рядом с левым глазом. 2. Срез имплантированного тимуса под флуоресцентным микроскопом. Клетки донора (Д) можно отличить от клеток реципиента, поскольку ядра X. borealis светятся яркими точками, тогда как клетки X. laevis - однородно зеленым цветом. Тимус заселен лимфоцитами реципиента, в то время как многие клетки стромы остаются «пятнистыми» (т. е. имеют донорское происхождение). Окраска хинакрином, х 300.

Рис. 15.41. Химерные лягушки. Химеры Xenopus были получены путем взаимной замены передних и задних частей двух эмбрионов через 24 ч после оплодотворения. На этой стадии закладка тимуса (т. е. его эпителий) находится в передней, а все предшественники лимфоцитов - в задней части эмбриона. Один эмбрион был от альбинотического варианта (с белой кожей и красными глазами), а другой от нормальной особи Xenopus. Эти химеры использовались для исследования «обучения» клеток в тимусе. (Фото любезно предоставлено д-ром М. Flajnik и д-ром L. DuPasquier.)
Обе эти экспериментальные модели были использованы для изучения роли стромальных клеток тимуса в процессе «обучения», включающего отрицательную селекцию (формирование толерантности Т-клеток к аутоантигенам) и положительную селекцию (рестрикция по специфическим антигенам МНС, с которыми преимущественно взаимодействуют хелперные и эффекторные популяции Т-клеток). Результаты таких экспериментов, проведенные на Xenopus, свидетельствуют об участии эпителия чужеродного тимуса в положительной селекции и индукции толерантности к кожным трансплантатам с МНС-специфичностью тимуса, хотя, что удивительно, эта толерантность не препятствует возникновению реакции смешанной культуры лимфоцитов на клетки донора тимуса. Аналогичные данные получены на зародышах птиц и млекопитающих. Однако считается, что у млекопитающих основную роль в отрицательной селекции (делеции Т-клеток, обладающих высоким сродством к собственным молекулам МНС) играют не эпителиальные клетки тимуса, а интердигитатные (дендритные) клетки его стромы, которые попадают в тимус извне.
Онтогенез аллоиммунореактивности/толерантности и продукции антител. Иммунные реакции на аллоантигены (МНС) и образование специфических антител «включаются» у головастиков одновременно с тем, как на периферии появляются необходимые популяции Т- и В-клеток (рис. 15.42): это может происходить, когда лимфоидная система содержит еще менее миллиона лимфоцитов. Иммунологическая память сохраняется в процессе метаморфоза, но связано ли это с переносом клеток памяти или с персистенцией антигена, неизвестно. Тем не менее иммунокомпетентных головастиков (но не взрослых особей) можно легко сделать толерантными к аллогенной коже; такая «аллотолерантность» особенно легко индуцируется в процессе метаморфоза (рис. 15.43). Решающее значение имеют при этом размеры трансплантата и степень гистонесовместимости. У Xenopus головастики и особи на стадии метаморфоза всегда толерантны к трансплантатам, молекулы МНС которых лишь незначительно отличаются от молекул МНС хозяина. Толерантность, индуцируемая у головастиков пересадкой чужеродной кожи или лимфоидной ткани, редко бывает «полной», поскольку и до, и после метаморфоза некоторые «ангидонорские» реакции (например, реакция СКЛ) сохраняются. В основе толерантности лежит, по-видимому, супрессия или анергия.
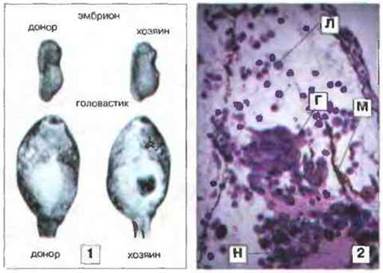
Рис. 15.42. Трансплантация эмбриональной ткани у Rаnа - онтогенез «аллоиммунитета». 1. Кусочек нервной складки, удаленный у эмбриона на стадии появления хвостового выпячивания, подсаживали в середину вентральной поверхности другого эмбриона (хозяина). С нервными складками тесно связаны элементы нервного гребешка, являющиеся предшественниками клеток различного типа, в том числе пигментных. Заметные пигментные клетки дают прекрасную возможность следить за судьбой эмбрионального трансплантата. У головастика-хозяина пигментные клетки из трансплантата образуют четко видимую массу. 2. На срезе (через 15 сут после трансплантации) видны дифференцированные элементы трансплантата, крупные ганглионарные клетки (Г) с отчетливыми ядрышками, другая нервная ткань (Н) и меланин (М). Несмотря на небольшой срок, лимфоциты и гранулоциты уже проникают в трансплантат (Л - лейкоцит). Окраска гематоксилином-эозином, х 100. (Фото любезно предоставлены д-ром Е. Volpe)
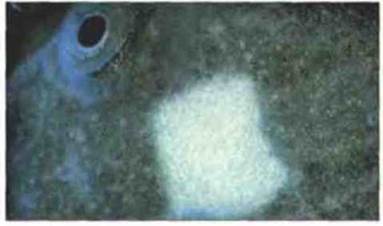
Рис. 15.43. Толерантность к кожному трансплантату у Xenopus. Реципиент на стадии головастика или метаморфоза может быть толерантным к аллогенным кожным трансплантатам, даже от МНС-отличающегося донора. Последующие кожные трансплантаты (здесь кусочек белой кожи брюшка) от того же донора точно так же приживаются у взрослой лягушки. Однако кожа другого донора через 3 нед (при 25 °С) отторгается.
Модельные системы для изучения источников происхождения лимфоидных клеток
Эксперименты с пересадкой цитогенетически отличающихся жаберных зачатков на эмбрионах Rana pipiens, Xenopus laevis и тритона Pleurodeles waltlii подтвердили, что лимфоциты тимуса развиваются у них, как и у гомойотермных животных, из клеток-предшественников, колонизирующих тимус извне. У Xenopus лимфоидные клетки-предшественники, которым предстоит попасть в тимус, происходят как из вентролатеральной (вентральные островки кроветворения), так и из дорсолатеральной мезодермальной пластинки эмбриона. У молодых особей Xenopus стволовые клетки заселяют тимус двумя волнами: одна наблюдается на ранней стадии развития головастика, вторая — на стадии метаморфоза, что, по-видимому, обеспечивает «обучение» зрелых Т-клеток в среде, где экспрессируются специфичные для взрослых особей антигены.
Установлено, что у Xenopus клетки некоторых гемопоэтических линий днфференцировки экспрессируют общий лейкоцитарный антиген CD45, обладающий тирозинфосфатазной активностью.
Метаморфоз предъявляет новые требования к иммунной системе
Чрезвычайно интересно выяснить, каким образом амфибии избегают гибели от аутоиммунных болезней при метаморфозе, поскольку в это время впервые появляются маркеры, специфические для зрелых клеток. Предстоит выяснить и роль впервые экспрессируемых при метаморфозе молекул МНС класса I, весьма вероятно выполняющих супрессивные функции. Вместе с тем во время метаморфоза наблюдается высокий уровень кортикостероидов в плазме и повышенная экспрессия кортикостероидных рецепторов на лимфоцитах. Такие гормональные сдвиги могут приводить к непосредственному подавлению клеточного иммунитета, возможно путем ингибирования продукции ИЛ-2. Метаморфоз у амфибий - очень удобный период для изучения взаимодействия нейроэндокринной и иммунной систем, и не только в филогенетическом аспекте.
Вопросы для размышления
■ Какие клеточные и гуморальные иммунные механизмы обнаружены у беспозвоночных?
■ Рассмотрите основные различия между иммунными системами беспозвоночных и позвоночных. Какие факторы эволюции могли привести к развитию иммунной системы, имеющейся у позвоночных?
■ Каким способом у различных позвоночных создается разнообразие антител?
■ Что известно об эволюции главного комплекса гистосовместимости и о связанном с ней филогенезе Т-клеток?
■ В чем состоят преимущества амфибии Xenopus laevis как объекта для изучения онтогенеза иммунной системы?
■ Какие основные пробелы существуют в наших знаниях об эволюции иммунитета? Какие подходы можно было бы предложить для выяснения этих вопросов?
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Beck G., Cooper E.L., Habicht G.S., Marchalonis J.J. (ed.). 1994. Primordial immunity: Foundations for the Vertebrate Immune System. Ann. NY Acad. Sci. 712: 1-376.
Clem L.W., Warr G. (ed.). 1994. Developmental and Comparative Immunology. Oxford: Pergamon Press. Vol. 18, suppl. 1: 1-164. Proceedings of the 6th Congress of Developmental & Comparative Immunology.
Cohen N., Sigel M.M. (ed.). 1982. The Reticuloendothelial System. Ontogeny and Phytogeny. New York: Plenum.
Cooper E.L. (ed.) 1996. Invertebrate immune responses: cells and molecular products. Adv. Comp. Environ. Physiol. 23.
Du Pasquier L. 1989. Evolution of the immune system. In: Paul W.E. (ed.). Fundamental Immunology. 2nd edn. New York: Raven Press. 139-65.
Du Pasquier L., Schwager J., Flajnik M.F. 1989. The immune system of Xenopus Annu. Rev. Immunol. 7: 251-75.
Du Pasquier L. 1993. Phytogeny of В cell development. Curr. Opm. Immunol. 5: 185-93.
Flajnik M.F. 1994. Primitive vertebrate immunity: what is the evolutionary derivation of molecules that define the adaptive immune system? In: Antimicrobial Peptides. Chichester: Wiley. CIBA Foundation Symposium 186: 224-32.
Flajnik M.F., Hsu E., Kaufman J.F. et al. 1987. Changes in the immune system during metamorphosis of Xenopus. Immunol. Today 8: 58-64.
Greenberg A.S., Avila D., Hughes M. etal. 1995. A novel antigen receptor gene family that undergoes rearrangement and extensive somatic diversification in sharks. Nature 374: 168-73.
Greenberg A.S., Hughes A.L., Guo J. et al. 1996. A novel chimeric antibody class in cartilagenous fish: IgM may not be the Primordial Immunoglobulin. Eur. J. Immunol. 26: 1123-29.
Horton J.D. Amphibians. 1994. In: Turner R.J. (ed.) Immunology: A Comparative Approach. Chichester: Wiley; 101-36.
Horton T.L., Ritchie P., Watson M.D., et al. 1996. NK-like activity against allogeneic tumour cells demonstrated in the spleen of control and thymectomized Xenopus. Immunol. Cell Bio. 74: 365-73.
Humphreys T., Reinherz E.L. 1994. Invertebrate immune recognition, natural immunity and the evolution of positive selection. Immunol. Today 15: 316-20.
Lackie A.M. (ed.) Immune Mechanisms in Invertebrate Vectors. Zoological Society of London Symposia, 56. Oxford: Oxford University Press, 1986.
Marchalonis J., Schluter S.F. 1994. Development of an immune system. In: Primordial Immunity: Foundations for the Vertebrate Immune System. Ann NY Acad. Sci. 712: 1-12.
Marsh J., Goode J.A. (eds.) 1995. Antimicrobial Peptides. Ciba Foundation Symposium. Chichester: Wiley; 186.
Miller N.W., McKinney E.C. In vitro culture of fish leukocytes. In: Biochemistry and Molecular Biology of Fishes, Bol. 3. Elsevier; 1994. 341-53.
Raison R.L., Coverley J., Hook J.W., et al. 1994. A cell surface opsonic receptor on leukocytes from the phylogenetically primitive vertebrate, Eptatretus stouti. Immunol. Cell. Biol. 72: 326-32.
Ratcliffe N.A., Rowley A.F. (ed.). 1981. Invertebrate Blood Cells Vol. 1 & 2. London: Academic Press.
Ratcliffe N.A., Rowley A.F. (ed.), Fitzgerald S.W. et al. 1985. Invertebrate immunity: basic concepts and recent advances. Int. Rev. Cytol. 97: 183-350.
Robert J., Guiet C., Du Pasquier L. 1994 Lymphoid tumors of Xenopus laevis with different capacities for growth in larvae and adults. Devel. Immunol. 3: 297-307.
Rowley A.F., Ratcliffe N.A. (ed.). 1988. Vertebrate Blood Cells. Cambridge: Cambridge University Press.
Secombes C.J. The phytogeny of cytokines. In: Thomson A.W. (ed.). The Cytokine Handbook. London: Academic Press; 1991. 387-412.
Secombes C.J. 1994. Enhancement of fish phagocyte activity. Fish Shellfish Immunol. 4: 421-36.
Smith L.C., Davidson E.H. 1992. The echinoid immune system and the phylogenetic occurrence of immune mechanisms in deuterostomes. Immunol. Today 13: 356-62.
Soderhall K., Iwanga S., Vasta GR. (ed.). 1996. New Directions in Invertebrate Immunology. Fair Haven: SOS Publications 1-494.
Stewart J. 1992. Immunoglobulins did notarise in evolution to fight infection. Immunol. Today 13: 396-9.
Stolen J.S., Fletcher T.C., Bayne C.J. (eds.). Modulators of Immune Responses, The Evolutionary Trail. Fair Haven: SOS Publications; 1996. 1-600.
Turner R.J. (ed.). Immunology: A Comparative Approach. Chichester: Wiley, 1994.
Warr G. 1995. The immunoglobulin genes of fish. Devel. Comp. Immunol. 19: 1-12.
Warr G., Cohen N. (ed.). Phylogenesis of Immune Functions. Oxford: CRC Press, 1991.