БІОНЕОРГАНІЧНА ТА БІООРГАНІЧНА ХІМІЯ - М.В. Яцков - 2014
II. ПРЕДМЕТ, ЗАВДАННЯ, МЕТОДИ ТА ОСНОВНІ НАПРЯМКИ ДОСЛІДЖЕНЬ БІООРГАНІЧНОЇ ХІМІЇ
2.4. Білкові речовини
2.4.3.Білки
Білки - високомолекулярні органічні сполуки, що побудовані із залишків α-амінокислот, які з’єднані між собою пептидними зв’язками в довгі поліпептидні ланцюги, прямі і закручені. Вони становлять структурну та функціональну основу кожного живого організму, оскільки з їх діяльністю пов’язано існування живої матерії.
В організмі білки виконують життєво важливі функції: структурну, захисну, каталітичну, транспортну, енергетичну, регуляторну, спадкову тощо. З діяльністю білків пов’язано живлення, подразливість, скорочення, ріст, розвиток, розмноження, регуляція свого хімічного складу та функцій, пристосування до зовнішнього середовища і смерть, тобто всі прояви життя. Білки -необхідний продукт харчування людини (в середньому раціон повинен містити щоденно 80-400 г/добу), є сировиною для харчової, легкої та хімічної промисловості.
Білки складають 45-50% сухої маси живого організму. Це і було причиною їх першої наукової назви - «протеїн» (грец. Protos - перший, найважливіший). Для білків характерний постійний елементарний склад. Так, білкова молекула містить: Карбону - 50,654,5%, Оксигену - 21,0-23,5%, Нітрогену - 15-19%, Гідрогену - 6,57,5%, Сульфуру - 0,3-2,5%, Фосфору - 0,0-2,0%, Феруму - 0,0-0,4% тощо.
Рівні структурної організації білкової молекули
Розрізняють чотири рівні структурної організації білкової молекули - первинний, вторинний, третинний і четвертинний.
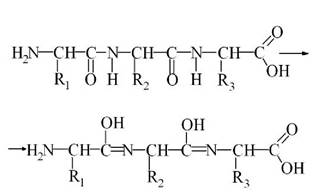
Первинна структура молекули білка визначається кількістю та послідовністю амінокислотних залишків у ній, які з’єднані між собою пептидними зв’язками.
Складніша первинна структура білкової молекули наведена нижче. В схемі бокові групи показано літерою R. Такими групами можуть бути бокові відгалуження самих амінокислот, пептидів і поліпептидів:

Вторинна структура молекули білка формується за рахунок водневого зв’язку ланцюга між групами -NH- і -СО- даного поліпептидного ланцюга, що приводить до упорядкованого розміщення в просторі поліпептидного ланцюга у вигляді спіральної або складчастої структури.
Третинна структура молекули білка утворюється внаслідок взаємодії між боковими відгалуженнями поліпептидних ланцюгів.
Це призводить до формування водневих, дисульфідних, йонних (сольових), вандерваальсових та інших зв’язків. Поліпептидні ланцюги згортаються в певному порядку, що приводить до утворення просторової конфігурації білкової молекули.
Четвертинна структура білкової молекули є асоціацією (сполукою) декількох субодиниць поліпептидної природи, що мають власну первинну, вторинну і третинну структури, або глобул, що з’єднані у єдину складну молекулу. Такі субодиниці називають протомерами, а їх комплекс - мультимером.
Фізичні та хімічні властивості білків
Більшість білків - тверді аморфні та кристалічні речовини. Деякі з них зберігають природну форму (наприклад, кератин вовни). Окремі білки мають консистенцію в’язких рідин (наприклад, альбуміни і глобуліни сироватки крові). Більшість білків добре розчиняється у воді і утворює колоїдні розчини, вони розчиняються в лужних і кислих розчинах.
За формулою молекул білки поділяють на фібрилярні (ниткоподібні) і глобулярні (кулясті). Представником перших може бути фіброїн шовку, других - альбумін сироватки крові. Є і перехідні форми, тобто молекула білка змінює форму залежно від функціонального стану органу та організму (наприклад, актоміозин м’язевої тканини).
Білки - високомолекулярні сполуки, їх молекулярна маса коливається у діапазоні від кількох тисяч (наприклад, інсулін - 5700) до сотень мільйонів (білок вірусу грипу - 322 млн.). Розчини білків оптично активні - вони обертають площину поляризації ліворуч.
Біуретова реакція на виявлення пептидних зв’язків в білках
Білки (поліпептиди) в лужному розчині у присутності купрум(ІІ) сульфату утворюють комплексні сполуки купруму, що мають синьо- фіолетове забарвлення, інтенсивність якого залежить від кількості пептидних зв’язків в молекулі білка.
Спочатку пептидні групи поліпептиду зазначають в лужному середовищі енолізацію:
Фенольна форма поліпептиду взаємодіє з купрум(ІІ) гідроксидом утворюючи забарвлений у синьо-фіолетовий колір комплекс:
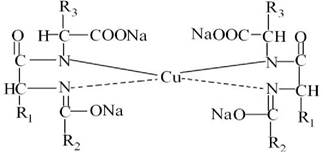
Продукти неповного гідролізу білка (пептиди) дають червоне або рожеве забарвлення у біуретовій реакції.
Класифікація білків
Відомо близько 3000 індивідуальних білків, їх поділяють на прості білки, або протеїни, та складні білки, або протеїди. Молекули протеїнів внаслідок гідролізу розщеплюються переважно до а-амінокислот, протеїдів - на простий білок, який, в свою чергу, - до а-амінокислот, і простетичну (небілкову групу). Протеїни і протеїди поділяють на підгрупи залежно від властивостей, будови молекули та біологічного значення. Група протеїнів включає такі підгрупи.
Альбуміни (лат. albumen, albumis - білок) - прості білки, що містяться в крові, лікворі, зерні рослин та мікроорганізмах. До них відносяться лактоальбумін (білок молока), сироватковий альбумін (білок сироватки крові), легумелін гороху, лейкози пшениці.
Глобуліни (лат. globules - кулька) - прості білки, молекули яких мають кулясту форму. Розрізняють сироваткові, молочні, яєчні глобуліни. До них відносяться міозин, тиреоглобулін, нейроглобулін, нейростромін, едестин коноплі, гліциній сої, фазеолін квасолі. Глобуліни складають близько 90% білків, які екстрагуються з тканин.
Гістони (грец. histos - тканина) - прості білки основного характеру, що містяться переважно в ядрах клітин людини, тварин і рослин. Гістони стабілізують вторинну структуру ДНК, беруть участь у регуляції біосинтезу ДНК і РНК.
Глутеліни (лат. gluten - клей) - прості рослинні білки (глутеїн пшениці, жита, кукурудзи, вівса, оризенін пшениці). Разом з проламінами утворюють клейковину борошна.
Гемоглобін - червоний ферумвмісний білок еритроцитів. До складу молекули гемоглобіну входять чотири субодиниці, кожна з яких складається з молекули простого білка глобіну і простетичної групи гема. Гемоглобін у складі еритроцитів транспортує кисень від легень до тканин і клітин всього організму, а вуглекислоти - до легень.
Глікопротеїди - складні білки, молекули яких при гідролізі розщеплюються на простий білок і вуглеводну простетичну групу (її частина в загальній масі - близько 80%). Містяться у всіх органах і тканинах людини і тварин, а також рослин. Простетичні групи в складі молекули глікопротеїду забезпечують конформацію, найвигідніше розміщення в клітині, транспортування, захист від протеолізу і імунні властивості. До таких білків відносяться білки крові (церулоплазмін, трансферин, фібриноген, імуноглобуліни тощо), білки секретів слизових залоз (муцини), опірних органів і тканин (мукоїди), деякі ферменти (панкреатична РНКаза), гормони (еритропоетин, тиреотропін), структурні білки клітинних мембран. Останні беруть участь у йонному обміні, імунних реакціях, міжклітинній адгезії тощо.
Еластин (грец. elastikos - гнучкий, пружний, розтяжний) - опірний білок сполучної тканини (зв’язки, сухожилля, судини тощо), не розчиняється у воді. Молекулярна маса досягає 10000.
Казеїн утворюється з казеїногену молока після відщеплення при згортанні молекули білка пептиду. Казеїн - важлива поживна речовина для харчування людини і годівлі тварин (особливо молодняку), сировина для одержання пластиків, фарб, клеїв тощо.
Кератини (грец. keras - keratus - ріг) - прості білки, похідні шкіри (вовни, волосся, рогів, копит, копитець, пір’я тощо), не розчинні у воді, лугах та кислотах.
Колагени (грец. kolla - клей і genes - народження) - фібрилярний білок, що становить третину всіх білків тваринного організму. При кип’ятінні колагену утворюється желатин.
Желатин застосовують у харчовій промисловості, при виготовленні фотографічних матеріалів, як живильне середовище для мікроорганізмів.
Ліпопротеїди - складні білки, молекули яких при гідролізі розщеплюються на прості білки і ліпіди. Ліпопротеїди - структурна основа біологічних мембран. Деяка кількість ліпопротеїдів у вільному стані є в крові.
Міоглобін - червоний ферумвмісний пігмент. Молекула складається із однієї групи гема та однієї молекули глобіну. Міоглобін депонує у м’язевій тканині кисень і передає його відповідним ферментним системам. У м’язах наземних тварин приблизно 10% всього кисню зв’язано з міоглобіном, у людини - 14%, а у морських тварин (дельфіна) - до 40%. Молекулярна маса міоглобіну - 17000. Він переносить до органів, тканин і клітин кисень і забирає вуглекислоту.
Складні білки, або протеїди, поділяють на такі підгрупи. Нуклеопротеїди - складні білки, молекули яких при гідролізі (ферментативному або кислому) розщеплюються до простих білків (гістонів і протамінів, зрідка - альбумінів і гістонів) і нуклеїнових кислот (ДНК і РНК).
Розрізняють дезоксирибонуклепротеїди (ДНП) і рибонуклопротеїди (РНП). За функціональним значенням ДНП відповідає за збереження і передачу спадкової інформації, РНП - за біосинтез білка.
Пепсин - фермент шлункового соку. Пепсин гідролізує більшість внутрішніх пептидних зв’язків у молекулах білків і пептидів.
Протаміни - прості білки основного характеру, складова частина молекул нуклеопротеїдів. Значна кількість протамінів міститься в багатьох органах людини і тварин. До них відноситься сальмін лосося, глупеїн оселедця, стурін осетра, галін курей.
Проламіни - прості білки рослинного походження з високим вмістом проліну і амінного Нітрогену. До них відносяться гліадин пшениці, гордеїн ячменю, зеїн кукурудзи, аверин вівса, оризин
рису, каферин сорго. У зерні пшениці гліадин і глутеїн становлять основу клейковини, що зумовлює хлібопекарські якості борошна.
Протеіноїди, або склеропротеїни (грец. sclerosis - затвердіння) - прості білки, що виконують опорні функції у тваринному організмі.
Фіброїн (лат. fibra - волокно) - простий білок шовкової нитки, що виробляється шовковидільними залозами шовкопряда.
Фосфопротеїди - складні білки, молекула яких при гідролізі розщеплюється до молекули простого білка і ортофосфатної кислоти НзРО4.
Типовим представником підгрупи є казеїн молока (молоко корови містить казеїну в середньому 3,2%, кози - 3,8%, вівці - 5,1%) і пепсин шлункового соку.
Хромопротеїди (грец. chroma - колір, забарвлення + протеїд) - складні білки, молекули яких при гідролізі розщеплюються на забарвлені простетичні групи та простий білок. Найбільше значення у житті людини і тварин належить двом хромопротеїдам - гемоглобіну і міоглобіну, для рослин - хлорофіл.
Хлорофіл — зелений магнійвмісний білок. Є два типи хлорофілу: а-хлорофіл C55H72О5N4Mg і β - C55H70O6N4Mg. В основі лежить протопорфірин, який зв’язаний двома основними і двома допоміжними валентними зв’язками з магнієм. Хлорофіл є складним естером двохосновної кислоти та двох спиртів - метанолу та фітолу. Хлорофіл відіграє важливу роль в процесах фотосинтезу зелених рослин.