Практическая химия белка - А. Дарбре 1989
Аналитические методы
Фосфорилированные аминокислоты
Методы анализа
8.11.2.1. Тонкослойная хроматография.
1. На пластинках со слоем целлюлозы MN-300. Элюэнт: бутанол — изопропанол — муравьиная кислота — вода (3:1:1:1) ([358], детали не приведены).
2. На полиамидных пластинках (фирма Cheng-Chin). В одном направлении хроматографируют в 5%-нон пропионовой кислоте, содержащей 0,013—0,025% ДСН. Высушивают и опрыскивают 0,2%-ным раствором нингидрина, нагревают в термостате при 50 °С под наблюдением. Thr(P) и Ser(P) мигрируют вместе, Rf = 0,70; Туr(Р) = 0,54.
8.11.2.2. Электрофорез [42, 169]. Буфер pH 1,9: ледяная уксусная кислота — муравьиная кислота (88%-ная) — вода (78:25: :897); буфер pH 3,5: ледяная уксусная кислота — пиридин — вода (50:5:945). Пиридин очищают 18-часовым кипячением над n-толуолсульфохлоридом и затем перегоняют.
Используют тонкослойные пластинки (фирма Brinkman, Polygram CEL MN-300, 200X200 мм, 0,1 мм). Растворяют образец в буфере pH 1,9 и проводят электрофорез при pH 1,9, 1,5 кВ, 75 мин по направлению к аноду. После высушивания проводят электрофорез во втором направлении в буфере pH 3,5, 1 кВ, 1 ч. Сушат пластинку, опрыскивают буферным раствором, содержащим 0,1% нингидрина (разд. 8.14.2). Туr(Р) дает серое окрашивание; Ser(P) и Thr(P)—голубое. В случае радиоактивных препаратов используют авторадиографию.
Стандартные растворы: смесь по 0,5 мкл растворов нейтрализованных фосфоамииокислот (20 мг/мл). На рис. 8.2 показано положение пятен фосфоаминокислот после двумерного электрофореза.
8.11.2.3. Аминокислотный анализатор [51]. Используют короткую колонку (по Муру и Стейну) (80X6,0 мм), упакованную смолой фирмы Durrum DC6A. Растворяют образец в 0,01 М ТФУ с немечеными стандартами фосфоаминокислот (1,5 нмоль каждой) или без них и наносят на колонку. Элюирование в изократическом режиме при 50 °С 0,01 М ТФУ со скоростью потока 0,4 мл/мин. При флуориметрическом определении фракции обрабатывают ОФА-реагентом (разд. 8.16.3.2) (скорость потока 0,2 мл/мин) в специальном смесителе. При работе с [32Р] меченным образцом ОФА-реагент заменяют на воду и собирают фракции по 1 мл для измерения радиоактивности.
Приблизительные величины времен удерживания: Ser(P) 19 мин Thr(P) 28 мин, Туr(Р) 64 мин. Цистеиновая кислота выходит в свободном объеме, другие аминокислоты не элюируются.
Регенерируют колонку, пропуская через псе следующие растворы:
1) 1,0 M по Na+ (34,8 г NaCl + 39,2 г тринатриевой соли лимонной кислоты на 1 л воды с добавлением 1 мл фенола для подавления роста бактерий);
2) 0,2 М NaOH;
3) 1 М ТФУ;
4) 0,01 М ТФУ.
Результаты количественного анализа. Выходы для стандартных образцов фосфоаминокислот (по измерению флуоресценции) составили: Ser(P) 88%, Туr(Р) 71% относительно выхода Thr(P), принятого за 100%, и соответственно Thr(P) 89%, Ser(P) 71% и Туr(Р) 71% относительно выходов их нефосфорилированных аналогов.
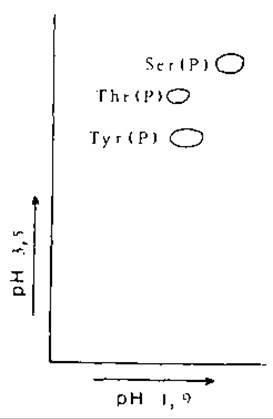
РИС. 8.2. Двумерное разделение электрофорезом фосфоаминокислот: в нервом направлении при pH 1,9, во втором направлении при pH 3,5 [43].
8.11.2.4. Жидкостная хроматография под высоким давлением.
1. Анионообменная колонка (фирма Ultrasil Ах, 250X4,6 мм, Beckman), уравновешенная 15 мМ К-фосфатным буфером (pH 3,8). Наносят образец и элюируют тем же буфером в течение 25 мин, скорость потока 2,0 мл/мин. Нерадиоактивные соединения детектируют измерением поглощения при 206 нм. Приблизительные времена удерживания: Thr(P) 6 мин; Ser(P) 8,6 мин; Туr(Р) 9 мин и Рt 10,5 мин [358].
2. Анионообменная колонка (Synchrom Ах-300, 250X4,6 мм). Элюирование фосфатным буфером (как и в пункте 1), скорость потока 1 мл/мин. Фракции элюата обрабатывают ОФА [213] и измеряют поглощение при 338 нм или радиоактивность на жидкостном сцинтилляционном счетчике. Времена удерживания: Thr(P) 12 мин; Scr(P) 17 мин; Туr(Р) 23 мин (J. Downward, частное сообщение).
3. Колонка (250X4,6 мм) с анионообменной смолой Partisil-10 SAX (фирма Whatwan). Наносят образец и элюируют 10 мМ К-фосфатным буфером (pH 3,0), содержащим 10,5% метанола, скорость потока 1 мл/мин, температура комнатная. Обнаружение с помощью обработки ОФА. Приблизительные времена удерживания: Thr(P) 26 мин; Туr(Р) 32 мин; Ser(P) 38 мин; Pi 60 мин [413].
4. Дансилирование и ВЭЖХ ДНС-фосфоаминокислот [77]. Гидролизуют белок 2 ч при 110 °С концентрированной соляной кислотой (фирма Pierce), yпаривают в потоке азота. Приливают 100 мкл 0,2 М Nа2СО3 и снова упаривают. Суспендируют образец в 100 мкл воды и добавляют 100 мкл свежеприготовленного раствора дансилхлорида (2,5 мг ДНС-Сl на 1 мл ацетона). Инкубируют в темноте 1 ч при 37 °С. Высушивают досуха в потоке азота. Для анализа методом ВЭЖХ растворяют ДНС-производные в 100 мкл 0,5%-ной ТФУ.
ВЭЖХ на колонке Protesil 300 (фирма Whatman). Промывают колонку раствором вода — ТФУ (1000:1) или смесью вода — ацетонитрил — ТФУ (970:30:1). Элюируют в режиме линейного градиента: 30 мл раствора вода — ацетонитрил — ТФУ (970:30:1) + 30 мл раствора вода — ацетонитрил — ТФУ (900:100:1). Измеряют поглощение элюата при 280 нм. Собирают радиоактивные фракции для измерения на счетчике. Приблизительные времена удерживания: Ser(P) 12 мин, Thr(P) 16 мин и Туг(Р) 22 мин.
ВЭЖХ на микроколонке Bondapak C18(фирма Waters). Элюирование в изократическом режиме раствором вода — ацетонитрил — ТФУ (925:75:1). Приблизительные времена удерживания: Ser(P) 15 мин, Thr(P) 22 мин, Туг(Р) в элюате не обнаружен.
5. Ионопарная ВЭЖХ фосфоамиокислот на обращенной фазе [1, 268]. Колонка (150 мХ4,6 мм) с Partisil 5 ODS2. Элюируют при комнатной температуре смесью 0,5 мМ гидроксид тетрабутиламмония — 0,5 мМ о-фталат, pH 6,3, скорость потока 1 мл/мин. Детекция при 243 им, шкала на 0,1 сд. опт. пл., чувствительность 200 пмоль. Приблизительные времена удерживания: Asp и Glu 5,3 мин; Pt 6,9 мин; Thr(P) 11,6 мин; Scr(P) 12,8 мин; Туr(Р) 15,9 мин.