Практическая химия белка - А. Дарбре 1989
Методы твердофазного анализа аминокислотной последовательности
Методы присоединения
Присоединение лизилсодержащих пептидов с помощью ДИТЦ
Пептиды, содержащие остатки лизина, расположенные как внутри цепи, так и па С-конце полипептида, а также пептиды, содержащие аминоэтилцистеин, могут быть эффективно присоединены своими свободными аминогруппами к смолам на основе полистирола или к аминопропильным стеклам (АПС или ß-АПС) при помощи ДИТЦ (рис. 12.3). Разновидностью «ДИТЦ-метода» является использование бифункционального реагента — лактона N-(n-изотиоцианатобензоил)-DL-гомосеринa для присоединения лизилсодержащих пептидов к носителям па основе стекла, содержащим аминогруппы. Сообщается о высоких выходах присоединения [21].
12.4.1.1. Методики присоединения.
Преимущества, Выходы в реакциях присоединения обычно очень высокие (80—90%). При сравнении различных полистирольных носителей в реакции Эдмана пептидиламинополистирол дает наименьший выход побочных продуктов. Ранее для присоединения небольших пептидов (содержащих 25—30 аминокислот) наилучшим носителем считался аминополистирол, тогда как более длинные пептиды и белки связывали преимущественно со стеклами (аминопропилстекло или ß-аминопропилстекло). В настоящее время разработаны методы присоединения пептидов меньшего размера к стеклянным носителям (разд. 12.4.2— 12.4.4).
Ограничения.
1. Условия присоединения могут вызвать снижение растворимости некоторых пептидов, ведущее к низким выходам присоединения. Для предотвращения потерь следует проводить контрольные испытания во время и после завершения процесса присоединения (разд. 12.4.5). Некоторые из пептидов, нерастворимые в буфере для присоединения (его состав приведен ниже), можно растворить добавлением пиридина или ДМФА. Если это не помогает, то растворимость образца можно повысить изменением pH буфера (от 7,5 до 10). Иногда пептиды становятся растворимыми после предварительной обработки ТФУ и высушивания. Проблему растворимости помогает решить проведение конденсации в безводных условиях (ДМФА — триэтиламин) [60]. Лизилсодержащие пептиды можно также присоединять к аминополистиролу конденсацией с карбодимидом (КДИ) при pH 3—5 (разд. 12.4.4).
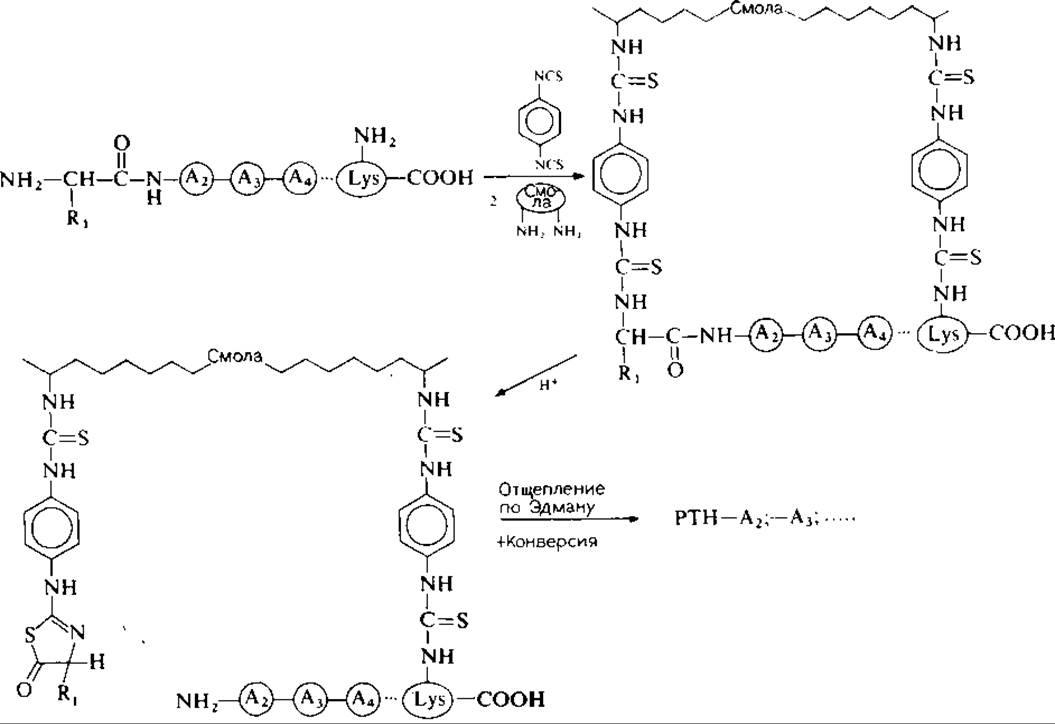
РИС. 12.3. Присоединение пептидов к носителям, содержащим аминогруппы; активация а- и ε-аминогрупп пептидов n-фенилендиизотиоцианатом.
2. N-концевые аминокислоты и остатки лизина после отщепления от пептидной цепи остаются ковалентно связанными с носителями, поэтому их нельзя идентифицировать. Однако в случае неполного присоединения N-концевых аминокислот к смоле (стеклу) среди продуктов отщепления обнаруживают в небольших количествах ФТГ-производные N-концевых аминокислот. Обычно после пришивки пептида к носителю для блокирования оставшихся свободных аминогрупп смолы (стекла) используют метилизотиоцианат (МИТЦ). В этом случае образуется метилтиогидантоин (МТГ) первой аминокислоты [28]. Мы заменили МИТЦ на ФИТЦ, поэтому N-концевая аминокислота может быть определена в виде обычного ФТГ-производного. При анализе на макроуровне такая обработка не влияет на выходы отщепления при условии, что использовался перегнанный ФИТЦ.
3. ДИТЦ-метод неприменим в случае пептидов, имеющих С-концевой Arg, поэтому остаток Arg гидразинолизом превращают в Оrn [28, 45]. Однако при гидразинолизе часто наблюдается расщепление пептидных связей внутри молекулы, например по остаткам Asn, что усложняет интерпретацию результатов отщепления аминокислот. Поэтому ДИТЦ-метод не рекомендуется использовать для пептидов, содержащих С-концевой Arg.
Методика присоединения. Конденсацию с аминополистиролом или со стеклянными носителями, содержащими аминогруппы, проводят при pH 9,5 по методике, описанной в работах [28, 59], или по модифицированной методике [30, 55, 61].
Емкость носителей: 1—3 нм пептида/мг полимера или 1 нм/мг стекла.
10—100 нмоль обессоленного пептида переносят в стеклянную пробирку (размер 5х130 мм) и высушивают в вакууме (масляный насос), предпочтительно в концентраторе (фирма Savant) или в эксикаторе; пептид можно также лиофилизовать. Растворяют пептид под азотом в 50 мкл буфера для присоединения (разд. 12.2.5). Проверяют pH (>9,0) и растворимость пептида. Отбирают аликвоту (2—5 мкл) для контроля методом ТСХ (разд. 12.4.5.1). Добавляют 1,0 мг ДИТЦ (5 мкм) в 100 мкл ДМФА, перемешивают под азотом 30 мин при 50 °С. В пожелтевшем растворе не должно быть осадка.
30—50 мг аминополистирола (или 100 мг аминопропилстекла) промывают ДМФА, оставляют набухать в 200 мкл ДМФА в течение 15 мин при комнатной температуре. Затем носитель двумя порциями добавляют к пептиду, предварительно активированному ДИТЦ. Перемешивают смесь под азотом 60 мин при комнатной температуре. Для удаления избытка аминогруппы носителя добавляют 100 мкл раствора ФИТЦ и 100 мкл буфера (разд. 12.2.6), перемешивают под азотом 60 мин при 30 °С, центрифугируют. Жидкость над осадком проверяют на содержание исходного пептида (разд. 12.4.5.2). Промывают носитель метанолом (3 раза по 8 мл), центрифугируют, сушат в вакууме. При использовании аминополистирола последний смешивают с 900 мг стеклянных шариков (разд. 12.2.3); такой смешанный носитель упаковывают в колонку.